S I P I-4 0树脂富集分离大蒜绿变色素的研究
赵晓丹,曹雁平,张 禄
(1.北京工商大学北京市食品添加剂工程技术研究中心,北京100048;2.东北林业大学林学院,黑龙江哈尔滨150040)
大蒜绿变是一种常见的加工现象。长期的生活实践证明,大蒜绿变物质对人体是安全的,但绿变物质具体为何种物质尚属未知。近年来,一些学者对大蒜绿变机理及绿变物质进行了相关研究。一些研究对绿变产物的组成和性质进行了探索,目前认为绿变色素由蓝色素和黄色素两种成分混合组成,故而呈现绿色,其紫外可见吸收峰在440nm和590nm[1]。有学者在部分纯化的基础上对色素的结构进行了推测,认为大蒜绿色素可能是一种含氮类色素,性质与花青素有许多相似之处,具有多个吡咯环,含有一个硫原子[2],当吡咯环的聚合度增加时,其颜色由紫红向蓝、绿、黄方向改变[3]。目前认为大蒜绿变过程是大蒜中丙烯基半胱氨酸亚砜在酶类(蒜氨酸酶和γ-谷氨酰转肽酶)作用下转化为硫代磺酸酯[4-5],而后与氨基酸[6-7]等物质反应形成了绿变产物,可见绿变产物可能是由含硫化合物转化而来。还有的学者试图对色素进行人工合成[8],以期从另一个角度揭示其结构信息,同时也为绿变色素的开发利用奠定基础。在绿变物质的研究过程中,常需要对色素进行提取、浓缩及多次纯化等处理来获得高纯度色素提取物,再对其深入研究,因此提高色素提取物的制备效率尤为必要。研究显示SephadexLH-20[1-9]等进口分离介质对色素的分离效果较为理想但易被污染,从而影响分离效果,在其之前最好进行初级分离除去杂质,才能保证这类介质的分离效率和使用寿命。大孔树脂成本低,处理量大,操作条件温和,本研究采用SIPI-40大孔树脂直接对色素水提取液进行吸附分离,通过实验优化确定了分离操作条件,通过大孔树脂的吸附富集作用,可以快速的将绿变物质与大多数杂质分离,减少了对后续分离的干扰;同时保持绿变产物的性质,并达到浓缩的目的。是一种高效快速制备绿变色素提取物的方法。
1 材料与方法
1.1 材料与仪器
新鲜紫皮大蒜 购于当地超市;大孔树脂AB-8、NKA-9及S-8 购于南开大学化工厂;SIPI-40 为上海华震公司产品;其他常规化学试剂 均为国产分析纯。
UV 762紫外/可见分光光度计 为上海精密科学仪器有限公司产品;FD-1E-50冷冻干燥机 为北京博医康实验仪器有限公司产品。
1.2 实验方法
1.2.1 大蒜绿变色素粗提液的制备 将大蒜用5%醋酸室温浸泡约一周,待大蒜变成蓝绿色取出做实验原料。将绿变大蒜打碎,用80%乙醇提取∶料液比(1∶5),提取温度25℃,提取时间5h;提取两次,合并提取液。将提取液真空旋转蒸发浓缩,浓缩液用乙酸乙酯萃取两次,静置分层后弃去上层,留取下层色素浓缩液备用[1]。用蒸馏水稀释色素浓缩液,调节其吸光值A590在0.5~0.6之间,即得树脂纯化实验中的色素粗提液试样;以A590作为粗提液中绿变色素浓度的衡量指标。
1.2.2 大孔树脂的筛选 每种树脂准确称取5g,加入制备好的色素提取液50mL,于100mL三角瓶中,置于摇床振荡24h(25℃,100r/min),过滤,测定滤过液吸光值A5901;吸附前色素粗提液吸光值记为A5900;用蒸馏水洗涤树脂表面,再各用50mL 90%乙醇溶液于相同条件下解吸,过滤,测定解吸液吸光值记为A5902。吸附率及解析率计算公式如下[10]:

1.2.3 大孔树脂纯化绿变色素的条件优化 将预处理后的SIPI-40树脂装入1cm×30cm的柱中,树脂柱床体积(BV)20mL,待柱平衡后,取一定量按前述方法制备的色素粗提液,在不同条件下通过树脂柱,以确定最佳的上样体积、上样流速、洗脱剂浓度和洗脱剂体积。
1.2.3.1 最佳上样体积 将色素提取液以1mL/min流速通入树脂柱,同时收集透过液,每5mL为一管,测定每管透过液的A590,以其为纵坐标,以透过液体积为横坐标,绘制吸附曲线[11],根据曲线确定最佳上样量。
1.2.3.2 最佳上样流速 取五份体积为2BV的色素提取液,分别以0.5、1、1.5、2及2.5mL/min的流速通入树脂柱,收集透过液并测定其A590,计算不同流速下的吸附率,确定上样流速。
1.2.3.3 洗脱剂浓度 各取2BV的色素提取液上柱,吸附1h,然后用3BV的蒸馏水洗脱,再分别用20%、40%、60%、80%、90%乙醇溶液及含0.1%HCl的90%乙醇溶液乙醇洗脱4BV,收集洗脱液,浓缩至2BV,测定洗脱液A590,计算解吸率。
1.2.3.4 洗脱曲线绘制 取2BV的色素提取液溶液上柱,流速1ml/min,先用3BV的蒸馏水洗脱,再用酸化的90%乙醇进行洗脱,每5mL收集一管,并测定各管洗脱液A590,以洗脱液体积为横坐标,各收集管中洗脱液A590为纵坐标,绘制洗脱曲线,收集色素富集区域的洗脱液,即为色素纯化物;将这部分色素纯化物浓缩冻干,得干燥的色素粉末,-20℃保存。
1.2.4 色素提取物纯度的评价 由于大蒜绿变色素的结构尚未明晰,无法通过与标准品对照来准确定量,其提取物的纯度通常以色价来衡量。色价的测定过程及计算方法依据参考文献进行[10]。具体如下:称取纯化前色素粗提物及纯化物固态样品各0.05g,用pH3.0的HCl溶液溶解,定容至100mL。取1cm比色皿,以HCl溶液为空白,在波长590nm下测定吸光度A。
色价的计算公式如下:
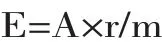
式中:A,样品的吸光度;r,稀释倍数;m,样品的质量(g);E,色价。
2 结果与讨论
2.1 大孔树脂的筛选结果
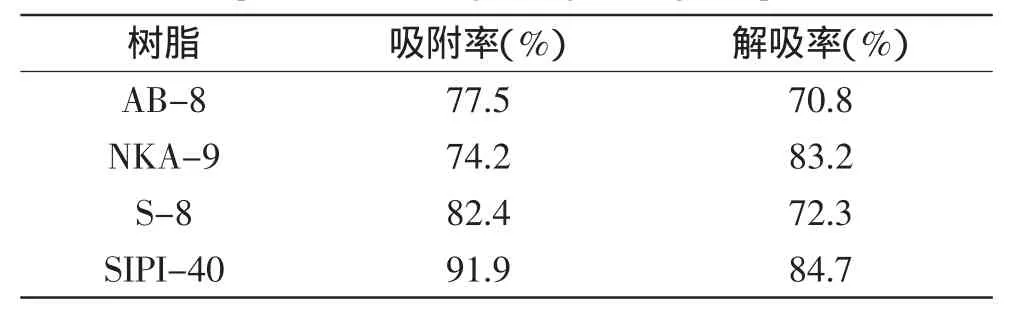
表1 不同大孔树脂对绿变色素的吸附及解吸效果Table 1 Absorption and desorption capabilities of different macroporous resin to garlic greening compounds
树脂对色素的吸附效率的不同与树脂本身的性质有关。S-8属于强极性树脂,NKA-9、SIPI-40树脂属于中等极性树脂,AB-8属于弱极性树脂。前期研究表明,绿变色素属中等极性物质,因此选择上述几种已得到广泛应用的极性树脂来对绿变物质进行分离纯化。由表1中数据可知,在静态吸附和解吸实验中,几种极性树脂对于大蒜绿变物质均具有一定的吸附效果,其中以SIPI-40的吸附率最高,达到91.9%;解吸率为84.7%。因此选择SIPI-40树脂作为介质进一步优化其分离条件。SIPI-40在其他中等或弱极性物质的分离中也得到了较好应用,彭益强等曾利用SIPI-40树脂从酶解液中吸附分离了1,3-丙二醇[12]。
2.2 SIPI-40树脂纯化绿变物质的条件优化
在树脂分离条件优化实验中,以绿变色素的粗提液为试液,测定其吸附前后的吸光值A590的变化,并按前述方法计算吸附率及解吸率。绘制动态吸附及解吸曲线时,以A590为考察指标。
2.2.1 最佳上样量的确定 当树脂吸附饱和后,继续增加上样量会产生目标吸附物质的泄露现象。SIPI-40对大蒜绿变色素的吸附曲线如图1所示,以透过液的吸光值A590为指标考察透过液中色素物质的浓度。由图1中数据可知,当上样体积达到2BV后,随着进样量的增加,透过液的A590逐渐增加;当进样超过4BV,透过液中色素含量显著增加,泄露现象明显。可见进入树脂床的提取液体积超过2BV时,树脂对绿变物质的吸附开始趋于饱和,因此上样量定为2BV。
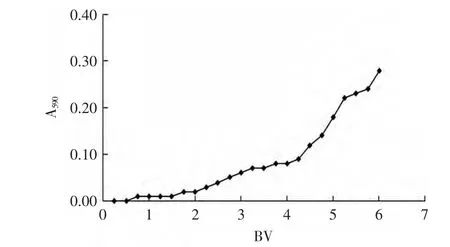
图1 SIPI-40树脂对绿变色素的动态吸附曲线Fig.1 Dynamic adsorption curve of Garlic greening compounds on SIPI-40 resin
2.2.2 最佳上样流速的确定 树脂对色素的动态吸附效果与其接触时间有关,因此上样时样液的流速决定了吸附率的高低。图2所示为不同的进样流速下,树脂对色素的吸附率。可见,随着流速的增加,树脂对色素的吸附率逐渐下降,当流速为0.5mL/min和1mL/min时,吸附率分别为94.3%和92.8%,考虑到实际操作效率,选择上样流速为1mL/min。
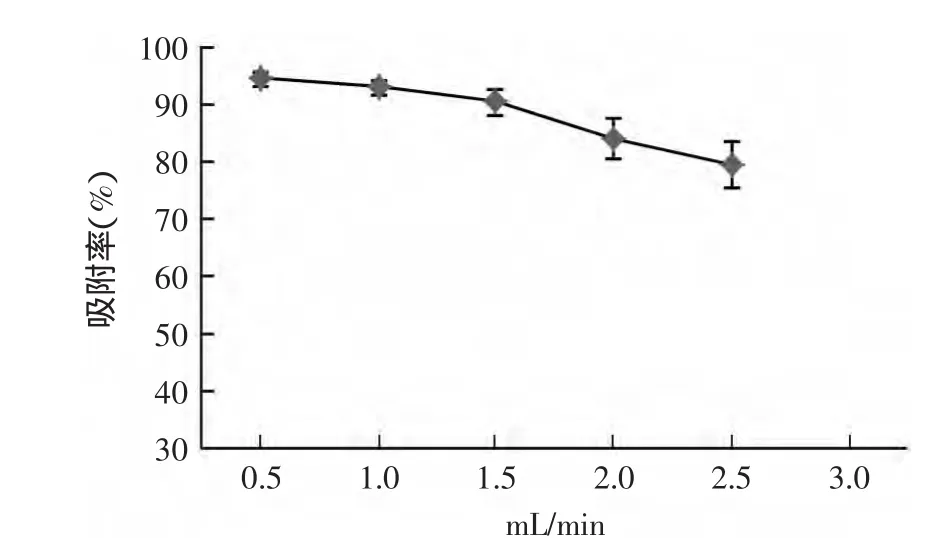
图2 上样流速对树脂吸附效果的影响Fig.2 Effect of injecting velocity on adsorption rate of garlic greening compounds
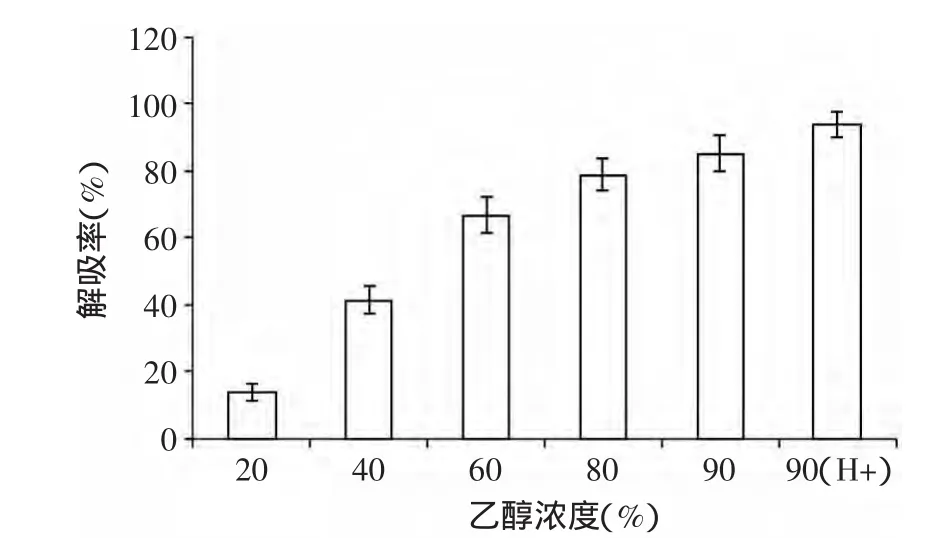
图3 不同洗脱溶剂对色素的解吸效果Fig.3 Desorption rate of garlic greening compounds by Macroporous Resin different eluent
2.2.3 最佳洗脱溶剂的确定 不同洗脱剂对绿变色素的解吸效果如图3所示,随着乙醇浓度的提高,洗脱剂对色素的洗脱能力逐渐增强,在乙醇浓度达到90%时,解析率为87.4%。为提高解吸效果,在此采用了向洗脱剂中加入助剂的方式提高解吸效果,经过实验证实,加入低浓度的盐酸(0.1%)可以显著提高解析率。前期研究表明,色素在酸性条件下比较稳定,因此加入盐酸不会影响色素的性质。最终选择含有0.1%HCl的90%乙醇溶液为洗脱剂。
2.2.4 洗脱曲线及洗脱液体积的确定 色素粗提液在SIPI-40树脂柱床上按上述确定的操作条件进行上样,吸附和水洗,然后在1mL/min的洗脱流速下采用酸化的90%乙醇溶液对色素进行解吸。洗脱过程中,每5ml洗脱液收集为1管,洗脱液所用体积为4BV(80mL),共计16管。测定每管吸光值A590,以其为纵坐标,以洗脱液体积(以BV计)为横坐标绘制洗脱曲线。洗脱曲线如图4所示,由图4可见,随着洗脱的进行,收集管中洗脱液的A590开始逐渐增加,色素逐渐被解吸下来,洗脱液为1.5BV时,A590达到0.143,色素开始被大量解吸。整个洗脱曲线呈峰形,说明目标分离物在尖峰处得到了富集。当洗脱液体积达到3BV时,A590已下降为0.140左右,浓度较低;继续洗脱,洗脱液吸光值继续下降,因此设定整个洗脱体积为4BV,解吸可基本完成。根据曲线收集1.5BV到3BV这一阶段的洗脱液,该部分为绿变色素经过树脂富集纯化后得到的浓缩区带,适用于后续研究。
综合以上研究结果,SIPI-40树脂富集分离大蒜绿变物质的最佳操作条件为:首先控制进样的色素粗提液浓度使其A590为0.55左右,最大进样量为2BV,进样流速1mL/min,洗脱剂为含0.1%HCl的90%乙醇溶液,洗脱剂用量为4BV,洗脱液体积为1.5~3BV部分得到的洗脱液为色素富集带,收集这部分洗脱液,浓缩冻干得到色素纯化物粉末。

表2 SIPI-40树脂纯化前后的大蒜绿变色素提取物的色价Table 2 Color value of the garlic greening compound extracts before and after the separation
2.2.5 色素纯化物纯度评价 表2中的结果显示,未经树脂柱纯化的色素粗提液的冻干粉末的色价为10.4,主要是其中含有较高比例的杂质,如糖类等。经过树脂柱的吸附纯化后,大多数杂质与色素组分得到了很好的分离,纯化产物的色价为47.6,色素纯度大大提高。
3 结论
本研究采用SIPI-40树脂对大蒜绿变色素进行了初步的富集分离,确定了树脂分离的最佳条件:以0.5mg/mL的色素提取物水溶液进样,最大进样体积为2BV(柱床体积),进样流速1mL/min,洗脱剂为含0.1%HCl的90%乙醇溶液,洗脱体积为4BV,在此操作条件下测得的洗脱曲线峰形理想;纯化后的色素提取物的色价提高到47.6,可见大孔树脂SIPI-40可以实现对大蒜绿变色素的富集纯化。色素组分经树脂法富集分离后,可进一步选用适宜的分离手段完成对其的高度纯化,进而研究其结构信息及相关性质。
[1]赵晓丹,傅达奇,王萍,等.腊八蒜绿变色素的分离提取[J].食品与发酵工业,2004,30(10):129-131.
[2]Lee E J,Cho J E,Kim J H,et al.Green pigment in crushed garlic(Allium sativum L.) cloves:purification and partial characterization[J].Food Chemistry,2007,101(4):1677-1686.
[3]Imai S,Akita K,Tomotake M,et al.Identification of two novel pigment precursors and a reddish-purple pigment involved in the blue-green discoloration of onion and garlic[J].Journal of Agricultural and Food Chemistry,2006,54(3):843-847.
[4]Kubec R,Velišek J.Allium discoloration:The color-forming potential of individual thiosulfinates and amino acids:Structural requirements for the color-developing precursors[J].Journal of Agricultural and Food Chemistry,2007,55(9):3491-3497.
[5]Roman K,Marcela H,Rabi A.Allium discoloration:precursors involved in onion pinking and garlic greening[J].Journal of Agricultural and Food Chemistry,2004,52(16):5089-5094.
[6]Cho J E,Lee E J,Yoo K S.Identification of candidate amino acids involved in the formation of blue pigments in crushed garlic cloves(Allium sativum L.)[J].Journal of Food Science,2009,74(1):C11-C16.
[7]Jungeum CHO,Eun J L,Kil S Y,et al.Identification of candidateamino acidsinvolved in the formation ofblue pigments in crushed garlic cloves(Allium sativum L.)[J].Journal of Food Science,2009,74(1):C11-C16.
[8]Wang D,Nanding H,Han N,et al.G.2-(1Hpyrrolyl)carboxylic acids as pigment precursors in garlic greening[J].Journal of Agricultural and Food Chemistry,2008,56(4):1495-1500.
[9]王岩,乔旭光.大蒜绿变物质提取及其分离纯化方法的初步研究[J].食品工业科技,2006,27(4):115-117.
[10]李伟,姜媛,唐晓珍,等.大孔树脂纯化黑粒小麦麸皮色素及其初步鉴定[J].食品与发酵工业,2011,37(8):200-204.
[11]鄢贵龙.大孔树脂对葛根素吸附行为的研究[J].食品工业科技,2007,28(1):63-66.
[12]彭益强,兰琳,陈巍,等.吸附树脂在酶法制备1,3-丙二醇中的应用[J].精细化工,2008,25(5):463-467.

