葛花原花青素的酶法提取及抗氧化性研究
李银花,李洪燕
(1.广东食品药品职业学院,广东广州510520;2.广州市质量监督检测研究院,广东广州510110)
葛花为豆科葛属落叶藤本植物的花朵,是我国传统的药食两用植物,在我国资源丰富,特别是在广西、云南、四川、福建、台湾等地已有广泛种植[1]。葛花富含多种生理活性物质,例如黄酮、多糖、氨基酸、微量元素等[2],它们表现出较多的生理活性,例如影响特异基因表达、保护心血管及抗癌等[3-5]。葛花的开发研究与综合利用是目前研究的焦点之一,但是葛花中原花青素产品的提取、开发、综合利用等还鲜有报道,同时如何高效的提取葛花中的原花青素也还有待研究。原花青素(procyanidins,PC)是一种具有特殊分子结构的生物类黄酮,它由黄烷-3-醇和黄烷-3,4-二醇的配位缩合或聚合而成的低聚或多聚物[6]。原花青素由于其特殊、多样的分子结构,因此具备抗衰老、抗氧化、抗糖尿病、抗肿瘤、抗菌等多种生理活性及药理作用[7]。它广泛存在于自然界中,目前原花青素主要来从葡萄籽、松树皮中提取,提取原花青素来源单一,无法满足社会的需要。
传统的原花青素提取方法主要是水浸提法[8]和有机溶剂提取法[9]等。传统的提取方法不但提取时间很长,而且提取温度高,会严重影响原花青素组成。酶法提取是一种优良的提取方法,它利用相应的酶破坏植物细胞,促进有效物质的快速溶出。酶法提取不仅操作简便迅速,并能在一定的程度上提高提取率,目前已广泛应用在生物活性物质提取方面[10-11]。在研究中采用酶法提高葛花中原花青素的含量及提取效率,并采用响应曲面法优化提取工艺,分析纤维素酶、果胶酶、酶解时间及酶解温度对葛花原花青素提取率的影响,并建立数学模型。此外,利用Sephadex LH-20凝胶柱对葛花原花青素进行纯化,分析其体外抗氧化活性,为葛花的综合开发与利用提供理论及技术支持。
1 材料与方法
1.1 材料与仪器
葛花药材 由广州二天堂药店提供,广东省中药研究所鉴定为粉葛(P.thomsonii Benth)的花,烘干磨粉后,过20目筛于冰箱冷藏备用;儿茶素标准品、1,1-二苯基-2-三硝基苯肼(DPPH) 美国Sigma公司;乙醇、甲醇、香兰素均为分析纯。
KQ-SOOB型超声波清洗器 昆山市超声仪器有限公司;THZ-82恒温振荡器 国华企业;752-紫外分光光度计 上海分析仪器厂;N-1001真空旋转蒸发仪 上海爱朗仪器有限公司;电子分析天平 梅斯特-拖利多仪器上海有限公司;CF16RXII高速冷冻离心机 日立。
1.2 实验方法
1.2.1 葛花原花青素的酶法提取 准确称取预先处理好的葛花粉2.0g于锥形瓶中,加入20mL蒸馏水,加入纤维素酶、果胶酶在一定温度下作用一定时间,过滤,滤液用旋转蒸发仪蒸干大部分水分,余下的滤液加入60%的乙醇溶液至20mL,在60℃条件下提取2h,过滤、浓缩,定容,得提取液。将提取液稀释一定倍数,测定原花青素的含量。
1.2.2 葛花原花青素提取工艺优化 单因素实验:果胶酶添加量0.4%,酶解时间2h,酶解温度50℃的条件下,考察纤维素酶添加量(0.2%、0.4%、0.6%、0.8%、1%)对原花青素得率的影响。纤维素酶添加量0.4%,酶解时间2h,酶解温度50℃的条件下,考察果胶酶添加量(0.2%、0.4%、0.6%、0.8%、1%)对原花青素得率的影响。纤维素酶添加量0.4%,果胶酶添加量0.6%,酶解温度50℃的条件下,考察酶解时间(30、60、90、120、150min)对原花青素得率的影响。纤维素酶添加量0.4%,果胶酶添加量0.6%,酶解时间90min的条件下,考察酶解温度(35、45、55、65、75℃)对原花青素得率的影响。分别研究纤维素酶添加量(X1)、果胶酶添加量(X2)、酶解时间(X3)和酶解温度(X4)对提取效果的影响。在单因素实验的基础上,利用Box-Behnken中心组合实验进行实验设计,用Design Expert 8.0软件进行响应面优化分析,确定最佳提取工艺。因素水平编码表如表1所示。

表1 响应曲面实验设计因素水平编码表Table 1 Factors and levels of response surface experimental design
1.2.3 原花青素含量的测定 采用香草醛-盐酸法[12]测定提取液中原花青素含量。以儿茶素标准品绘制标准曲线,测定提取液中原花青素的含量,按下式计算得率:

以儿茶素为标准品,分别配制浓度为50,100,150,200,250,300μg/mL的标准液,绘制标准曲线。得到回归方程Y=0.003X+0.0433,R2=0.9945。
1.2.4 葛花原花青素的纯化 在最优工艺条件下提取葛花原花青素,对提取液进行浓缩,3000g离心15min,收集上清液,去除沉淀。将上清液旋转蒸发浓缩至一定体积,经 0.45μm滤膜过滤,上样至Sephadex LH-20凝胶柱。用50%甲醇洗脱至洗脱液无色,再用500mL 70%的丙酮溶液洗脱,收集丙酮洗脱部分,将洗脱液真空浓缩、冷冻干燥,得到原花青素,于-20℃冰箱中储藏备用,同时测定原花青素的含量。
1.2.5 葛花原花青素的体外抗氧化活性
1.2.5.1 DPPH自由基清除能力 参考Villaño[13]等人的方法,略作修改。取不同浓度的原花青素溶液0.1mL,加入3.9mL质量浓度为25mg/L的DPPH甲醇溶液中,摇匀,反应30min。在515nm处测吸光度。以VC作为对照。将IC50值定义为,DPPH自由基清除率达到50%时原花青素样品的浓度。
按下式计算DPPH自由基清除率:

其中,A0为空白组吸光值,A1为样品组吸光值。1.2.5.2 羟自由基清除能力 参考 Smimoff等人[14]的方法。取不同浓度的样品0.5mL,依次加入1.5mL 2.0mmol/L的FeSO4溶液,1.5mL 6.0mmol/L的H2O2溶液,1.5mL 6.0mmol/L的水杨酸溶液。37℃反应30min后冷水冷却。510nm处测吸光度。以VC作为对照。将IC50值定义为,羟自由基清除率达到50%时原花青素样品的浓度。
羟自由基清除能力按下式计算:
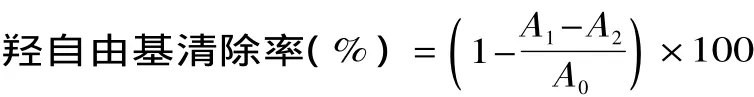
其中,A0为空白组吸光值,A1为样品组吸光值,A2为试剂空白的吸光值。
1.2.5.3 超氧阴离子自由基清除能力 参考Li[15]的方法。50μL不同浓度的样品溶液与2900μL的pH 7.4的Tris-HCl缓冲液(0.05moL/L,37℃)混合,加入50μL邻苯三酚溶液(25μL 6.0mmol/L邻苯三酚溶液与25μL 1mmol/L HCl溶液混合),迅速混匀,37℃下反应,在325nm下测定反应5min时吸光度的变化,计算超氧阴离子自由基清除能力。以VC作为对照。将IC50值定义为,超氧阴离子自由基清除率达到50%时原花青素样品的浓度。
按下式计算超氧阴离子自由基清除能力:
超氧阴离子自由基清除率(%)
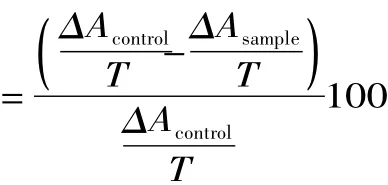
其中,ΔAcontrol为空白组吸光度的变化,ΔAsample为样品组吸光度的变化,T为测定时间,即5min。
2 结果与分析
2.1 单因素实验
2.1.1 纤维素酶对原花青素得率的影响 图1说明,在纤维素酶添加量小于0.4%时,原花青素得率随纤维素酶添加量的增加而增加;在纤维素酶添加量达到0.4%时达最大,之后随着纤维素酶添加量的增加反而呈下降趋势。这可能由于当酶浓度提高到一定值后,底物浓度对酶不能达到饱和,导致酶的作用受到抑制[16]。因此,纤维素酶添加量选择在0.2%~0.6 %为宜。
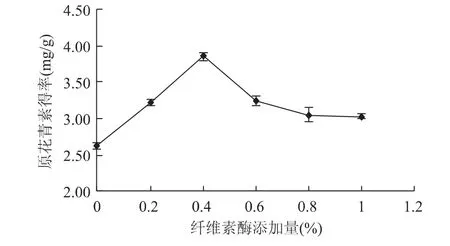
图1 纤维素酶添加量对原花青素得率的影响Fig.1 Effect of cellulase on extraction of PC
2.1.2 果胶酶对原花青素得率的影响 由图2可知,随着果胶酶添加量的增加,原花青素得率逐渐增大,在0.6%左右达到最高。当果胶酶添加量超过0.6%后,原花青素得率逐渐下降。因此果胶酶添加量选择在0.4%~0.8%为宜。
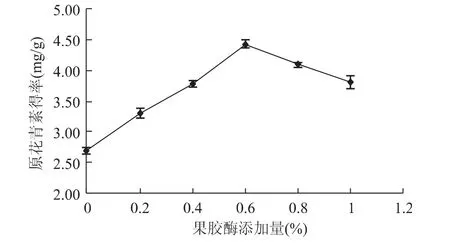
图2 果胶酶添加量对原花青素得率的影响Fig.2 Effect of pectase on extraction of PC
2.1.3 酶解时间对原花青素得率的影响 酶解时间太短影响酶解效果,太长则不利于工业生产。由图3可知,30~90min内原花青素得率随着时间的增加而逐渐增大,这是因为随着酶解时间的延长,酶解反应进行较为完全,原花青素更能有效溶出,使得原花青素得率增大。进一步延长酶解时间,得率反而降低,且会增加能耗,不利于生产。因此酶解时间选择在60~120min为宜。
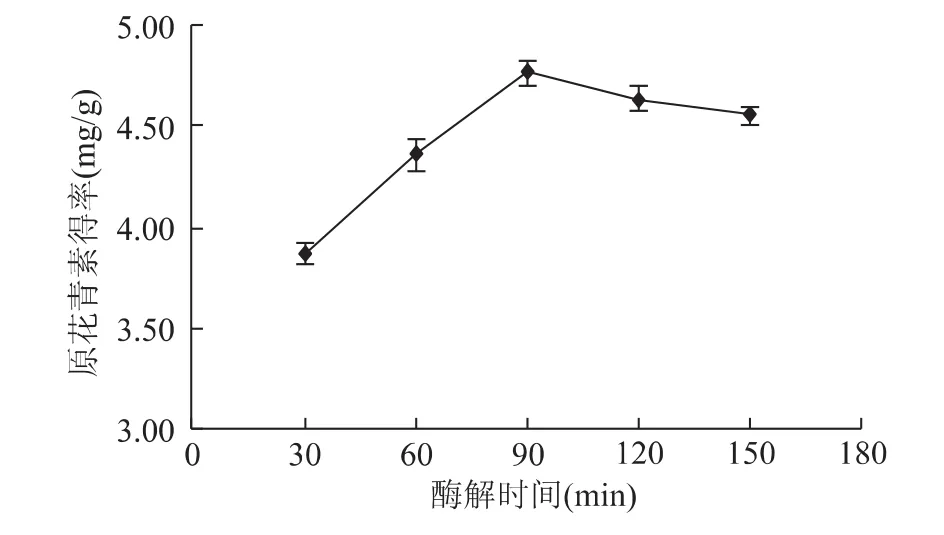
图3 酶解时间对原花青素得率的影响Fig.3 Effect of enzyme time on extraction of PC
2.1.4 酶解温度对原花青素得率的影响 由图4可知,随着酶解温度的升高,原花青素的得率不断增加,到65℃左右达到最高;继续升高温度,得率反而下降。说明温度的升高对酶的作用有促进作用,这可能是由于较高的温度使得酶活性增强,反应速度加快;但温度过高会使酶活性减弱,酶的稳定性降低,同时高温会破坏原花青素的结构,导致得率下降,因此提取温度不宜过高。综上,酶解温度选择55~75℃为宜。

图4 酶解温度对原花青素得率的影响Fig.4 Effect of enzyme temperature on extraction of PC
2.2 响应曲面实验结果
响应曲面实验设计及结果见表2。
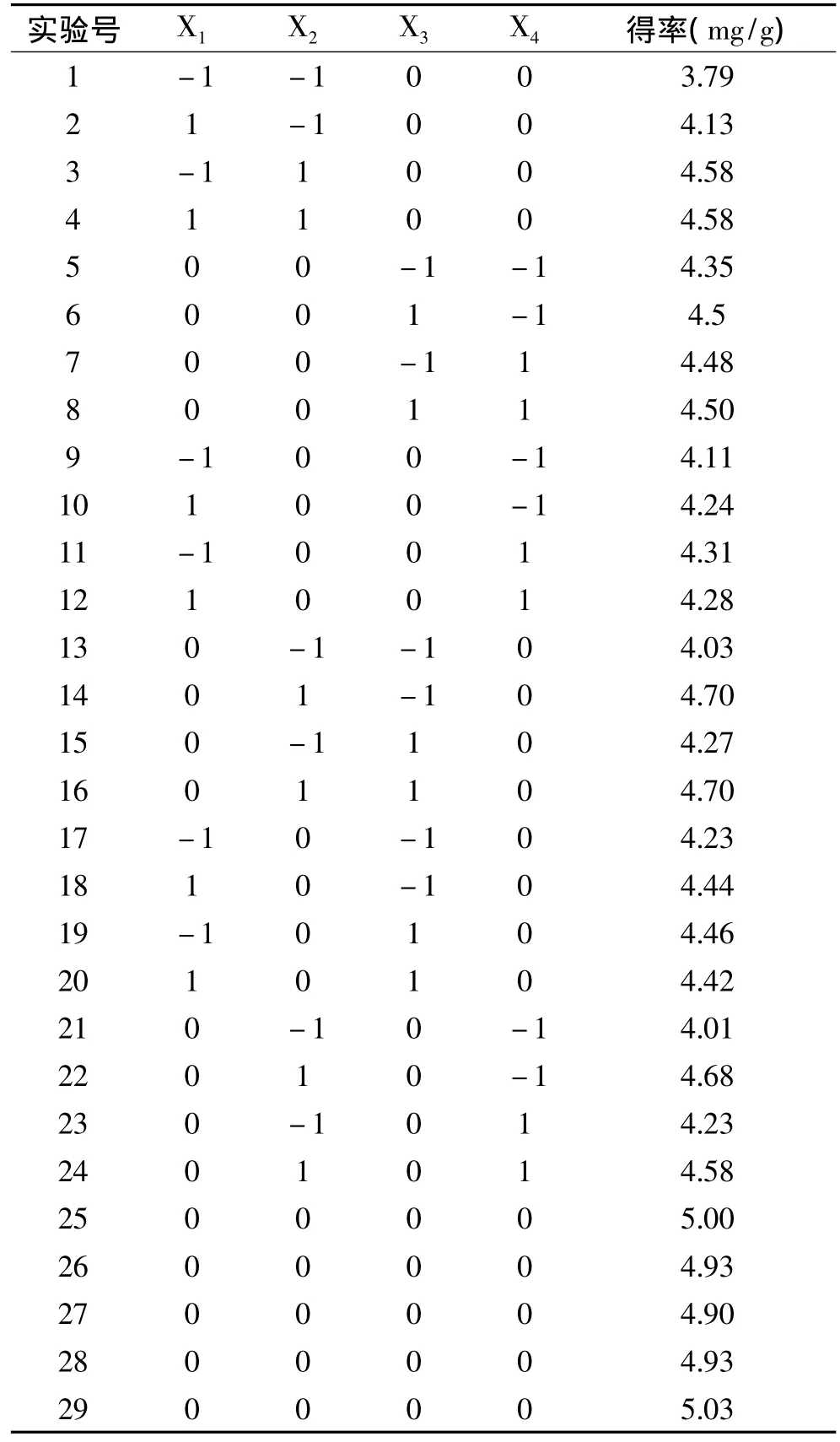
表2 响应曲面实验方案及结果Table 2 The design matrix andthe corresponding results of RSM experiments
利用Design-Expert软件对表2实验结果进行回归分析,得到回归方程:
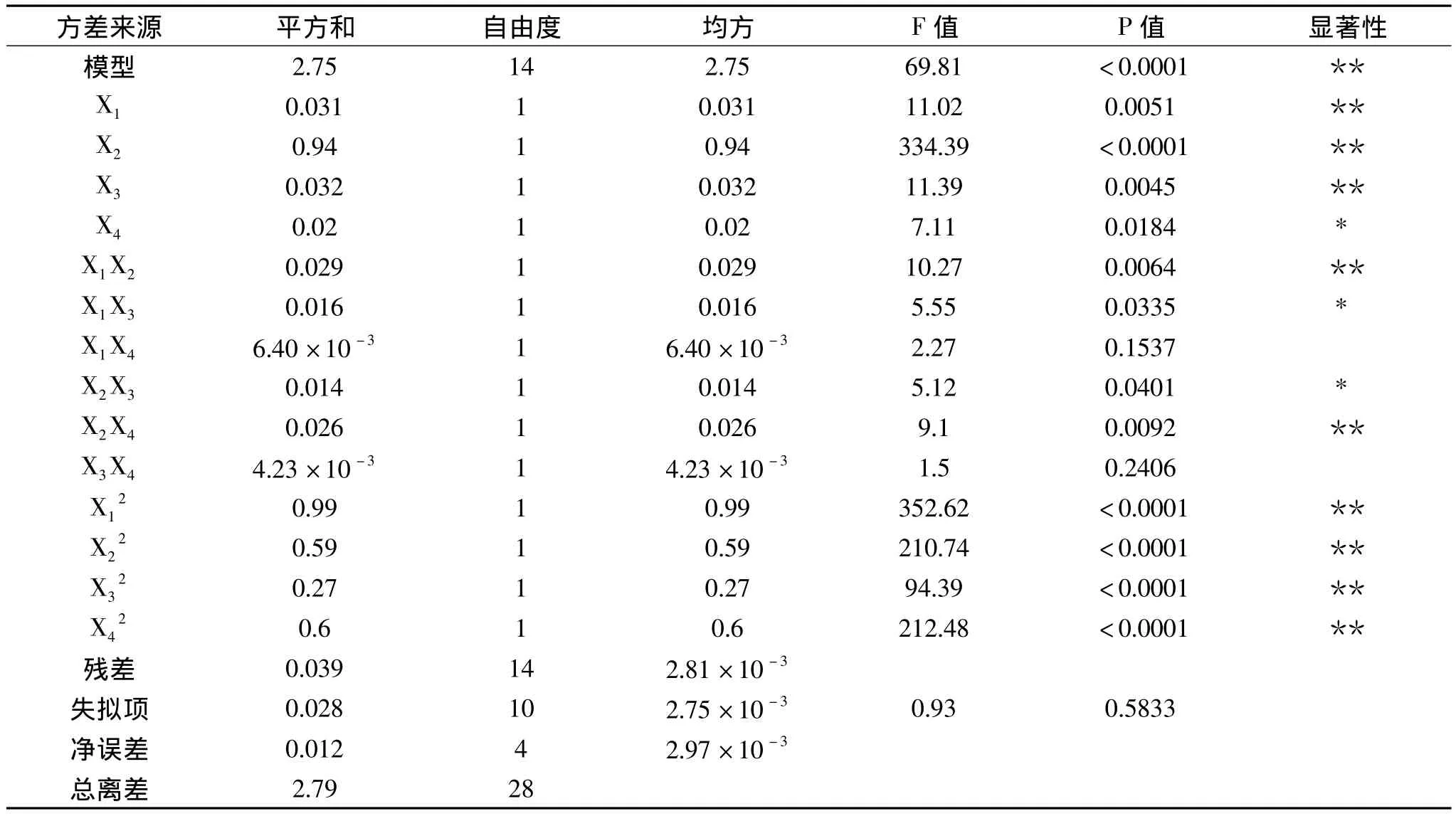
表3 方差分析表Table 3 Analysis of variance table
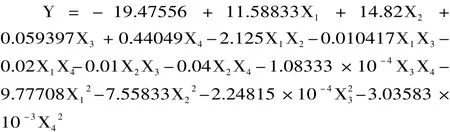
对模型进行方差分析,结果见表3。由表3可知,模型的显著水平远远小于0.05,说明模型效应显著;失拟项p=0.5833>0.05,说明方程对实验的拟合度较好。显著性分析可知,X1、X2、X3、X4、X1X2、X1X3、X2X3、X2X4、X12、、X32、对原花青素得率的影响显著,说明纤维素酶添加量、果胶酶添加量、酶解时间及酶解温度对原花青素得率的影响均达显著水平。交互项中,纤维素酶添加量与果胶酶添加量、纤维素酶添加量与酶解时间、果胶酶添加量与酶解时间、果胶酶添加量与酶解温度之间的交互作用显著,而其他因素之间的交互作用不显著。由F值可知,各因素对葛花原花青素得率影响的显著性由大到小依次为X2(果胶酶添加量)>X3(酶解时间)>X1(纤维素酶添加量)>X4(酶解温度)。
利用Design-Expert软件中的响应面和等高线图对4因素间的交互作用进行分析,结果如图5~图10所示。
在酶解时间90min,酶解温度65℃时,纤维素酶添加量和果胶酶添加量的响应面和等高线如图5所示。由图可知,纤维素酶添加量不变时,果胶酶对原花青素得率的影响呈先增大后减小的趋势。而当果胶酶不变时,随着纤维素酶添加量增大,原花青素的得率逐渐增大,之后略微降低。由方差分析结果可知,两者交互作用显著。
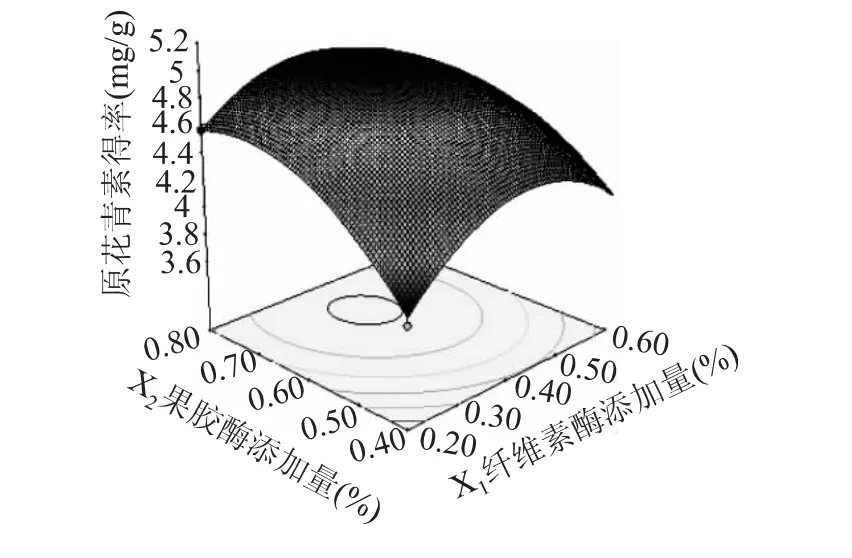
图5 纤维素酶添加量和果胶酶添加量的响应面Fig.5 Response surfaces of cellulase and pectase
果胶酶添加量0.6%,酶解温度60℃的条件下,纤维素酶添加量和酶解时间的响应面和等高线如图6所示。由图可知,当纤维素酶添加量不变时,酶解时间对原花青素得率的影响呈现先增加后降低的趋势。而当酶解时间不变,随着纤维素酶的增加,原花青素得率出现先增加后降低的趋势,在中心点附近达到最高值。由方差分析可知两者交互作用显著。
在果胶酶添加量0.6%,酶解时间90min的条件下,纤维素酶添加量和酶解温度的响应面和等高线如图7所示。由图可知,当纤维素酶添加量不变时,酶解温度对原花青素得率的影响先增加而后降低。当酶解温度不变时,纤维素酶添加量对原花青素得率的影响与提取温度类似,且在中心点附近达到最高值。
在纤维素酶添加量0.4%,酶解温度65℃条件下,果胶酶添加量和酶解时间的响应面和等高线如图8所示。从图中可以看出,果胶酶添加量不变,随着液料比的增大,原花青素得率逐渐增大。在酶解时间不变时,随着果胶酶添加量增加,原花青素得率逐渐增加,后略微降低。由方差分析结果可知,两者的交互作用显著。
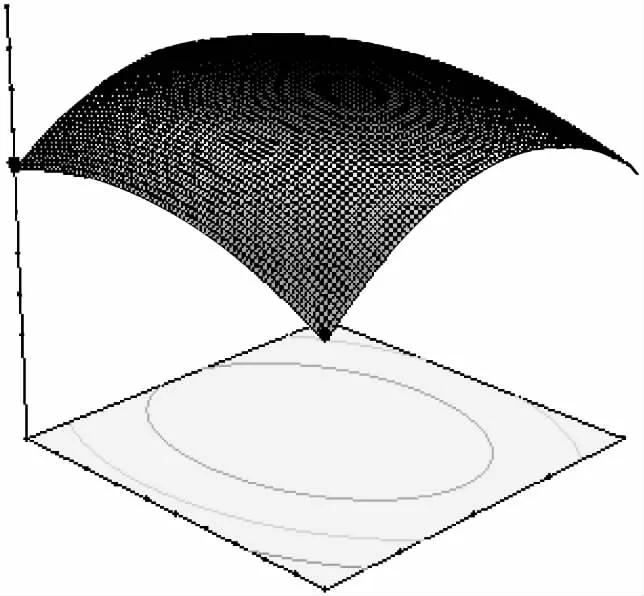
图6 纤维素酶添加量和酶解时间的响应面Fig.6 Response surfaces of cellulase and enzyme time

图7 纤维素添加量和酶解温度的响应面Fig.7 Response surfaces of cellulase and enyzme temperature

图8 果胶酶添加量和酶解时间的响应面Fig.8 Response surfaces of pectase and enzyme time
在纤维素酶添加量0.4%,酶解时间90min的条件下,果胶酶添加量和酶解温度的响应面和等高线如图9所示。由图可知,果胶酶添加量一定时,随着酶解温度的增大,原花青素的得率逐渐增加,而后略微降低,在中心点附近原花青素得率达到最高。酶解温度不变时,随着果胶酶的增加,原花青素得率逐渐增大。由方差分析可知两者的交互作用显著。
纤维素酶添加量0.4%,果胶酶添加量0.6%的条件下,酶解时间和酶解温度的响应面和等高线如图10所示。由图可知,当酶解时间一定时,随着酶解温度的增加,原花青素得率先增加后降低,在中心点附近达到最大值。当酶解温度处于一定水平时,随着酶解时间的延长,原花青素得率也呈先增大后下降的趋势。

图9 果胶酶添加量和酶解温度的响应面Fig.9 Response surfaces of pectase and enzyme temperature
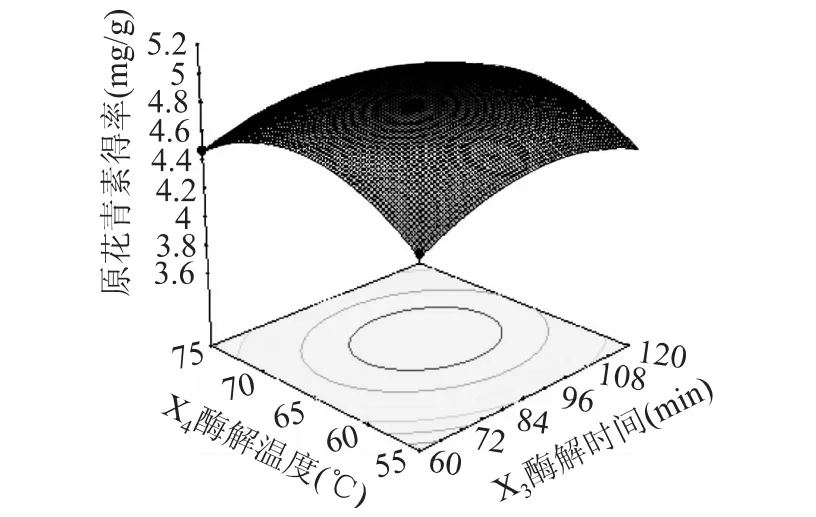
图10 酶解时间和酶解温度的响应面Fig.10 Response surfaces of enzyme time and enzyme temperature
利用已建立的数学模型在实验范围内优化出最优条件为:纤维素酶添加量0.4%,果胶酶添加量0.69%,酶解时间92min,酶解温度65℃。在此条件下,葛花原花青素的得率为5.02mg/g。
2.3 葛花原花青素的纯化
为验证模型的可靠性,在此条件下进行验证实验,葛花原花青素的平均得率为5.05mg/g。与理论预测值相比,其相对误差约为0.60%,说明数学模型可靠。
2.4 葛花原花青素的体外抗氧化能力
2.4.1 DPPH自由基清除能力 DPPH自由基是一种相对稳定的自由基,是评价抗氧化剂抗氧化能力的常用方法[17]。葛花原花青素对DPPH自由基的清除能力见图11。

图11 葛花原花青素的DPPH自由基清除能力Fig.11 DPPH radical scavenging activity of PC from puaearia
由图11可知,原花青素对DPPH自由基的清除能力呈一定的量效关系,清除率随着原花青素的浓度增加而逐渐增大。当原花青素浓度达到0.2mg/mL时,清除率在90%以上。以VC为对照,两者的IC50值分别为0.087、0.105mg/mL,说明葛花原花青素呈现出较好的抗氧化活性。
2.4.2 羟自由基清除能力 羟自由基是活性较高的自由基,它与衰老、癌症及多种疾病的发生有关[18]。清除羟自由基可能是防御一些疾病的有效手段。葛花原花青素对羟自由基的清除能力如图12所示。
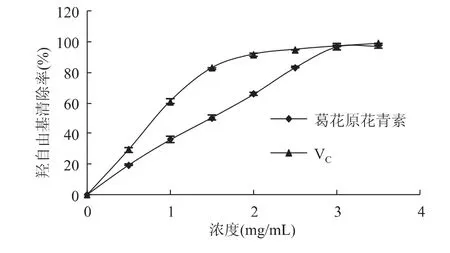
图12 葛花原花青素的羟自由基清除能力Fig.12 Hydroxyl free radical scavenging activity of PC from puaearia and VCas positive control
由图12可知,原花青素对羟自由基的清除能力呈一定的量效关系,清除率随原花青素浓度的增加逐渐增大,在1.5mg/mL的浓度时即达到80%以上。以VC为对照,两者的IC50值分别为0.767、1.310 mg/mL。
2.4.3 超氧阴离子自由基清除能力 超氧阴离子自由基是活性氧之一。大量的超氧阴离子自由基会使细胞中超氧化物歧化酶钝化[19],从而使细胞受到毒害甚至死亡。超氧阴离子自由基清除率是常用的抗氧化活性指标。
由图13可知,葛花原花青素是具有较高的超氧阴离子自由基清除能力,在0.6mg/mL的浓度时清除能力即达到90%以上。与VC相比,原花青素呈现较高的超氧阴离子自由基清除能力。两者的IC50值分别为0.303mg/mL、0.371mg/mL。
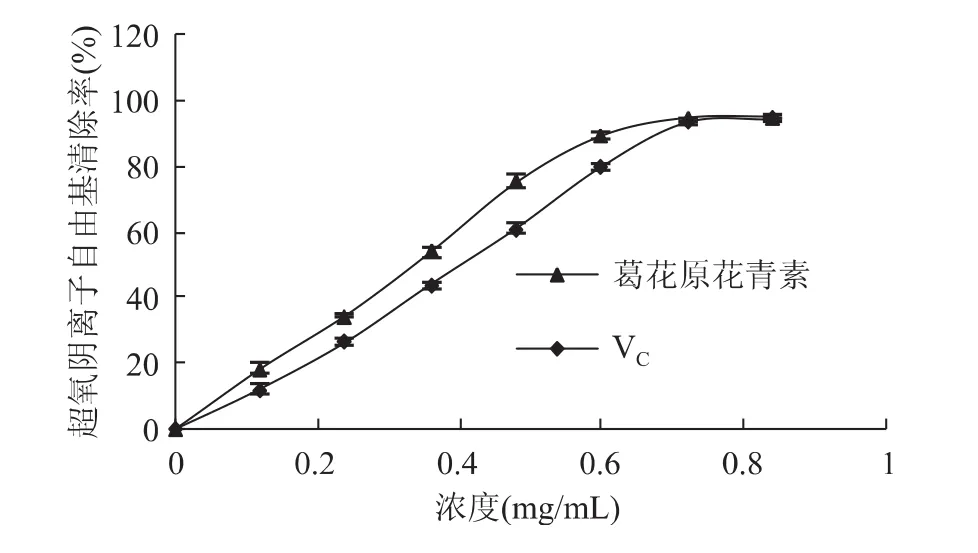
图13 葛花原花青素的超氧阴离子自由基清除能力Fig.13 Superoxide anion free radical scavenging activity of PC from puaearia and VCas positive control
3 结论
通过单因素实验和Box-Behnken实验设计优化,研究纤维素酶添加量、果胶酶添加量、酶解时间和酶解温度对葛花原花青素得率的影响。经优化实验得到的最佳提取工艺为:纤维素酶添加量0.40%,果胶酶添加量0.69%,酶解时间92min,酶解温度65℃。在此条件下,葛花原花青素的得率为5.02mg/g。所得原花青素具有良好的抗氧化活性,其DPPH自由基清除率、羟自由基清除率和超氧阴离子自由基清除率的IC50值分别为0.087,0.767,0.303mg/mL。
[1]肖淑贤,李安平,范圣此,等.葛根种质资源研究进展[J].山西农业科学,2013,41(1):99-102.
[2]叶淑静.中药葛根研究进展[J].浙江中医学院学报,2003,27(6):94-96.
[3]Latipron U,Waranya C,Orawan M,et al.Impact of pueraria candollei var.mirifica and its potent phytoestrogen miroestrol on expression of bone-specific genes in ovariectomized mice[J]. Fitoterapia,2012,83(8):1687-1692.
[4]刘莹,郁建平.野葛花素解酒作用机理[J].食品工业科技,2011,32(4):355-357.
[5]高学清,汪何雅,钱和,等.葛根和葛花对急性酒精中毒小鼠的解酒作用[J].食品与生物技术学报,2012,41(9):79-81.
[6]吕丽爽.天然抗氧化剂低聚原花青素的研究进展[J].食品科学,2002,23(2):147-150.
[7]石壁,杜晓.植物原花色素研究利用进展与发展趋势[J].四川大学学报:工程科学版,2006,38(5):16-24.
[8]黎超,毛超伦,雍克岚.肉桂原花青素的提取及其对高级糖基化终产物形成的抑制作用[J].食品科学,2012,33(8): 126-130.
[9]周玮婧,孙智达,谢笔均,等.荔枝皮原花青素提取、纯化及抗氧化活性研究[J].食品科学,2009,30(8):68-71.
[10]李力,杨晋,朱桂花.酶法辅助提取苦豆子渣总黄酮的工艺研究[J].食品科技,2011,36(6):248-254.
[11]Antonio Z,Marcello F,Roberto L.Enzyme-assisted extraction of lycopene from tomato processing waste[J].Enzyme and microbial technology,2011,49(6-7):567-573.
[12]周芸.莲房原花青素制备工艺及抗氧化活性研究[D].杭州:浙江大学,2012.
[13]VillanoD,FernandezMS,MoyaML,etal.Radical scavenging ability of polyphenolic compounds towards DPPH free radical[J].Talanta,2007,71(1):230-235.
[14]Smirnoffn N,Cumbes Q J.Hydroxyl radical scavenging activity ofcompatible solutes[J].Phytochem,1989,28: 1057-1060.
[15]Li Xican.Improved pyrogallol autoxidation method:a reliable and cheap superoxide-scavenging assay suitable forall antioxidant[J].Journal of Agriculture and Food Chemistry,2012,60(25):6418-6424.
[16]张涛,李超,商学兵.葡萄籽原花青素的纤维素酶辅助提取工艺优化[J].中国食品添加剂,2011(5):82-88.
[17]Sanchez M C.Review:Method used to evaluate the free radical scavenging activity in foods and biological systems[J]. International Journal of Food Science&Technology,2002,8(3): 121-137.
[18]Valentao P,Fernandes E,Carvalho F,et al.Hydroxyl radical and hypochlorous acid scavenging activity of small centaury (centaurium erythraea)infusion.A comparative study with green tea(camellia sinensis)[J].Phytomedicine,2003,10(6-7): 517-522.
[19]王秋林,王浩毅,王树人.氧化应激状态的评价[J].中国病理生理杂志,2005,21(10):2069-2074.

