超高效液相色谱串联质谱测定乳及乳制品中AFM1、AFM2
李佳峻,杨春林,胡强,吴蔚,吕小艇
(乐山市产品质量监督检验所,四川乐山614000)
超高效液相色谱串联质谱测定乳及乳制品中AFM1、AFM2
李佳峻,杨春林*,胡强,吴蔚,吕小艇
(乐山市产品质量监督检验所,四川乐山614000)
利用免疫亲和萃取结合超高效液相色谱-串联四极杆质谱技术(UPLC-MS/MS)建立了乳及乳制品中黄曲霉毒素M1和M2的提取、分离、确证与定量方法。乙腈和水提取样品中的黄曲霉毒素,乙腈二次去蛋白后用免疫亲和柱净化,采用Waters Acquity UPLCHSST3(2.1×100mm,1.7μm)色谱柱实现分离,多反应监测(MRM)模式下以外标法定量。结果表明:黄曲霉毒素M1和M2在0.1μg/L~50μg/L范围内线性关系良好(r﹥0.998 5);检出限为0.029μg/L~0.047μg/L(S/N=3);2种黄曲霉毒素各添加水平在鲜牛奶、奶粉和奶油中的回收率为在69.56%~88.43%之间;相对标准偏差为3.69%~8.74%。
超高效液相色谱-串联质谱;乳及乳制品;黄曲霉毒素;免疫亲和柱净化
黄曲霉毒素(aflatoxin,AFT)主要是由黄曲霉Aspergillus flavus Link ex Fries.和寄生曲霉Aspergillus parasiticus Speare.产生的次生代谢产物,目前报道的黄曲霉毒素已多达17种[1]。黄曲霉毒素毒性极强,据报道能致癌、致畸、致诱变[2-4],其化学性质稳定,污染范围广[5],一直是农畜产品质量和食品安全中的重大问题之一。对农产品污染较大的主要有黄曲霉毒素B1、B2、G1、G2等,其中黄曲霉毒素B1、B2随着饲料被动物摄入后,在肝微粒体单氧化酶系的催化作用下羟化形成同样具有致癌毒性的黄曲霉毒素M1(AFM1)和黄曲霉毒素M2(AFM2)[6]。牛奶及其制品经常因为奶牛食用了含有黄曲霉毒素的饲料而污染AFM1和AFM2,世界上许多国家都规定了牛奶及其制品中AFM1的限量标准。目前食品中黄曲霉毒素检测的主要方法有薄层色谱法(TLC)[7]、酶联免疫吸附法(ELISA)[8]、酶联免疫吸附柱-荧光分光光度法(IAC-FLM)[9]、高效液相色谱法-荧光测定法(HPLC-FLD)[10-11]等。这些方法虽然在一定程度上解决了黄曲霉毒素的检测方法问题,但由于无法对样品进行准确的定性和定量分析,且容易出现假阳性等问题,不能作为最终的确证方法。超高效液相色谱-串联质谱法(HPLC-MS/MS)集高效分离、多组分定性与定量于一体,已成为近年来真菌毒素检测的主要方向[12]。近年来,关于液质联用法检测食品中黄曲霉毒素的文献较少[13-14],国内还未见HPLC-MS/MS法同时检测乳及乳制品中黄曲霉毒素M1、M2的报道。本文以乙腈沉淀样品中的蛋白,免疫亲和柱(IAC))净化,超高效液相色谱-串联质谱同时测定乳及乳制品中黄曲霉毒素M1、M2,取得满意效果。
1 材料与方法
1.1实验仪器、试剂与样品
1.1.1 仪器与设备
超高效液相色谱仪UPLC I_Class(配置二元高压泵、自动进样系统)、三重四级杆串联质谱仪Xevo TQD:美国waters公司;MiliQ超纯水机系统:美国Milipore公司;冷冻离心机CR 22G:日本日立公司;氮吹仪NEVAP:美国Organomation公司;电子天平DV215CD(精确至0.000 01 g):美国Ohaus公司;超声波清洗器:上海冠特超声仪器有限公司;RV10控制型旋转蒸发仪:德国IKA公司;ToxinFast黄曲霉毒素免疫亲和柱:北京华安麦科生物技术有限公司。
1.1.2 试剂与样品
甲醇、乙腈(色谱纯):美国Fisher公司;色谱纯甲酸(色谱纯)、乙酸铵(优级纯):德国DNW公司;黄曲霉毒素M1、M2标准品:以色列Fermentek公司;Whatman玻璃纤维滤纸:英国GE Healthcare公司;所有供试样品均在当地大中型超市购买。
1.2 色谱-质谱条件
1.2.1 色谱条件
1.2.2 质谱条件
离子源:电喷雾离子化源(ESI);扫描模式:正离子扫描;离子源温度:150℃;脱溶剂温度:450℃;脱溶剂气体(N2)流量900 L/h;锥孔气体(N2)流量:50 L/h;毛细管电压:0.5 kv;扫描方式:多反应监测MRM。黄曲霉毒素M1、M2的其他质谱参数见表1。
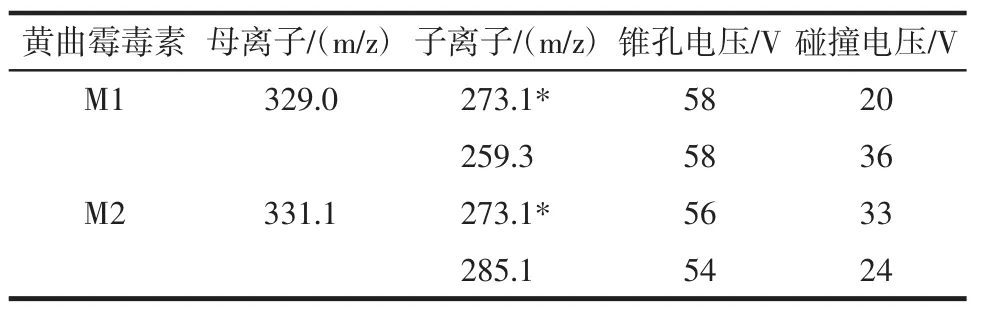
表1 黄曲霉毒素M1、M2的质谱分析参数Table1 MS/MS parameters for detection of AFM1 and AFM2
1.3 样品的提取与净化
1.3.1 样品提取
液态奶类样品:准确称取5g样品(精确至0.0001g),加入乙腈-水溶液(85∶15,体积比)至50mL,充分涡旋混合2min,45℃水浴20min(每隔5分钟涡旋混合1min),8 000 r/min的转速于4℃离心15min,上清液中再加入50mL乙腈,充分涡旋混合1min,10 000 r/min的转速离心10min,上清液转移到100mL圆底烧瓶中于旋转蒸发仪中减压浓缩至约5mL,加水稀释至20mL,供净化处理。
奶粉:准确称5 g均匀样品(精确至0.000 1 g),加入乙腈-水溶液(85∶15,体积比)至50mL,于涡旋混合器上充分混合2min,45℃超声提取20min(每隔5分钟用手振摇10次),8000 r/min的转速于4℃离心15min,上清液中再加入50 mL乙腈,充分涡旋混合1 min,10 000 r/min的转速离心10min,上清液转移到100mL圆底烧瓶中于旋转蒸发仪中减压浓缩至约5mL,加水稀释至20mL,供净化处理。
奶油等高脂肪样品:准确称5 g样品(精确至0.0001g),加入30mL石油醚充分溶解样品,加入20mL水和30mL乙腈,振荡30min后,将全部液体转移至100mL分液漏斗中,待分层后,将下层溶液全部转移至100mL圆底烧瓶中,于旋转蒸发仪中减压浓缩至约5mL,加水稀释至20mL,供净化处理。
1.3.2 试液净化
将上述稀释后的提取液用玻璃纤维滤纸过滤2次,全部转移至连接于免疫亲和柱上端的20mL注射器筒中,调节固相萃取装置的真空系统,控制试液以每秒钟1 d~2 d的流速通过黄曲霉毒素免疫亲和柱,分别以10mL纯水清洗2次,至样品完全流干后加4mL甲醇淋洗,收集淋洗液于40℃用氮气吹至近干,用乙腈-水(1∶9,体积比)溶液定容至1mL,过0.2μm有机滤膜待测。
1.4 标准溶液的配制
用乙腈-水(1∶9,体积比)将标准溶液稀释并配制成一定浓度的标准储备液,再用按照1.3的方法得到的空白样品提取液将标准储备液逐级稀释成中间液和所需浓度的标准工作液。
2 结果与分析
2.1 色谱条件的选择
实验分别以甲醇和乙腈作为强洗脱剂,比较不同体系流动相对黄曲霉毒素M1、M2在色谱柱上的保留与分离情况。黄曲霉毒素M1和M2分子结构相近、分子极性相当且分子量相差很小,当乙腈体系作为流动相时,由于其洗脱能力较强,峰形较好,但是两种黄曲霉毒素很难实现基线分离。最后选用甲醇-乙腈-水体系作为流动相,以1.2.1所示的洗脱程序进行梯度洗脱,两种目标物质的色谱图见图1。
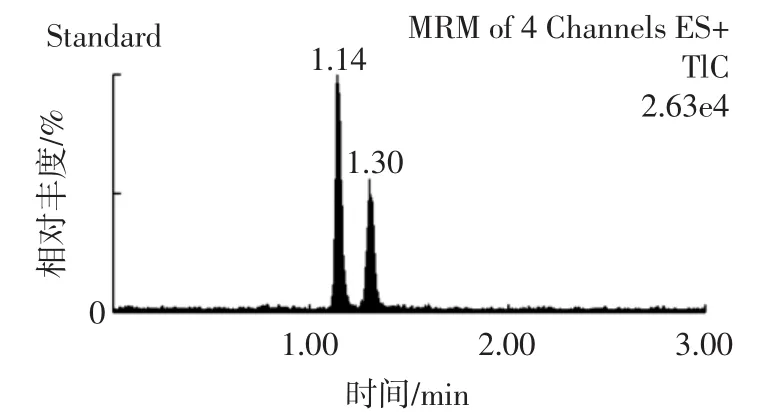
图1 黄曲霉毒素M1、M2标准溶液色谱图Fig.1 Chromatogram of standard solution of AFM1 and AFM2
实验采用超高效液相色谱系统,所用的UPLC色谱柱粒径小,柱效高,分离速度快,黄曲霉毒素M1、M2在1.5min内即实现基线分离。值得注意的是,虽然在45%有机相条件下两种黄曲霉毒素有较好的色谱保留及分离度,但是试液中一些极性较小的杂质可能由于没有完全洗脱而干扰下一个样品的分析。所以在目标峰出现之后将流动相中的有机相增加到90%以使样品中的杂质充分洗脱,同时将流路切换至废液而不进入质谱系统,充分保护质谱系统少受杂质的污染,提高使用寿命。
2.2 质谱条件的优化
通过蠕动泵连续进样的形式,直接将标准样品注入质谱系统来优化质谱条件。锥孔电压、碰撞电压等质谱参数以及定性、定量离子对等可以利用质谱软件MassLynx4.1的Intelistart功能(智能调谐)进行自动优化,离子源温度、毛细管电压(喷雾电压)等参数需要实验人员手动调谐。结果表明,离子源温度从120℃到150℃对质谱响应的强弱没有显著影响,而毛细管电压的高低对质谱响应具有非常明显的影响。实验考察了毛细管电压从3.5 kV降至0.3 kV的过程中质谱响应值和信噪比的变化趋势,结果如图2所示(以黄曲霉毒素M1为例)。

图2 黄曲霉毒素M1在不同毛细管电压下的信噪比Fig.2 Signal to Noise Ratio of AFM1 of different Capillary voltage
由图2可知,毛细管电压为3.5 kV时响应和信噪比最低,随着毛细管电压的降低,响应和信噪比越来越高,当电压降至0.5 kV时达到最高,当毛细管电压再下降时质谱响应也开始下降。其原因可能是流动相中加入的少量甲酸能增加样品雾滴带电的能力,有助于其离子化过程,所以毛细管电压也相应的需要降低。由于试液在离子化的过程中受溶剂的影响较大,采取不通过色谱柱而将样品直接注入质谱系统的方式进行调谐时需要利用仪器的“T”型三通流路,结合流动相来同时进行,否则可能发生调谐的结果与实际样品分析的情况不符的现象,从而影响实验的准确性和重现性。在优化的质谱参数和色谱条件下,黄曲霉毒素M1、M2(浓度分别为4μg/L和5μg/L)的提取离子色谱图见图3。
2.3 试样提取及净化
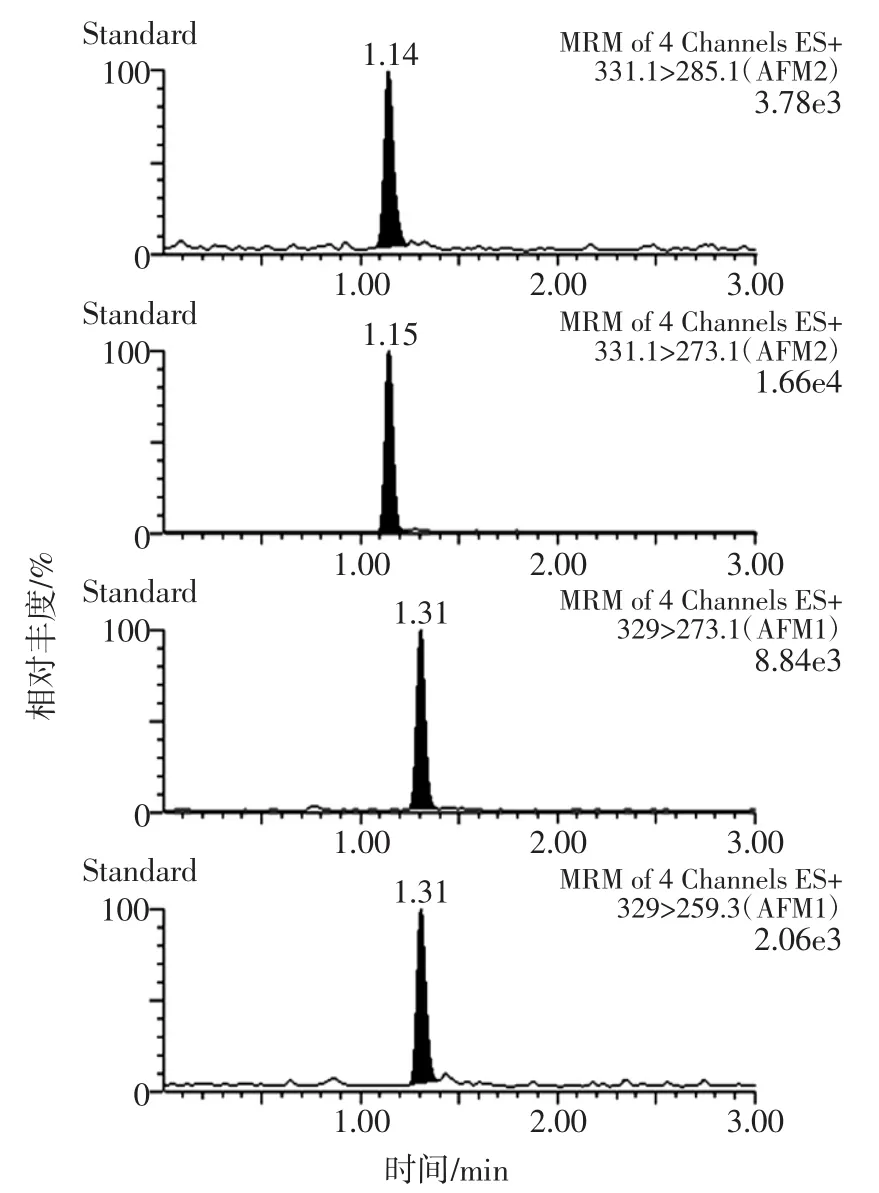
图3 黄曲霉毒素M1、M2的提取离子色谱图Fig.3 Ion chromatograms of AFM1 and AFM2 standard
由于乳和乳制品中富含的蛋白和脂肪是干扰色谱柱分离、影响峰形以及造成峰拖尾的重要因素之一。因此,找到既能最大程度除去样品中的蛋白和脂肪又能保证样品回收率的方法是实验的关键步骤。实验针对不同基质的样品建立差异性的前处理方法,为提高回收率,液态奶采用涡旋与水浴的方式提取,奶粉采用涡旋结合超声的方式提取,奶油等高脂肪的样品则采用石油醚除脂。用高比例的乙腈作为提取溶剂,充分利用乙腈对蛋白的沉淀作用并结合冷冻离心的方式,尽可能的除去样品中的蛋白等杂质。在上清液中加入等体积的乙腈并将离心的转速提高至10 000 r/min,能进一步将提取液中微量的蛋白质和脂肪沉淀并析出。由于上清液中乙腈的含量很高,直接过免疫亲和柱净化会影响样品中黄曲霉毒素与特异性抗体的结合,所以为了提高回收率,可将样品提取液在旋转蒸发仪上减压浓缩至5mL左右,用水稀释后再用免疫亲和柱净化。用建立的前处理方法和优化的色谱、质谱条件对实际样品进行处理和分析,所得的空白样品(A)及黄曲霉毒素M1阳性样品(B)提取离子流色谱图见图4。
2.4 标准曲线的配制、方法的线性范围与检出限
由于净化后的样品含有的少量杂质仍然会产生基质效应影响质谱方法的灵敏度,为了校正基质效应对质谱响应带来的影响,本方法采用空白样品提取液配制标准工作溶液,使得标准溶液与样品的基质背景基本一致,从而有效消除样品基质效应对定量的影响。实验表明,黄曲霉毒素M1、M2在0.10μg/L~50.00μg/L范围内线性关系良好,相关系数均大于0.9985,线性方程见表2。

图4 牛奶空白样品及阳性样品色谱图Fig.4 Chromatograms of negative sample and positive sample
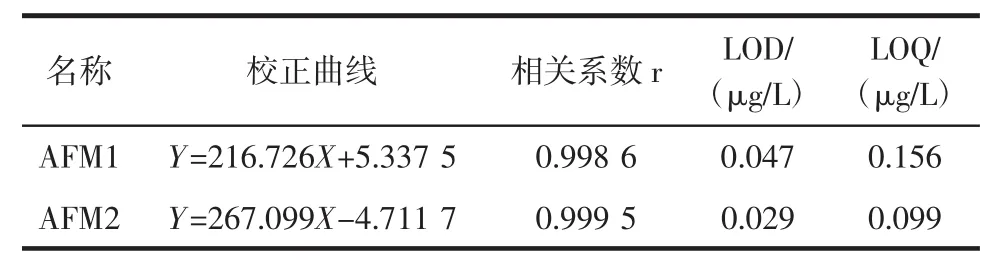
表2 黄曲霉毒素M1、M2标准曲线、检测限(LOD)和定量限(LOQ)Table2 Standard curves,limit of detection,and limit of quantification for fAFM1 and AFM2
以3倍信噪比为检出限(LOD),计算得出黄曲霉毒素M1、M2的检出限分别为0.047μg/L和0.029μg/L;以10倍信噪比为定量限(LOQ),得出2种黄曲霉毒素的定量限分别为0.156μg/L和0.099μg/L。
2.5 方法的回收率和精密度
选择阴性鲜牛奶、奶粉和奶油样品,分别添加一定量的标准溶液,使添加水平分别为0.5、5.0、10.0μg/kg,按上述方法处理,每个浓度重复测定6次,考察方法的精密度,结果见表3。
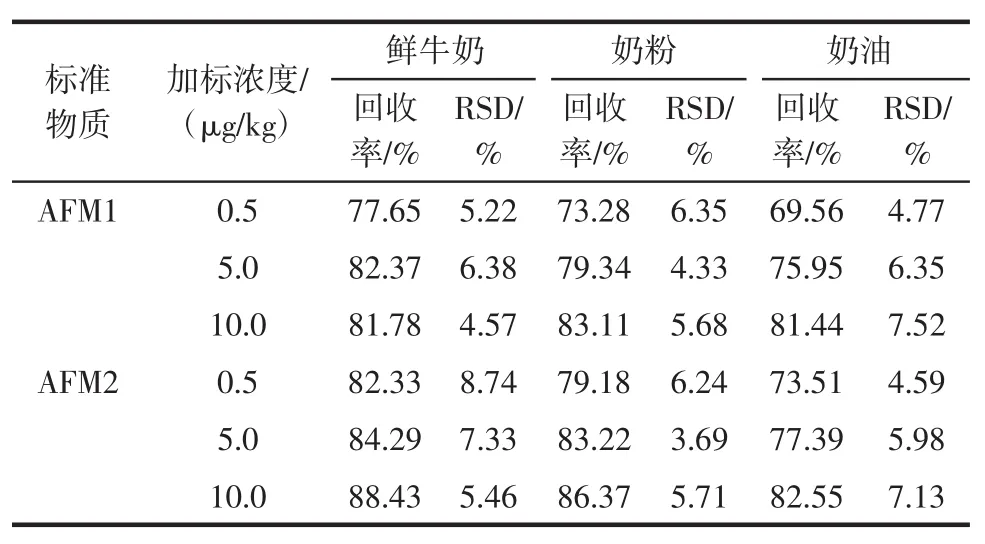
表3 不同食品中黄曲霉毒素M1、M2的回收率和相对标准偏差(n=6)Table3 Recoveries and RSDs of AFM1 and AFM2 in different food(n=6)
在空白样品中添加黄曲霉毒素M1、M2的平均回收率在69.56%~88.43%之间,相对标准偏差(RSD)小于10%。
3 结论
本研究建立了免疫亲和柱净化-超高效液相色谱-三重四级杆串联质谱法检测乳及乳制品中黄曲霉毒素M1、M2的方法。利用乙腈和水提取样品中的黄曲霉毒素,乙腈二次去蛋白,免疫亲和柱净化能够快速、特异的将黄曲霉毒素M1、M2从样品中分离出来,净化程序简单、净化率高,适合高蛋白样品的净化处理。实验对色谱、质谱条件进行了优化,利用超高效液相色谱方法进行分离,实现了了大量样品的高通量检测。该方法灵敏度高,准确度、精密度和各项技术指标均满足国内外真菌毒素检测的要求,可用于乳及乳制品中黄曲霉毒素M1、M2的同时检测。
[1]杨美华.药用植物及其产品中真菌及真菌毒素污染研究进展[J].贵州农业科学,2008,36(6):69-73
[2]Dvorackova I.Aflatoxin inhalation and alveolar cell carcinoma[J]. BM J,1976,1:691
[3]CARLSON M A,BARGERON C B,BENSON R C.An automated, handheld biosensor for aflatoxin[J].B iosens Bioelectron,2000(14): 841-848
[4]HASAN A,ABDURRAHMAN A,SAHAN S.Determination of aflatoxin levels in some dairy and food products which consumed in Ankara[J].Food Control,2005(16):263-266
[5]SIMEON N,MYERS R,BAYL C,et al.Some applications of near-ultraviolet laser-induced fluorescence detection innanomoar-and subnanomolar-range high-performance liquid Chromatography or micro-high-performance liquid chromatography[J].J Chromatogr A, 2001(913):253-259
[6]张春燕,潘国卿,刘来俊,等.反相高效液相色谱法测定乳及乳制品中的黄曲霉毒素M[J].理化检验-化学分册,2009,45(9):1032-1034
[7]Lin L M,Zhang J,Wang P.Thin-layer chromatography of mycotoxins and comparison with other chromatography methods[J].J Chromatogr A,1998,815:3
[8]胡骁飞,职爱民,刘庆堂,等.真菌毒素ELISA检测方法新进展[J].中国农学通报,2010,26(8):100-103
[9]Macrae R.现代实用高效液相色谱分析法[M].曹志军译.陕西:天则出版社,1992:193,194
[10]李丽萍.柱后衍生高效液相色谱法测定罗汉果甜甙中黄曲霉毒素B1[J].理化检验-化学分册,2008,44(5):414-415
[11]李佐卿,章再婷,谢东华,等.免疫亲和柱高效液相色谱法快速测定牛奶和奶粉中黄曲霉毒素M1、B1、B2、G1、G2[J].理化检验-化学分册,2005,41(6):406-408
[12]赵孔祥,胡筱芸,何佳,等.免疫亲和净化-液相色谱-串联质谱测定中成药中14个真菌毒素[J].药物分析杂志,2012,32(5):846-851
[13]CAVALIERE C,FOGLIA P,PASTORIN I E,et al.Liquid chromatography/tandem mass spectrometric confirmatory method for determining aflatoxin M1 in cowmilk comparison between electrospray and atmospheric pressure photo ionization sources[J].J Chromatogr A, 2006(1101):69-78
[14]VENTURA M,GOMEZ A,ANAYA I.Determination of aflatoxins B1, G1,B2 and G2 in medicinal herbs by liquid chromatography-tan-dem mass spectrometry[J].J Chromatog r A,2004(1048):25-29
Determination of Aflatoxin M1 and M2 in Milk and Dairy Products by Ultra-high Performance Liquid Chromatography-tandem Mass Spectrometry
LI Jia-jun,YANG Chun-lin*,HU Qiang,WU Wei,LÜ Xiao-ting
(Leshan Product Quality Supervision Inspection,Leshan 614000,Sichuan,China)
A method for the determination of2 aflatoxins(M1,M2)in milk and dairy products by immunoaffinity extraction coupled with ultra-high performance liquid chromatography-tandem mass spectrometry(UPLC-MS/MS)was developed.Aflatoxins in samples were extracted into acetonitrile/water system and deproteinized by adding additional acetonitrile,followed by stepwise purification using an immunoaffinity column.The target compounds were then eluted with methanol.With the gradient elution using a binary mobile phase containing of 0.1%formic acid solution and methanol/acetonitrile,the two aflatoxins were separated on a Waters Acquity UPLCHSST3 column(2.1×100mm,1.7μm particle size),followed by positive electrospray ionization and multi reaction monitoring provided by a triple-quadrupole tandem mass spectrometer,and quantified by external reference method.The calibration curve was linear over the concentration range of 0.1μg/L-50μg/L(r﹥0.998 5)and the detection limits of two aflatoxins were0.029μg/L-0.047μg/L.The recoveries from milk,milk powder and cream were generally between 69.56%and 88.43%and the relative standard deviations were3.69%-8.74%.
UPLC-MS/MS;fermented condiment;aflatoxins;immunoaffinity column clean-up
10.3969/j.issn.1005-6521.2014.04.022
2012-11-03
李佳峻(1987—),女(汉),助理工程师,本科,研究方向:食品安全与质量控制。
*通信作者

