一株产纤维素酶细菌的分离鉴定及酶学特性研究
贾博涵 周伟 赵罗迪 杨埔 苟敏
(四川大学建筑与环境学院,成都 610065)
一株产纤维素酶细菌的分离鉴定及酶学特性研究
贾博涵 周伟 赵罗迪 杨埔 苟敏
(四川大学建筑与环境学院,成都 610065)
从采集的含腐烂树叶的土壤中,筛选到1株产纤维素酶能力较高的菌株JJ-3,经16S rRNA基因序列分析,鉴定该菌株为产酸克雷伯氏杆菌(Klebsiella oxytoca)。产酶条件及酶学特性研究表明:以滤纸为碳源、蛋白胨为氮源、初始pH为8.0的培养基中发酵3 d更利于纤维素酶的合成;菌株发酵液在中性和碱性条件下均有较高的滤纸酶活力,分别可达118.7 U/mL(pH7.0),167.8 U/mL(pH8.0)和120 U/mL(pH9.0);所产纤维素酶的最适酶反应pH为7.0,最适酶反应温度为40℃,对温度比较敏感,在pH7.0-8.0的范围内具有较好的稳定性,能满足中性和碱性纤维素酶的要求。
纤维素酶 产酸克雷伯氏杆菌 产酶条件 酶学特性
利用秸秆等纤维素类生物质生产清洁能源及化工原料,可有效地缓解环境污染与能源危机的双重压力[1]。利用微生物产生的纤维素酶来转化纤维素成可发酵利用的还原糖,是纤维素资源化的有效途径。现有的纤维素酶大多来源于真菌和放线菌,这类菌繁殖周期长,且多产酸性纤维素酶[2]。
细菌产生的纤维素酶一般为中性或者碱性酶,因为其对天然纤维素的水解能力较弱,因此对其重视不够。近年来,随着中性和碱性纤维素酶在洗涤、造纸、纺织和废水处理等行业的成功应用,细菌纤维素酶已显示出良好的经济价值[3]。然而,现有细菌纤维素酶的研究和应用还处于起步阶段,需求量较大,而且其水解活力较低,反应成本高,难以实现工业化[4]。因此,筛选优良的产纤维素酶的细菌资源对实现纤维素资源化具有重要意义。本研究从采集的含腐烂树叶的土壤中筛选产纤维素酶能力高的菌株,旨在为获得中性和碱性纤维素酶的菌株提供参考。
1 材料与方法
1.1 材料
1.1.1 试验材料 菌株分离自四川大学江安校区内几处腐烂树叶下的表层土壤。
1.1.2 培养基 富集培养基:玉米秸秆1 g,滤纸1 g,报纸0.5 g,(NH4)2SO40.2 g,酵母粉0.05 g,NaCl 0.5 g,KH2PO40.4 g,CaCl2·6H2O 0.45 g,MgSO4· 7H2O 0.03 g,蒸馏水100 mL,pH调至8.0,灭菌。
初筛培养基:羧甲基纤维素钠(CMC-Na)0.2 g,(NH4)2SO40.2 g,酵母粉0.05 g,NaCl 0.5 g,KH2PO40.4 g,CaCl2·6H2O 0.45 g、MgSO4·7H2O 0.03 g,琼脂2 g,蒸馏水100 mL,pH调至8.0,灭菌。
发酵产酶培养基:CMC-Na 0.2 g,(NH4)2SO40.2 g, 酵 母 粉0.05 g,NaCl 0.5 g,KH2PO40.4 g,CaCl2·6H2O 0.45 g、MgSO4·7H2O 0.03 g,Tween-80 0.02 g,蒸馏水100 mL,pH调至8.0,灭菌。
1.2 方法
1.2.1 纤维素酶产生菌的分离鉴定
1.2.1.1 纤维素酶产生菌的富集 配制0.9%(W/V)的NaCl溶液100 mL,将采集的土壤样品混合均匀后悬浮于NaCl溶液中,并于30℃、150 r/min条件下振荡2 h。取10 mL静置后的上清液接种至100 mL富集培养基中培养3 d(30℃,150 r/min),再取10 mL培养液接种到新鲜培养基中继续培养,重复多次富集。
1.2.1.2 纤维素酶产生菌的筛选 用水解圈初筛,发酵复筛相结合的方法进行纤维素酶产生菌的筛选。将富集培养液涂布到初筛培养基平板上进行菌种分离,并采用刚果红染色法进行初筛,挑选能够产生较大透明圈的菌株。将初筛菌株接种到发酵产酶培养基中,测定滤纸酶活性,取酶活最大的菌株(命名为JJ-3)进一步研究。
1.2.1.3 菌株鉴定及16S rRNA基因序列分析 菌株JJ-3的种属鉴定由上海生工完成,并将菌株的16S rRNA 基因序列提交到GenBank数据库。利用软件Clustal X1.8进行多序列比对后[5],采用软件MEGA-3.1构建菌株JJ-3的系统发育树,构树方法为邻连法(Neighbor-Joining),bootstrap 检测1 000 次[6]。
1.2.2 菌株JJ-3产酶条件的优化
1.2.2.1 碳源对菌株产酶能力的影响 以1%(W/V)的 CMC-Na、滤纸、微晶纤维素、玉米秸秆和葡萄糖为唯一碳源的发酵产酶培养基中,分别接种菌株JJ-3,发酵培养3 d,测定滤纸酶活性。
1.2.2.2 氮源对菌株产酶能力的影响 以1%(W/V)的滤纸为唯一碳源,在液体发酵培养基中分别加入0.25%(W/V)的不同氮源(硝酸钾、酵母粉、蛋白胨、尿素和硫酸铵),接种菌株JJ-3发酵培养3 d,测定滤纸酶活性。
1.2.2.3 培养基pH对菌株产酶能力的影响 以滤纸和蛋白胨为唯一碳氮源,调节发酵培养基的初始pH为5.0-9.0,分别接种菌株JJ-3发酵培养3 d,测定滤纸酶活性。
1.2.2.4 发酵时间对菌株产酶能力的影响 以滤纸和蛋白胨为唯一碳氮源,调节发酵培养基的初始pH为8.0,接种菌株JJ-3分别发酵培养1-5 d,测定滤纸酶活性。
1.2.3 菌株JJ-3的滤纸酶酶学特性
1.2.3.1 温度对酶活的影响及酶的热稳定性 将测定滤纸酶酶活的水浴反应温度分别设定为30℃-70℃,其它条件同1.2.4的方法测定酶活,以最高值为100%,获得滤纸纤维素酶在不同pH条件下的相对酶活力。将粗酶液分别置于上述温度中处理1 h后,测定剩余酶活力,以未处理的粗酶液作为对照,评价纤维素酶的热稳定性。
1.2.3.2 pH对酶活的影响及酶的pH稳定性 利用磷酸缓冲液把滤纸酶酶活测定中底物溶液的pH 调节为4.0-9.0,其它条件同1.2.4的方法测定酶活,以最高值为100%,获得滤纸纤维素酶在不同温度下的相对酶活力。将粗酶液分别置于pH为4.0-9.0的磷酸缓冲溶液中处理1 h后,加入滤纸测定剩余酶活力,以未处理的粗酶液作为对照,评价纤维素酶的pH稳定性。
1.2.4 纤维素酶活力的测定 菌株JJ-3以8%的接种量接种到发酵产酶培养基中,于30℃、150 r/min培养3 d,取发酵液于4 000 r/min离心20 min,取上清(粗酶液)测定纤维素酶活性。通常采用滤纸纤维素酶(FPase)来衡量纤维素菌酶系的综合降解能力[7]。以滤纸为底物,应用二硝基水杨酸法在540 nm处测定吸光度值,每组做3个平行样,计算
FPase活力[7]。在上述条件下,每分钟由底物生成1 μmol还原糖所需酶量定义为一个酶活力单位,用U/mL表示。
2 结果
2.1 纤维素酶产生菌的分离与鉴定
采用水解圈初筛,发酵复筛的方法从土壤中分离到6株产纤维素酶的菌株,其中菌株JJ-3合成纤维素酶的能力最高(平板培养3 d后,菌落直径为0.6 cm,透明圈直径1.3 cm,复筛时酶活为38.5 U/mL),作为后续研究的对象。
在固体培养基上,菌株JJ-3的菌落呈圆形,表面光滑,隆起,边缘整齐,半透明,灰白色。经鉴定,该菌株的16S rRNA基因序列与产酸克雷伯氏杆菌(Klebsiella oxytoca)具有99%的序列相似性。将该序列登录GenBank,获得序列号为KJ801560,菌株JJ-3的系统发育位置见图1。

图1 菌株Klebsiella oxytoca JJ-3的系统发育树
2.2 菌株JJ-3发酵条件的优化
2.2.1 碳源对菌株产酶能力的影响 在液体产酶培养基中,分别以1%的 CMC-Na、滤纸、微晶纤维素、玉米秸秆和葡萄糖为唯一碳源,对菌株JJ-3进行发酵培养。图2-A显示,上述底物存在时,菌株JJ-3都具有纤维素酶活,以滤纸为唯一碳源时FPase活性最高(59.8 U/mL),其次为葡萄糖、玉米秸秆、微晶纤维素和CMC-Na。
2.2.2 氮源对菌株产酶能力的影响 考察了不同氮源(硝酸钾、酵母粉、蛋白胨、尿素和硫酸铵)对菌株JJ-3产纤维素酶的影响。图2-B显示,以蛋白胨为氮源可获得最大的FPase活性(182.8 U/mL),其次是酵母粉;以硝酸钾和硫酸铵为氮源时,FPase活性分别只有以蛋白胨为氮源时的17%和24.8%;尿素存在时几乎没有FPase活性。
2.2.3 培养基pH对菌株产酶能力的影响 菌株JJ-3在不同pH值(5.0-9.0)的液体发酵培养基中培养,3 d后测定各自的纤维素酶活力。图2-C表明,菌株JJ-3在pH值为5.0-9.0的培养基中生长时,均具有一定的FPase酶活性,中性和弱碱性条件更有利于获得高活性的FPase,pH值为8.0时纤维素酶活性最高(167.8 U/mL),其次是pH值为9.0时的120 U/mL和pH值为7.0时的118.7 U/mL。
2.2.4 发酵时间对菌株产酶能力的影响 菌株JJ-3在以滤纸为碳源、蛋白胨为氮源、pH值为8.0的液体发酵培养基中培养不同的天数,确定最佳的发酵时间。图2-D显示,培养时间对FPase活性影响较大,发酵3 d和4 d时具有最大的FPase活性(约104 U/mL),继续发酵则活性迅速降低,因此确定3 d是最佳的发酵时间。
2.3 菌株JJ-3的滤纸酶酶学特性
2.3.1 温度对酶活的影响及酶的热稳定性 温度对FPase酶反应的影响(图3)显示,FPase在30℃-50℃范围内具有一定活性,40℃为其最适酶反应温
度;温度升高到50℃时,剩余酶活仅为33.1%;温度继续升高,FPase活性被完全抑制。粗酶液在不同温度保温1 h后FPase活性均有不同程度的下降,其热稳定性与温度对酶反应的影响具有相同的趋势(图3),表明菌株JJ-3的纤维素酶对温度比较敏感。
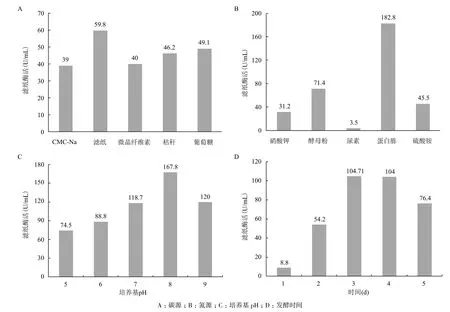
图2 菌株JJ-3的发酵条件优化
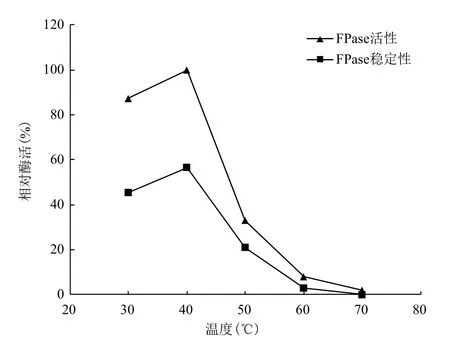
图3 温度对酶活的影响及酶的热稳定性
2.3.2 pH对酶活的影响及酶的pH稳定性 pH对FPase酶反应的影响(图4)显示,FPase在pH值为5.0-8.0的范围内具有一定活性,pH值为7.0时酶活性最高,当pH为9.0时酶活性被完全抑制,表明菌株JJ-3的纤维素酶在中性环境能更好地降解纤维素。此外,菌株JJ-3的纤维素酶对酸有一定的耐受能力。用不同的pH缓冲液处理粗酶1 h后,在pH值为7.0-8.0的范围内仍有50%-53%的纤维素酶活,表现出较好的稳定性,而当pH>8.0时FPase活性完全丧失(图4)。
3 讨论
从自然界筛选高效的纤维素酶生产菌是实现纤维素资源化的前提和基础。刚果红平板法是最常用的识别产纤维素酶菌株的方法,具有直观、快捷的优势。一般认为,纤维素酶活性与刚果红染色的透明水解圈大小(或者水解圈与菌落的直径比值Hc)呈正比,且水解圈出现越早,产酶越快。但也有研
究表明:不同菌株的最佳产酶条件存在差异,即使同一菌株在液体培养和固体培养时也表现出不同的生理特性,透明圈无法完全代表菌株的产酶能力[8]。因此,水解圈筛选后的液体发酵或滤纸条崩解等复筛验证过程必不可少[9]。采用水解圈初筛,发酵复筛的方法,本研究从校园土壤中获得一株拥有较高纤维素酶活力的产酸克雷伯氏杆菌。产酸克雷伯氏杆菌属于革兰氏阴性菌,多数研究认为该菌具有固氮能力[10],但对其降解纤维素的探讨仅有零星报道。如蔡燕飞[11]从环境中分离出一株产酸克雷伯氏杆菌株,对香蕉杆具有一定的降解效果。Wood等[12]发现产酸克雷伯氏杆菌具有较好耐糖能力,因此利用其分解纤维素产生的葡萄糖来合成重要的化工原料2,3-丁二醇。因此,本研究获得的菌株可为纤维素的利用提供有效的微生物资源。

图4 pH对酶活的影响及酶的pH稳定性
不同微生物生产纤维素酶的条件不同,因此优化培养条件是提高纤维素酶产量的最直接有效途径。据报道,大多数微生物来源的纤维素酶需要底物的诱导才能产生,而且容易利用碳源的存在(如葡萄糖等)会抑制纤维素酶的合成[13]。但菌株JJ-3以CMC-Na、滤纸、微晶纤维素、玉米秸秆和葡萄糖为唯一碳源时,均检测到一定的纤维素酶活性。而且以葡萄糖为碳源时具有较好的纤维素酶活性(49.1 U/mL),说明葡萄糖对纤维素酶的合成并未表现出阻遏作用。这些结果推测菌株JJ-3的纤维素酶可能为组成型表达,韩如旸等[14]报道菌株Clostridium sp. EVA1产生的纤维素酶也有类似结果。研究发现氮源对菌株JJ-3产酶能力的影响较大,蛋白胨是最佳的氮源,尿素几乎完全抑制了纤维素酶的生成,说明有机氮源比无机氮源更有利于纤维素酶的合成。也有研究发现纤维素降解菌Penicillium decumbens L-06的FPase活性在以蛋白胨为氮源时最高[15]。尿素为氮源会大大抑制Aspergillus sp. YN1中FPase的合成[16]。菌株JJ-3在不同pH值的发酵培养基中(5.0-9.0)均可合成纤维素酶,但中性和弱碱性条件获得的FPase活性更高,基本具备作为中性和碱性纤维素酶的要求。酶学特性显示菌株JJ-3合成的纤维素酶属于中温酶,在中性和弱碱性范围内表现出较好的稳定性,但对温度非常敏感。因此,后续研究可通过诱变或基因工程手段,来提高其对环境条件的耐受能力,以保证其在纤维素资源化中的应用。
4 结论
以秸秆、滤纸和报纸为原料,经水解圈初筛和发酵复筛,从校园含腐烂树叶的土壤中获得一株生产纤维素酶的细菌菌株,鉴定其为产酸克雷伯氏杆菌(Klebsiella oxytoca),GenBank登录号为KJ801560。产酶条件优化结果显示:菌株JJ-3的纤维素酶可能为组成型表达,无需底物诱导就能产生;有机氮源和中性或碱性条件更利于纤维素酶的合成;且最优产酶条件如下:碳源为滤纸,氮源为蛋白胨,培养基初始pH为8.0,发酵3 d。酶学特性结果显示:FPase的最适酶反应温度为40℃,对温度比较敏感;最适酶反应pH为7.0,在pH值为7.0-8.0的范围内仍有50%-53%的纤维素酶活,表现出较好的稳定性,基本满足中性和碱性纤维素酶的要求。
[1]王庆昭, 郑宗宝, 刘子鹤, 等.生物炼制工业过程及产品[J].化学进展, 2007, 19(7):1198-1205.
[2]顾方媛, 陈朝银, 石家骥, 等.纤维素酶的研究进展与发展趋势[J].微生物学杂志, 2008, 28(1):83-87.
[3]刘刚, 余少文, 孔舒, 邢苗.碱性纤维素酶及其应用的研究进展[J].生物加工过程, 2005, 3(2):9-14.
[4]Himmel ME, Ding SY, Johnson DK, et al. Biomass recalcitrance:engineering plants and enzymes for biofuels production[J]. Science, 2007, 315(5813):804-807.
[5]Thompson JD, Gibson TJ, Plewniak F, et al. The CLUSTAL_ X windows interface:flexible strategies for multiple sequence
alignment aided by quality analysis tools[J]. Nucleic Acids Research, 1997, 25(24):4876-4882.
[6]Tamura K, Dudley J, Nei M, et al. MEGA4:molecular evolutionary genetics analysis(MEGA)software version 4.0[J]. Mol Biol Evol, 2007, 24(8):1596-1599.
[7]Li X, Gao P. Isolation and partial properties of cellulose-decomposing strain of Cytophaga sp. LX-7 from soil[J]. J Applied Microbiol, 1997, 82(1):73-80.
[8]陈燕, 周孙全, 郑奇士, 等.常温纤维素降解菌的分离与鉴定[J].上海交通大学学报:医学版, 2010, 30(8):1018-1021.
[9]廖青, 江泽普, 邢颖, 等.发酵床中纤维素降解菌的分离与鉴定[J].生物技术通报, 2014(3):106-110.
[10]覃丽萍, 黄思良, 李杨瑞.植物内生固氮菌的研究进展[J].中国农学通报, 2005, 21(2):150-152.
[11]蔡燕飞, 李华兴, 彭桂香, 等.纤维素分解菌的筛选及鉴定[J].林产化学与工业, 2005, 25(2):67-70.
[12]Wood BE, Yomano LP, York SW, et al. Development of industrialmedium-required elimination of the 2, 3-butanediol fermentation pathway to maintain ethanol yield in an ethanologenic strain of Klebsiella oxytoca[J]. Biotechnol Prog, 2005, 21(5):1366-1372.
[13]高培基, 许平.环境资源微生物技术[M].北京:化学工业出版社, 2004:15-109.
[14]韩如旸, 梅建凤, 闵航, 等.嗜热厌氧纤维素降解菌对纤维素的粘附及其酶活性研究[J].浙江大学学报:农业与生命科学版, 2001, 27(2):165-168.
[15]刘韫滔, 禤淑霞, 龙传南, 等.纤维素降解菌 L-06 的筛选、鉴定及其产酶条件的分析[J].生物工程学报, 2008, 24(6):1112-1116.
[16]赵方圆, 范宁杰, 陈一楠, 等.纤维素降解菌 Aspergillus sp.YN1的产酶条件及酶学特性[J].微生物学通报, 2010, 37(8):1194-1199.
(责任编辑 马鑫)
Isolation,Identification and Enzymatic Characterization of a Cellulase-Producing Bacteria
Jia Bohan Zhou Wei Zhao Luodi Yang Pu Gou Min
(College of Architecture and Environment,Sichuan University,Chengdu 610065)
A cellulase-producing bacteria strain JJ-3 with high activity was isolated from the soil containing rotted leaves, which was identified as Klebsiella oxytoca based on the 16S rRNA sequence analysis. The optimal enzyme-producing conditions of strain JJ-3 was investigated and was as follows:filter paper as carbon source, peptone as nitrogen source, pH8.0, three-day fermentation. And the fermentation culture had higher FPase activity under neutral and alkaline conditions, with 118.7 U/mL(pH7.0), 167.8 U/mL(pH8.0), 120 U/mL(pH9.0). The results of enzymatic characterization showed that the optimal pH and temperature for enzyme reaction was 7.0 and 40℃, respectively. FPase was sensitive to temperature, while it kept good stability during the pH7.0 to 8.0. This study suggested that the cellulase from strain JJ-3 meets the request of neutral and alkaline cellulase.
Cellulase Klebsiella oxytoca Enzyme-producing conditions Enzymatic characterization
2014-05-21
国家自然科学基金项目(31200068)
贾博涵,男,研究方向:环境微生物工程;E-mail:jiabohanscu@163.com
苟敏,女,博士,硕士生导师,研究方向:有机废弃物资源化;E-mail:gouminscu@163.com

