重组酵母产人IFN-α2a与LL-37融合蛋白的工艺优化
张明杰
(广东紫金正天药业有限公司,河源 517000)
重组酵母产人IFN-α2a与LL-37融合蛋白的工艺优化
张明杰
(广东紫金正天药业有限公司,河源 517000)
通过单因素试验探索重组酵母P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的最佳条件。结果显示,重组酵母菌产蛋白酶的最佳表达条件是利用BMMY为诱导培养基,以接种量OD600=5.5、温度26℃、pH6.0、诱导剂(甲醇)为每隔24 h添加1.0%、振荡速度为200 r/min条件下连续诱导144 h。在最佳培养条件下,发酵液中的LL-37最高抗菌活性达27.9 mm。与初始的发酵条件相比,人LL-37基因与IFN-α2a融合蛋白的产量提高了32.29%。
干扰素α2a LL-37 工艺
英国科学家Isaacs和Lindenmann于1957年发现一种能干扰病毒感染的细胞因子,命名为干扰素[1]。随着人类研究的深入,不断发现了许多新的干扰素分子。目前,人类在哺乳动物中发现的干扰素共有10个家族,其中人干扰素有7个家族。按其功能和作用方式,可将人干扰素细分为I型、II型和III型。I型包括α、β、ε、τ、ω、κ,具有抗病毒和抗肿瘤的功能;II 型包括γ,具有调节免疫的功能[2];III型为干扰素样蛋白,功能与I型类似,但受体不同[3]。人IFN-α2a是由165个氨基酸残基构成,具有防治病毒性疾病[4]和恶性肿瘤[5]的功能。LL-37是目前在人体内发现的抗菌肽Cathelicedin家族中唯一的成员,对革兰氏阳性菌和阴性菌均具有较广谱的抗性[6]。除此之外,LL-37还具有免疫调节作用,可趋化单核细胞、T淋巴细胞、中性粒细胞和肥大细胞等[7]。当人体受到病原微生物、炎症或创伤刺激,LL-37的表达水平就会上升[8]。动物试验表明,LL-37可明显降低铜绿假单胞菌感染小鼠的死亡率[2]。
将人LL-37基因与IFN-α2a融合表达,形成同时具有抗病毒、抗肿瘤和抗菌的三重功效的新功能蛋白,在一些特殊的临床治疗中存在潜在的市场需求。本课题组前期的工作实现了在毕赤酵母(Pichia pastoris)GS115表达三功能的人LL-37基因与IFN-α2a融合蛋白。在进入工业化生产之前,有必要建立所构建的基因工程菌工艺条件,并对产品的应用
性能进行验证。本研究通过单因素试验旨在探索重组酵母P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的最佳条件。
1 材料与方法
1.1 材料
1.1.1 试验菌株 P. pastoris GS115LI,表达人LL-37基因与IFN-α2a融合蛋白。大肠杆菌(Escherichia coli)ATCC 25922,用于检测融合蛋白的抗菌活性。
1.1.2 培养基
1.1.2.1 YPD培养基 酵母提取物10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,121℃灭菌30 min。
1.1.2.2 BMGY培养基 见参考文献[10]。
1.1.2.3 BMMY培养基 同BMGY培养基,仅将其中的甘油10 mL换为甲醇5 mL。
1.1.2.4 初始培养基 种子培养:保藏的菌种先经YPD活化,后将入BMGY培养基,接种量2%,后振荡培养。培养条件:温度28℃,转速200 r/min,培养时间24 h。
诱导培养:种子培养液离心去培养液,后接种入BMMY培养液,使酵母OD600值达6.0,在温度28℃与转速150 r/min下振荡培养,每24 h补充甲醇0.5%(体积比)诱导表达[11],重复诱导5次。
1.2 方法
1.2.1 单因素发酵试验
1.2.1.1 诱导时长对P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的影响 按出发条件进行诱导,诱导过程中每12 h取样分析发酵液抗菌活性,直至检测的抗菌活性不再上升。
1.2.1.2 接种量对P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的影响 按前述确定的最佳诱导时长,分别调节接种量以OD600计为3.5、4.0、4.5、5.0、5.5、6.0、6.5和7.0,其它条件不变。诱导完成后取发酵液分析抗菌活性。
1.2.1.3 温度对P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的影响 在出发条件的基础上,按前述确定的最佳诱导时间与接种量,改变诱导温度,分别置于24℃、26℃、28℃、30℃和32℃下振荡培养。培养完后取样检测产物的抗菌活性。
1.2.1.4 溶氧对P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的影响 通过改变摇床的转速探索溶氧对重组P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的影响。分别选择摇床转速为120、160、240和280 r/min进行诱导培养,其它条件参照前述选择的最佳条件。诱导结束后取发酵液分析抗菌活性。
1.2.1.5 诱导剂(甲醇)添加量对P. pastoris GS115-LI产人LL-37基因与IFN-α2a融合蛋白的影响 通过改变诱导剂甲醇的添加量分别对体积比为0.6%、0.8%、1.0%、1.2%、1.4%和1.6%的菌株进行诱导表达。其它诱导条件为前述所确定的最佳条件。诱导结束后取发酵液分析抗菌活性。
1.2.1.6 pH对P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的影响 为了探索pH对P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的影响,分别选择pH为5.0、5.5、6.0、6.5、7.0、7.5和8.0进行试验。其它发酵条件为前述优化的最佳条件。诱导结束后取发酵液分析抗菌活性。
1.2.2 验证试验 在上述确定的最适培养和诱导表达条件下,重复试验3次,进行验证。
1.2.3 发酵液中人LL-37基因与IFN-α2a融合蛋白的抗菌活性分析 培养液中LL-37的活性测定参照文献[5]。用E. coli ATCC 25922作为检测菌种,用双层琼脂糖打孔法测定。底层培养基上打直径3 mm的圆孔,每孔加10 μL发酵液,37℃孵化3 h后,在底层上覆盖一层营养琼脂,37℃继续培养20 h,测量无菌生长的透明圈直径。
2 结果
2.1 诱导时长的影响
诱导时长对P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的影响结果(图1)显示,诱导开始后的前24 h,发酵液中检测出的以抗菌活性表示的融合蛋白产量上升较慢,这可能与菌体本身处于环境适应期的延迟期有关;而后产量呈直线上升,至第132 h,此后产量缓慢上升,至144 h达到最大值25.3 mm;此后24 h的诱导期内,融合蛋白产量出现轻微下降,可能是由于宿主老化后,产品有所降解引起。根据以上试验结果,确定144 h为最佳诱导时长。
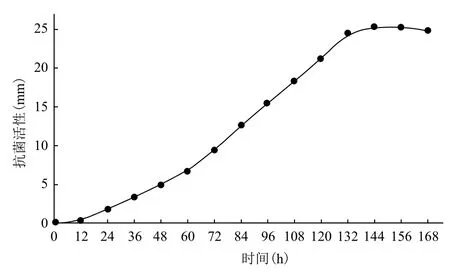
图1 诱导时长对P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的影响
2.2 接种量的影响
接种量对P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的影响结果(图2)显示,随着接种量自OD600=3.5上升,在其它条件不变的情况下,发酵液中以LL-37抗菌活性表示的人LL-37基因与IFN-α2a融合蛋白逐渐上升,至接种量达到OD600=5.5后,达到最大值约26.0 mm;之后,呈现逐渐下降的趋势。这表明,当OD600<5.5,发酵液中的酵母浓度太少,导致表达能力低。在OD600=5.5时达到饱和。之后再升高酵母浓度,可能由于营养或溶氧供应受限,从而导致产物的合成能力不升反降。在此,选择接种量为OD600≈5.5作为最佳的接种条件。
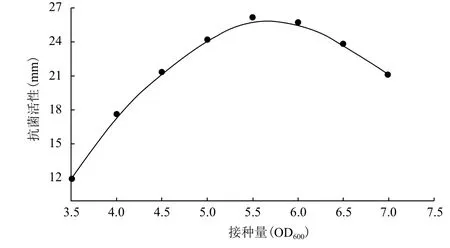
图2 接种量对P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的影响
2.3 温度的影响
温度对P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的影响结果(图3)显示,在温度为26℃时,以抗菌活性表示的人LL-37基因与IFN-α2a融合蛋白产量最高,可达26.5 mm以上。温度低于26℃,产量会有所下降,可能与低温下酵母代谢活性受影响有关。温度高于26℃,产量也出现下降,可能与在温度高时,酵母自身代谢加快后,衰老同样加快的原因。综合上述情况,选择26℃作为诱导时的最佳温度条件。
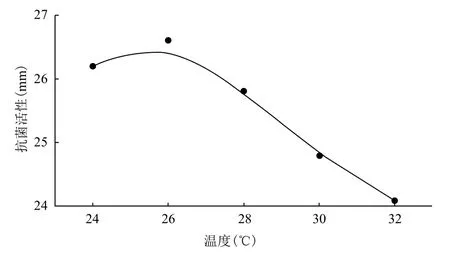
图3 温度对P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的影响
2.4 溶氧的影响
在摇瓶阶段,溶氧难以直接测定,故只能采用以摇床振荡转速为依据来进行探索。溶氧对P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的影响结果(图4)显示,在振荡转速低于200 r/min时,由于溶氧处于受限状态,故以抗菌活性表示的人LL-37基因与IFN-α2a融合蛋白产量较低。振荡转速高于200 r/min后,产量不再继续上升,表明此阶段溶氧已经到达饱和。综合考虑效应与成本,选择200 r/min作为诱导表达时最佳的溶氧控制条件。
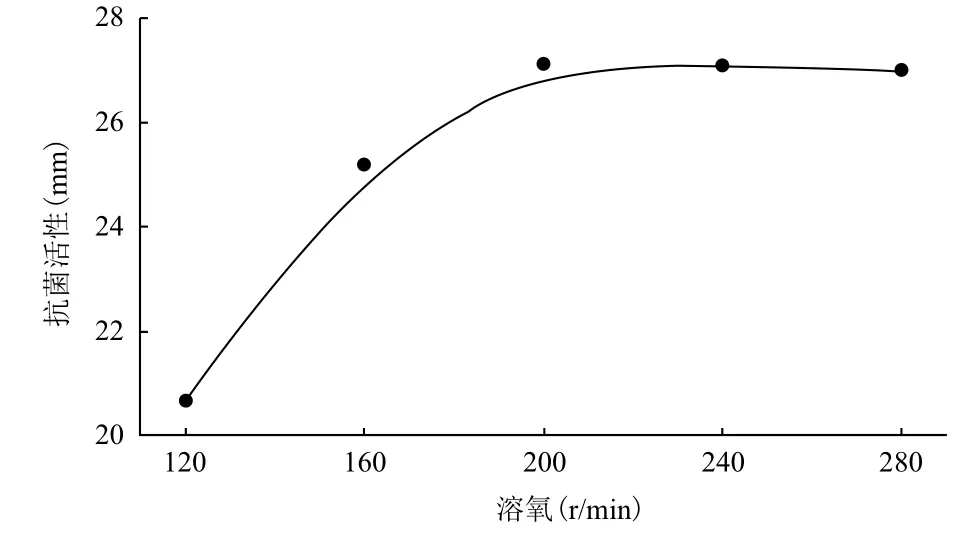
图4 溶氧对P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的影响
2.5 诱导剂(甲醇)添加量的影响
诱导剂(甲醇)添加量对P. pastoris GS115LI产
人LL-37基因与IFN-α2a融合蛋白的影响结果(图5)显示,甲醇浓度添加量为1.0%(以体积比计,下同)时,以抗菌活性计的人LL-37基因与IFN-α2a融合蛋白表达量达最大,约为27 mm。低于1.0%,可能是由于诱导的强度不够,表达速度下降,致使产物产量下降。高于1.0%,可能是由于诱导强度太大,超出了宿主菌的代谢负荷,反而产生负作用,从而也使表达量下降。综合考虑选择1.0%为诱导的最佳甲醇用量。
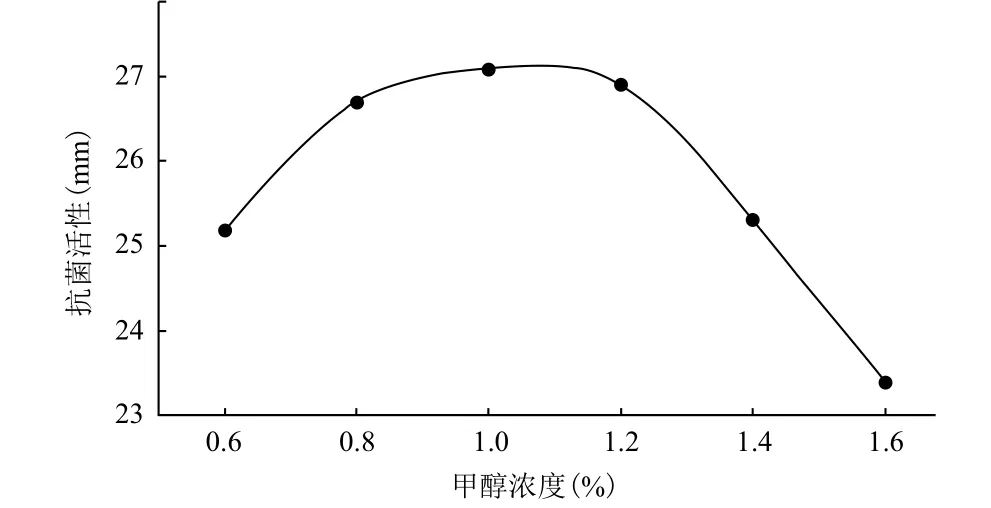
图5 甲醇添加量对P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的影响
2.6 pH的影响
pH对P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的影响结果(图6)显示,试验条件下,pH6.0时人LL-37基因与IFN-α2a融合蛋白的表达量最高,达到27.5 mm以上。pH主要通过影响细胞膜及基质的带电状态,从而影响膜对基质的通透性,再传递到对产物产量的影响。酵母的最适生长pH为偏酸性的环境,此处产物最佳表达量所需的pH6.0,恰好可在不影响宿主本身生长条件下实现产物的最佳表达,故确定pH6.0为最佳条件。
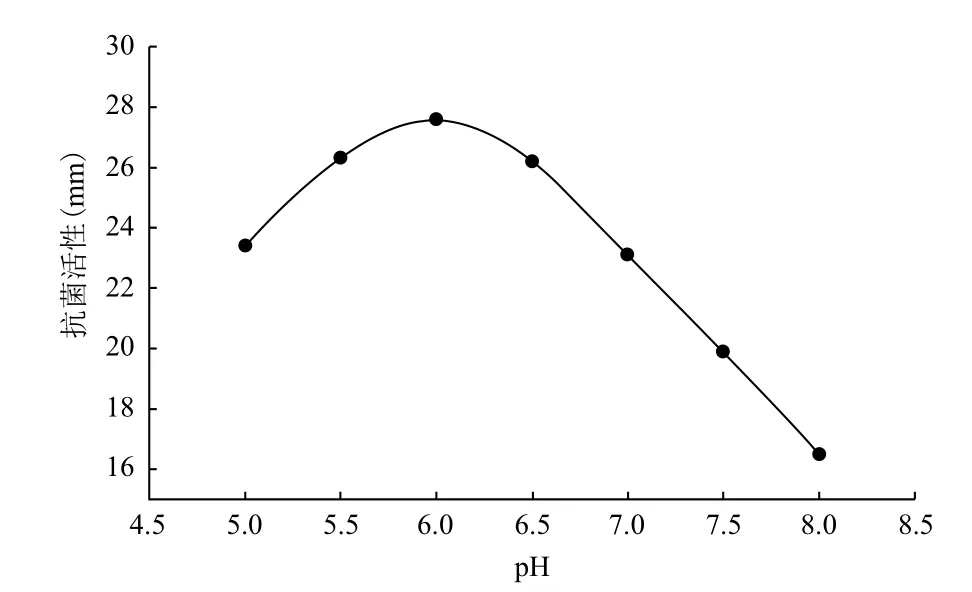
图6 pH对P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的影响
2.7 最佳工作条件验证
根据前面的试验结果,确定P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的最佳工艺条件为利用BMMY培养基,接种量以OD600计为5.5、温度26℃、pH6.0、诱导剂(甲醇)为每隔24 h添加1%、振荡速度为200 r/min条件下连续诱导144 h。在该工艺条件下重复验证3次,得到结果(以LL-37抗菌活性计)分别为27.8、28.1和27.9 mm,平均值为27.93±0.12(mm)。该结果与出发培养条件下的表达量(21.1 mm,参考1.2.1.1诱导时间120 h时的结果)相比,产物产量提高了32.39%。
3 讨论
LL-37作为人源性抗菌肽,已经在临床上获得广泛的应用。由于其分子小,与其它蛋白多肽或蛋白类药物融合表达时,不易对与其融合蛋白的功能产生影响,因此将LL-37与其它蛋白融合表达生产多功能药物成为可能[13]。例如,将LL-37与人酸性成纤维细胞生长因子融合表达形成的新蛋白,既具有酸性成纤维细胞生长因子促进伤口愈合的功能,又具有防止伤口感染的功能[14]。受此思路的启发,将LL-37与人IFN-α2a融合表达,构建出了同时具有抗癌、抗病毒和抗菌的三效药物。发酵工艺是将构建的蛋白转化为产物的关键。
从单因素试验的各因素变化所引起的人LL-37基因与IFN-α2a融合蛋白表达水平的波动情况分析,接种量、时间和pH是3个较为敏感的量,其它属于次敏感量,这可能预示着这些因素对表达产量的关键程度。接种量主要影响发酵时延迟期的长短和菌体与营养之间的协调关系。接种量小,延迟期长,产物合成量低;接种量大,菌体浓度高,会引起营养竞争[15]。pH不仅影响宿主菌对外源基因的表达,同时也可能对产物的稳定性及活性产生影响[16]。适宜的培养条件,有利于提高细胞的相对活性和延长细胞的高相对活性状态,从而实现融合蛋白产量的最大化累积[17,18]。各因素之间的影响还需要通过正交试验或序贯试验设计,利用统计学的原理进行详细分析。
试验中为了操作的方便,仅以LL-37的抗菌
活性进行表征。经过在菌种构建阶段的试验确认,LL-37的抗菌活性检测与IFN-α2a干扰素活性检测结果是相一致的,表明二者既实现了融合,而且融合蛋白还同时保留了二者各自独立时的活性(结果发表在本课题组另一篇文章中)。
本试验所有数据均是建立在摇瓶的试验基础之上的。众所周知,摇瓶并不能真正代替发酵罐的生产,因此本试验的结果还只能是发酵生产的参考。在达到生产水平之前,还需通过小型发酵罐进一步优化工艺参数,再逐步放大至生产规模。
4 结论
本研究确定了重组毕赤酵母P. pastoris GS115LI产人LL-37基因与IFN-α2a融合蛋白的最佳工艺条件为利用BMMY培养基、接种量以OD600=5.5、温度26℃、pH6.0、诱导剂(甲醇)为每隔24 h添加1%、振荡速度为200 r/min条件下连续诱导144 h。与出发条件相比,产量提高了32.29%。
[1]Borden EC, Sen GC, Uze G, et al. Interferons at age 50:past, current and future impact on biomedicine[J]. Nature Reviews Drug Discovery, 2007, 6(12):975-990.
[2]Pestka S. The interferons:50 years after their discovery, there is much more to learn[J]. Journal of Biological Chemistry, 2007, 282(28):20047-20051.
[3]O' Brien TR. Interferon-alfa, interferon-lambda and hepatitis C[J]. Nat Genet, 2009, 41(10):1048-1050.
[4]Beilharz MW, Cummins JM, Bennett AL. Protection from lethal influenza virus challenge by oral type 1 interferon[J]. Biochemical and Biophysical Research Communications, 2007, 355(3):740-744.
[5]Bodaghi B, Gendron G, Wechsler B, et al. Efficacy of interferon alpha in the treatment of refractory and sight threatening uveitis:a retrospective monocentric study of 45 patients[J]. British Journal of Ophthalmology, 2007, 91(3):335-339.
[6]Chen X, Niyonsaba F, Ushio H, et al. Synergistic effect of antibacterial agents human β-defensins, cathelicidin LL-37 and lysozyme against Staphylococcus aureus and Escherichia coli[J]. Journal of Dermatological Science, 2005, 40(2):123-132.
[7]Mookherjee N, Lippert DND, Hamill P, et al. Intracellular receptor for human host defense peptide LL-37 in monocytes[J]. The Journal of Immunology, 2009, 183(4):2688-2696.
[8]Kai-Larsen Y, Agerberth B. The role of the multifunctional peptide LL-37 in host defense[J]. Frontiers in Bioscience:A Journal and Virtual Library, 2007, 13:3760-3767.
[9]Jacobsen F, Mittler D, Hirsch T, et al. Transient cutaneous adenoviral gene therapy with human host defense peptide hCAP-18/ LL-37 is effective for the treatment of burn wound infections[J]. Gene Therapy, 2005, 12(20):1494-1502.
[10]柯野, 罗晓春, 谢明权.米曲碱性蛋白酶基因的克隆表达及水解特性研究[J].华南理工大学学报:自然科学版, 2012, 40(8):40-45.
[11]汤鸣强, 薛盛果, 叶鹏.米曲霉F-81产中性蛋白酶的固定化条件及其特性[J].生物技术通报, 2012(3):159-165.
[12]杨云霞, 朱玲, 王伯瑶, 等.人抗菌肽LL-37突变分子的特性和抗菌能力的比较.华西药学杂志, 2006, 21(5):422-424.
[13]Dannehl C, Gutsmann T, Brezesinski G. Surface activity and structures of two fragments of the human antimicrobial LL-37[J]. Colloids and Surfaces B:Biointerfaces, 2013, 109:129-135.
[14]Shen J, Lu X, Jin X, et al. Expression of a novel dual-functional protein-The antimicrobial peptide LL-37 fused with human acidic fibroblast growth factor in Escherichia coli[J]. Protein Expression and Purification, 2012, 81(1):119-125.
[15]Charoenrat T, Khumruaengsri N, Promdonkoy P, et al. Improvement of recombinant endoglucanase produced in Pichia pastoris KM71 through the use of synthetic medium for inoculum and pH control of proteolysis[J]. Journal of Bioscience and Bioengineering, 2013, 116(2):193-198.
[16]Reinholz M, Ruzicka T, Schauber J. Cathelicidin LL-37:an antimicrobial peptide with a role in inflammatory skin disease[J]. Annals of Dermatology, 2012, 24(2):126-135.
[17]Potvin G, Ahmad A, Zhang Z. Bioprocess engineering aspects of heterologous protein production in Pichia pastoris:A review[J]. Biochemical Engineering Journal, 2012, 64:91-105.
[18]Lo TM, Teo WS, Ling H, et al. Microbial engineering strategies to improve cell viability for biochemical production[J]. Biotechnology Advances, 2013, 31(6):903-914.
(责任编辑 马鑫)
The Process Optimization of Pichia pastoris GS115LI for Producing Fused Protein of LL-37 and IFN-α2a
Zhang Mingjie
(Pharmaceutical Co.,Ltd. Guangdong Zijing Zhengtian,Heyuan 517000)
With experiments of single factor, the optimal process of recombinant P. pastoris GS115LI for producing fused protein of LL-37 and IFN-α2a were using BMMY as inducing medium, inoculum as OD600=5.5, temperature as 26℃, pH6.0, inducing chemical(methanol)adding amount as 1.0% every 24 h, incubating shaking speed as 200 r/min, and inducing time as 144 h. Under those optimal conditions, the 27.9 mm of LL-37 antimicrobial activity could be gotten. Compared with the original conditions, the productivity of fused protein of LL-37 and IFN-α2a was increased as 32.29%.
Interferon-α2a LL-37 Fermentation process
2014-03-18
广东省重大科技专项(2011A080502011)
张明杰,教授,研究方向:微生物工程技术;E-mail:mingjiezh@126.com

