干旱胁迫对槭叶草生长及光合生理特性的影响
张 爽,董 然,董 妍,白盼盼,陈天宇
(1 吉林农业大学 园艺学院,吉林 长春130118,2 长春友谊公园管理所 吉林 长春132000)
槭叶草(Mukdeniarossii(Oliv.)Koidz)是虎耳草科(Saxifragaceae)槭叶草属(Mukdenia)多年生草本植物,主产于我国吉林省长白山区安图等县市,属吉林省重点保护野生植物,其植株矮小,花穗大,美丽鲜艳,叶形奇特,秋季变红,是优良的野生地被植物[1]。目前,对槭叶草的研究主要集中在药理药效及繁殖技术等方面,对其在园林绿化中的应用研究较少,而生态适应性的研究更未见报道。有部分学者从槭叶草的原生境推测其具有抗旱性,宫敬利[2]在槭叶草引种驯化技术研究中发现,槭叶草在炎热干旱的天气叶片容易过早老化;马全等[3]认为,槭叶草应栽植于假山溪水的绿化区和绿化带。但这些研究均缺乏理论依据。
为此,本研究通过盆栽控水试验,研究土壤自然失水胁迫对槭叶草生长、生理及光合特性的影响,旨在探讨槭叶草的耐旱性,为其引种驯化及确定其在园林中的应用范围提供理论支持和实践依据。
1 材料与方法
1.1 材 料
供试材料为长白山野生槭叶草的3年生种子苗,2013-03-10将具有相同芽数的根茎移栽到规格为20 cm×18 cm (直径×高)的塑料盆中(盆内所装基质由吉林农业大学园林试验基地内园土、沙子和草炭按体积比为2∶1∶1混合而成,其田间持水量为39.26%,每盆土质量为(1.5±0.2) kg),置于吉林农业大学园林试验基地的温室内生长,期间根据温室的条件进行正常肥水管理。
1.2 方 法
试验在吉林农业大学园林试验基地内进行。2013-05-17,选取长势良好,株高、冠幅基本一致的槭叶草移入旱棚内适应生长。2013-06-02开始干旱处理,采用人工给水后通过自然耗水的方法获取土壤水分梯度。即将处理植株分为2组,一组为对照组(CK),正常浇水;另一组为持续干旱组,试验处理前充足灌水3 d使土壤水分饱和,以后不再浇水使其自然干旱;每组5次重复,每个重复15盆,共150盆。干旱胁迫开始前(处理0 d),随机选取5盆,用环刀在盆内取0~5 cm土层的土样20 g左右,分别装入已知质量的铝盒中,盖好盖子(防止水分散失),带回实验室测定土壤相对含水量(SRWC,土壤含水量占田间持水量的百分率),结果取平均值;以后每隔5 d按此方法测定1次土壤SRWC,共处理30 d,获得7个SRWC,分别为:93.35%(0 d),55.8%(5 d),36.49%(10 d),18.49%(15 d),13.42%(20 d),12.46%(25 d)和11.01%(30 d)。同时每组选取成熟功能叶片各3片,3次重复,共18片,带回实验室测定其生理指标。天气晴好时打开旱棚的塑料布,以保证试验在自然条件下进行,下雨时则遮上塑料布。
1.3 测定项目及方法
1.3.1 土壤SRWC及槭叶草生长、生理指标 参考张治安等[4]的方法,土壤SRWC采用烘干法测定;叶片相对含水量(LRWC)采用饱和称重法测定,自然水分饱和亏缺采用烘干称重法测定,细胞膜透性采用电导率仪法测定,丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法测定。株高为茎基部到生长点的距离,用直尺测量;叶面积参考丁爱萍等[5]的方法计算。叶绿素和类胡萝卜素含量参考李合生[6]的方法测定。
1.3.2 光合参数 用美国 PP Systems 公司的CIRAS-2 型便携式光合仪进行测定,用LED光源控制光合有效辐射为1 000 μmol/(m2·s)。测定前使槭叶草叶片得到充分的光适应;每个处理选3株,每株选取3片相同部位的叶片,共 9次重复。仪器自动记录净光合速率(Pn)、胞间CO2浓度(Ci),气孔导度(Gs)和蒸腾速率(Tr)等光合作用参数,计算水分利用率(WUE):WUE=Pn/Tr,气孔限制值(Ls):Ls=1-Ci/Ca,其中Ca为空气中的CO2浓度。
1.4 数据分析
采用Excel 2003绘制折线图;使用DPSv 7.05软件对数据进行统计分析,采用Duncan’s新复极差法进行差异显著性分析。
2 结果与分析
2.1 干旱胁迫对槭叶草生长的影响
由图1可知,槭叶草的株高和叶面积均随干旱胁迫时间的延长呈先上升后下降的变化趋势。干旱胁迫时间≤10 d时,槭叶草株高和叶面积与对照组差异较小,变化趋势基本一致,均呈上升趋势;随着干旱胁迫时间的继续延长,干旱组的株高和叶面积增长缓慢,与对照组的差异逐渐加大,至20 d时,其株高和叶面积分别较对照组下降了13.62%和26.69%;此后,干旱胁迫组的株高和叶面积均呈缓慢下降趋势。
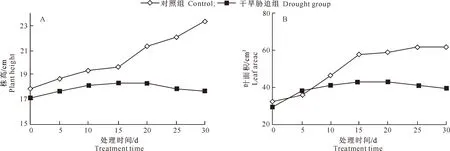
图1 干旱胁迫下槭叶草株高(A)和叶面积(B)的变化
2.2 干旱胁迫对槭叶草叶片相对含水量和自然水分饱和亏缺的影响
由图2可知,随着胁迫时间的延长,槭叶草叶片相对含水量(LRWC)呈下降趋势,自然水分饱和亏缺呈上升趋势。干旱胁迫时间≤10 d时,槭叶草叶片LRWC下降不明显,10 d时仅较对照组下降了5.12%;此后,LRWC急剧下降,与对照组差异显著,至胁迫30 d时,干旱组LRWC较对照组下降了52.62%。干旱胁迫组槭叶草叶片自然水分饱和亏缺变化趋势与LRWC相反,在干旱胁迫时间≤10 d时与对照组差异较小,而后与对照组差异逐渐加大,至胁迫30 d时,自然水分饱和亏缺是对照组的7.71倍。
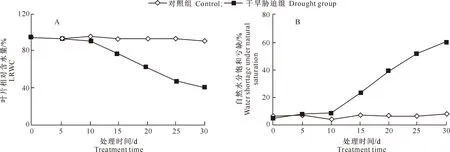
图2 干旱胁迫下槭叶草叶片相对含水量(A)和自然水分饱和亏缺(B)的变化
2.3 干旱胁迫对槭叶草叶片细胞膜透性和MDA含量的影响
干旱胁迫下,植物细胞膜透性增大,电解质外渗,引起电导率增加;同时植物体内活性氧增多,导致膜脂过氧化,产生MDA。由图3可知,随干旱胁迫时间的延长,槭叶草叶片相对电导率(REC)和MDA含量均呈上升趋势。干旱胁迫时间≤10 d时,REC上升幅度较小,与对照组差异不大;此后,REC显著升高,与对照组差异加大,至胁迫30 d时,REC是对照组的3.22倍。MDA含量在持续干旱15 d(SRWC为18.4%)时与对照组差异较小;此后,MDA含量急剧升高,与对照组差异加大,至胁迫30 d时,其MDA含量是对照组的4.83倍。
2.4 干旱胁迫对槭叶草叶绿素和类胡萝卜素含量的影响
叶绿素是植物光合作用中最重要的色素,而类胡萝卜素(Car.)既是光合色素又是内源抗氧化剂,能够消除活性氧,防止膜脂过氧化[7]。由表1可以看出,随着干旱胁迫时间的延长,处理组槭叶草叶片中的叶绿素a (Chl a)、叶绿素b (Chl b)、叶绿素a+b (Chl a+b)、类胡萝卜素含量和叶绿素a/b (Chl a/b)均不断降低。干旱胁迫时间≤10 d,Chl a和类胡萝卜素含量降幅较小,与对照组无显著差异(P>0.05);之后,Chl a、类胡萝卜素含量均显著或极显著降低,至试验结束时,均极显著低于对照组(P<0.01)。干旱胁迫时间≤5 d,处理组槭叶草叶片中叶绿素b、a+b含量和叶绿素a/b与对照组无显著性差异(P<0.05),之后均显著或极显著降低,至试验结束时,均极显著低于对照组(P<0.01)。
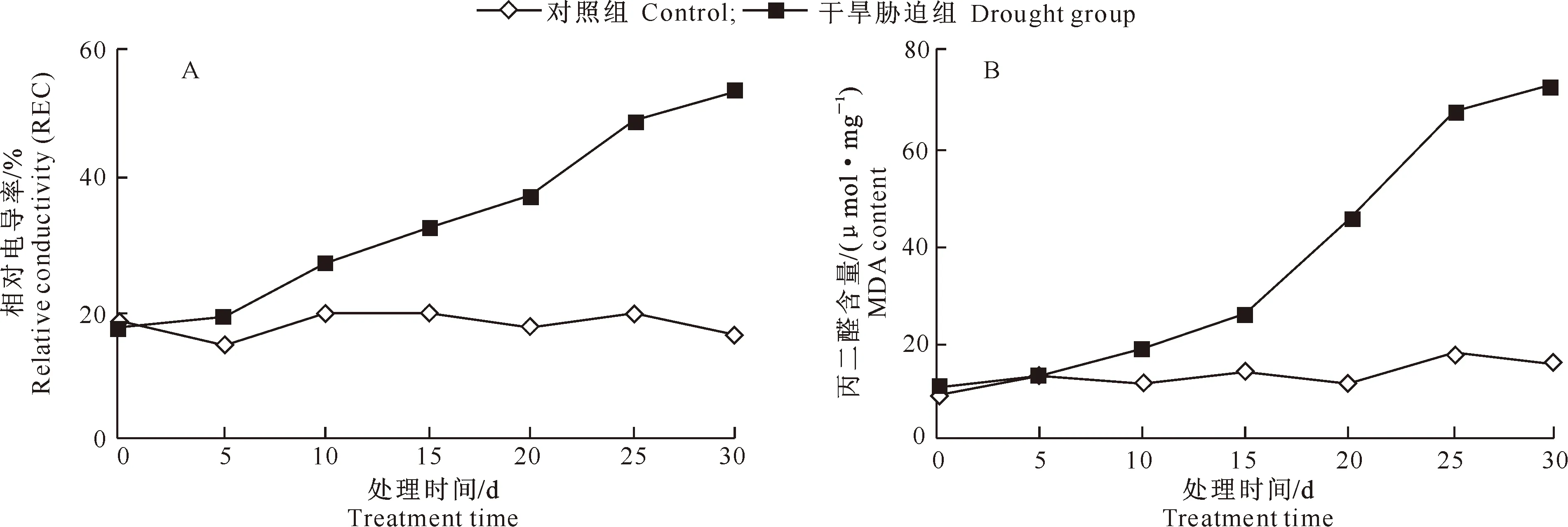
图3 干旱胁迫下槭叶草叶片 REC (A)和MDA含量 (B)的变化
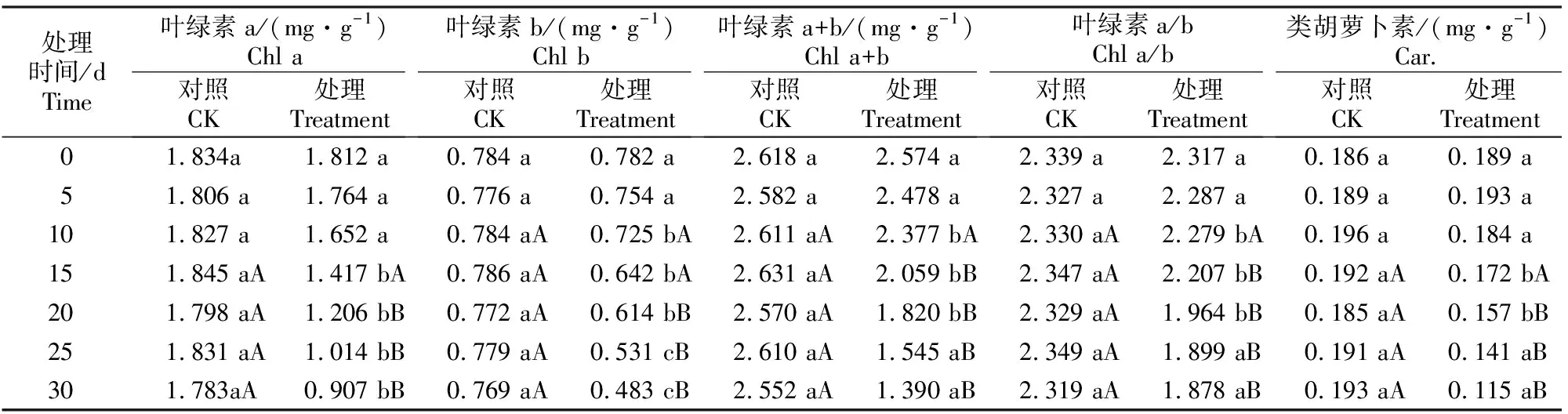
表1 土壤干旱胁迫下槭叶草叶片叶绿素和类胡萝卜素含量的变化
2.5 土壤干旱胁迫对槭叶草光合参数的影响
植物对干旱胁迫的光合生理响应在很大程度上反映了植物的抗旱性[8]。由表2可以看出,随着干旱胁迫时间的延长,Pn、Gs、Tr呈下降趋势,Ci呈先下降后上升的趋势,WUE和Ls呈先上升后下降的趋势。

表2 干旱胁迫下槭叶草叶片光合参数的变化
干旱胁迫时间≤5 d,处理组槭叶草叶片Pn下降幅度较小,与对照组无显著性差异(P<0.05);之后下降幅度增大,至试验结束时,Pn极显著低于对照(P<0.01)。干旱胁迫处理期间,干旱组Gs极显著低于对照组(P<0.01);Tr在协迫5 d时显著低于对照组,之后极显著低于对照组(P<0.01)。处理组Ci在干旱胁迫5和20 d时与对照组差异不显著(P>0.05),在10和15 d时极显著低于对照组,在25和30 d时极显著高于对照组(P<0.01)。干旱胁迫15 d以内,干旱组WUE和Ls不断升高,15 d时分别是对照组的1.86和2.8倍,差异极显著(P<0.01);之后,WUE和Ls则不断下降。
3 讨 论
水分是影响植物扩展生长的重要因素之一,水分亏缺能够改变细胞壁的伸展性能,导致细胞壁的伸展因生长受抑而明显降低[9]。有研究表明,干旱胁迫下,植株生长变缓,株高降低,植物叶面积减小,蒸腾失水减少[10]。本研究表明,在干旱胁迫10 d时,SRWC为36.49%,此时槭叶草株高和叶面积的生长较为稳定,而此后均不断减小,说明超出此干旱时间和土壤水分点后,植株的生长开始受到了抑制,这与李清明[9]的研究结果一致。
LRWC和自然水分饱和亏缺能够反映植物体内的水分状况,是衡量植物抗旱能力强弱的重要指标[11]。本研究结果表明,干旱胁迫10 d时,槭叶草LRWC缓慢降低,自然水分饱和亏缺缓慢升高;干旱胁迫对槭叶草叶片生理指标的影响较大,说明槭叶草具有较强的保水能力。植物叶片在受到水分胁迫时,细胞膜结构遭到破坏,膜脂过氧化,细胞内电解质外渗,从而导致植物叶片REC升高。MDA是膜脂过氧化的产物,是判断膜脂过氧化程度的重要指标。本研究表明,槭叶草叶片REC和MDA随胁迫时间的延长及LRWC的降低呈上升趋势。干旱胁迫10 d时,槭叶草叶片REC缓慢升高,MDA变化不明显,说明此时膜脂过氧化程度较低,细胞膜尚未受到严重破坏,表明槭叶草对干旱的耐受性较强。
光合色素是反映植物光合能力的一个重要指标,其含量的变化在一定程度上能够反映植物的抗旱性[12]。本研究结果表明,干旱胁迫10 d时,槭叶草叶片叶绿素和类胡萝卜素含量降低幅度较小,说明此时槭叶草受到的影响较小。
干旱胁迫对植物光合作用的影响较大,通常影响光合作用的因素分为气孔限制因素和非气孔限制因素。Farquhar等[13]和许大全[14]认为,若Pn减小伴随着Gs和Ci降低,而Ls升高,则Pn的减小是由气孔限制因素引起的;而当Pn减小伴随着Ci升高和Ls降低时,Pn的减小则是由非气孔限制因素引起的。本研究结果表明,干旱胁迫15 d以内,Pn、Gs和Ci均随胁迫时间的增加不断下降,而Ls不断升高,说明此时Pn的降低是由气孔限制因素引起的,即轻度干旱引起气孔开度减小甚至关闭,CO2进入叶片受阻,导致光合底物CO2不足,引起Pn减小。而此后,Pn继续减小,同时伴随着Ci升高和Ls降低,说明此时Pn的减小主要是由非气孔限制因素引起的,即重度干旱胁迫引起叶肉细胞光合活性下降,同化CO2的能力降低,从而导致Pn减小。这与大多数的研究结果[15-16]一致。
WUE是衡量碳同化和水分消耗关系的重要指标[17]。干旱胁迫下,植物可以通过减小气孔开度降低Tr,从而调节WUE的变化,这是植物的一种重要的抗旱机制[18]。本研究结果表明,干旱胁迫15 d时,Gs大幅减小,气孔逐渐关闭,Pn和Tr都不断下降,但Tr下降幅度大于Pn,从而导致WUE增加,即在此胁迫时间和土壤相对含水量范围内,槭叶草能够维持较高的WUE,说明其具有较强的抗旱能力,这与裴斌等[19]对沙棘的研究结果一致。
4 结 论
本研究结果表明,槭叶草具有较强的抗旱能力。干旱胁迫10 d时(即基质SRWC为36.49%时),槭叶草能够维持较高的Pn和WUE,生长较为稳定,各生理指标均未出现明显变化。干旱胁迫15 d时(即SRWC为18.49%时),槭叶草Pn下降是由气孔限制因素引起的,而此后,其Pn下降主要是由非气孔限制因素引起的。综合以上生长、生理及光合参数各指标分析认为,在发生持续干旱时,对槭叶草进行补水最好在干旱发生的15 d内进行。
[参考文献]
[1] 中国科学院中国植物志编辑委员会.中国植物志:第三十四卷第二分册 [M].北京:科学出版社,1992.
Flora Reipublicae Popularis Sinicae Editorial Board of CAS.Flora Reipublicae Popularis Sinicae:The second volume 34 [M].Beijing:Science Press,1992.(in Chinese)
[2] 宫敬利.槭叶草驯化栽培技术研究 [D].北京:中国农业科学院,2007.
Gong J L.Study on the tame cultivation technique ofMukdeniarossii(Olive) Koidz [D].Beijing:Chinese Academy of Agricultural Sciences,2007.(in Chinese)
[3] 马 全,杨淑娟,袁晓红.长白山早春植物与东北地区园林绿化 [J].中国林副特产,2008(1):85-86.
Ma Q,Yang S J,Yuan X H.Early spring growth plants in Changbai Mountain and the vegetation gardening in northeast China [J].Forest By-Product and Speciality in China,2008(1):85-86.(in Chinese)
[4] 张治安,陈展宇.植物生理学实验技术 [M].长春:吉林大学出版社,2008:130-138.
Zhang Z A,Chen Z Y.Plant physiology experiment technology [M].Changchun:Jilin University Press,2008:130-138.(in Chinese)
[5] 丁爱萍,王 瑞,张卓文,等.12 种园林植物耐荫性鉴定指标的筛选 [J].植物生理学通讯,2009,45(1):55-59.
Ding A P,Wang R,Zhang Z W,et al.Selection of shade-tolerance identification indices for 12 garden plant species [J].Plant Physiology Communications,2009,45(1):55-59.(in Chinese)
[6] 李合生.植物生理生化实验原理和技术 [M].北京:高等教育出版社,2006:167-260.
Li H S.Plant physiological and biochemical experiment principle and technology [M].Beijing:Higher Education Press,2006:167-260.(in Chinese)
[7] 米海莉,许 兴,李树华,等.水分胁迫对牛心朴子、甘草叶片色素、可溶性糖含量及碳氮比的影响 [J].西北植物学报,2004,24(10):1816-1821.
Mi H L,Xu X,Li S H,et al.Effects of soil water stress on contents of chlorophyll,soluble sugar,starch,C/N of two desert plants (CynanchumkomaroviiandGlycyrrhizauralensis) [J].Acta Bot Boreal-Occident Sin,2004,24(10):1816-1821.(in Chinese)
[8] 徐宜凤.石灰花楸幼苗对干旱胁迫的生长及生理响应 [D].南京:南京林业大学,2011.
Xu Y F.Effects of drought stress on the growth and physiological characteristics inSorbusfolgneriseedlings [D].Nanjing:Nanjing Forestry University,2011.(in Chinese)
[9] 李清明.温室黄瓜(CucumissativusL.)对干旱胁迫与 CO2浓度升高的响应与适应机理研究 [D].陕西杨凌:西北农林科技大学,2008.
Li Q M.Study on the response and adaptation mechanism of greenhouse cucumber (CucumissativusL.) to drought stresses and elevated CO2concentration [D].Yangling,Shaanxi:Northwest A&F University,2008.(in Chinese)
[10] 王晨阳.土壤水分胁迫对小麦形态及生理影响的研究 [J].河南农业大学学报,1992,26(1):89-98.
Wang C Y.The effects of soil water stress on morphological and physiological of wheat [J].Acta Agriculturae Universitatis Henanensis,1992,26(1):89-98.(in Chinese)
[11] 刘晓东,潘秀秀,何 淼.土壤干旱胁迫对二月兰幼苗生理特性的影响 [J].东北林业大学学报,2011,39(7):32-34.
Liu X D,Pan X X,He M.Effect of soil drought stress on physiological properties ofOrychophragmusviolaceusseedlings [J].Journal of Northeast Forestry University,2011,39(7):32-34.(in Chinese)
[12] 王 虹.夏秋季节干旱胁迫对红叶桃光合特性及相关生理指标的影响 [D].南京:南京农业大学,2008.
Wang H.Study on the photosynthesis characteristics and relative physiological index of red-leaf peach under drought stress in summer and autumn [D].Nanjing:Nanjing Agricultural University,2008.(in Chinese)
[13] Farquhar G D,Ehleringer J R,Hubick K T.Carbon isotope discrimination and photosynthesis [J].Annual Review of Plant Physiology and Plant Molecular Biology,1989,40:503-537.
[14] 许大全.光合作用效率 [M].上海:上海科学技术出版社,2002:26.
Xu D Q.Photosynthetic efficiency [M].Shanghai:Shanghai Science and Technology Press,2002:26.(in Chinese)
[15] 姚庆群,谢贵水.干旱胁迫下光合作用的气孔与非气孔限制 [J].热带农业科学,2005,25(4):80-85.
Yao Q Q,Xie G S.The photosynthetic stomatal and nonstomatal limitation under drought stress [J].Chinese Journal of Tropical Agriculture,2005,25(4):80-85.(in Chinese)
[16] 邓春暖,章光新,潘响亮.干旱胁迫对莫莫格湿地芦苇叶片光合生理生态的影响机理研究 [J].湿地科学,2012,10(2):136-141.
Deng C N,Zhang G X,Pan X L.Mechanism of influence of drought stress on photosynthetic physiological ecology ofPhragmitesaustralisleaves in momoge wetlands [J].Wetland Science,2012,10(2):136-141.(in Chinese)
[17] 范苏鲁,苑 兆,冯立娟,等.水分胁迫对大丽花光合作用、蒸腾和气孔导度的影响 [J].中国农学通报,2011,27(8):119-122.
Fan S L,Yuan Z,Feng L J,et al.Effects of water stress on photosynthesis,transpiration and stomatal conductance inDahlialeaves [J].Chinese Agricultural Science Bulletin,2011,27(8):119-122.(in Chinese)
[18] Steduto P,Katerji N,Puertos-Molina H,et al.Water-use efficiency of sweet sorghum under water stress conditions:Gas-exchange investigations at leaf and canopy scales [J].Field Crops Research,1997,54(2/3):221-234.
[19] 裴 斌,张光灿,张淑勇,等.土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响 [J].生态学报,2013,33(5):1386-1396.
Pei B,Zhang G C,Zhang S Y,et al.Effects of soil drought stress on photosynthetic characteristics and antioxidant enzyme activities inHippophaerhamnoidesLinn.seedlings [J].Acta Ecologica Sinica,2013,33(5):1386-1396.(in Chinese)

