脊尾白虾应答温度变化的5种因子活性分析*
高 焕,薛 蓓,赵 莲,于 飞,赖晓芳,阎斌伦,董丽君,孟 梦
(1.淮海工学院a.江苏省海洋生物技术重点实验室;b.海洋学院,江苏 连云港 222005;2.连云港市渔业技术指导站,江苏 连云港 222001)
0 引言
脊尾白虾(Exopalaemoncarinicauda,Holthuis)作为我国特有的物种,在我国沿海区域均有分布,其中尤以黄海、渤海产量最多[1]。该虾具有繁殖能力强(1年内可多次产卵,繁殖期8个月)、生长速度快(1年内可多茬养殖)、生长季节长(生长期11个月)和环境适应性广(耐低氧、广温、广盐和广食)等优点[2],因此,其人工养殖前景十分广阔。在脊尾白虾的各种养殖模式[3]中,一种秋冬季养殖模式很值得关注。因为该虾具有很强的温度适应性(2~39℃),即使在水温低于-3℃时也不会冻死[3],在温度18~24℃之间胚胎都可以进行正常的发育[4],因此很适合秋冬季时节气温还比较低的情况下养殖。为了更好地发挥该虾的低温养殖特性,有必要对该虾的相关低温生物学特征进行研究,以便为培育耐低温特性的快速生长新品系或品种提供指导和帮助。本研究希望从温度这一环境因素入手,通过对脊尾白虾血清中酸性磷酸酶(acid phosphatase,ACP)活性、碱性磷酸酶 (alkaline phosphatase,AKP)活性、过氧化氢(hydrogen peroxide,H2O2)浓度、过氧化物酶(peroxydase,POD)活性和总抗氧化能力(total antioxidant capacity,T-AOC)的检测,来探讨脊尾白虾应答温度变化的生理反应机制,以便为更好地利用这一机制培育耐低温的新品种提供指导帮助。
1 材料与方法
1.1 材料
实验用脊尾白虾为连云港地区养殖池塘中捕获的个体。选择大小相近的个体,平均体长为(2.14±0.47)cm、体质量(5.85±0.40)g。经室内暂养1周后进行实验。
1.2 实验分组及温度设置
共分为实验组和对照组2组,每组放入脊尾白虾40尾。每组虾放于玻璃缸中,并把玻璃缸放于塑料泡沫箱中,通过水浴的方式控制温度,温度精确度为±0.5℃。实验过程中对照组一直保持25℃不变,实验组则从25℃起,每h降1℃,降至5℃时,开始升温,升温幅度为每h升1℃,直到水温恢复到25℃为止。期间,分别在降温阶段的25,20,15,10,5℃和升温阶段的10,15,20,25℃共9个时间点取样,每次取样数量为3尾。
1.3 血淋巴制备
用注射器从脊尾白虾心脏中插入抽取血淋巴,置于1.5mL Eppendorf管中,并与抗凝剂(NaCl 450mmol/L,KCl 10mmol/L,EDTA.2Na 10mmol/L,HEPES 10mmol/L)以体积比1∶1混合均匀,经冷冻高速离心后析出上层血清以供酶活性测定。
1.4 非特异免疫因子活性测定
本实验所用药品购自南京生物工程研究所,共测定5种因子的活性或浓度:酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、总抗氧化能力(T-AOC)、过氧化物酶(POD)和过氧化氢(H2O2)。相关因子的测定方法参考试剂盒说明书进行。血清中蛋白浓度采用考马斯亮蓝法测定,具体参见试剂盒(南京生物工程研究所)使用说明书。牛血清白蛋白(AMRESCO公司)为标准蛋白。
1.5 数据处理
采用成组数据的t-test法对处理组和对照组进行比较。P<0.05时表示差异显著,P<0.01时表示差异极显著。
2 结果与分析
2.1 温度变化对脊尾白虾酸性磷酸酶活性的影响
酸性磷酸酶(ACP)活性随温度变化的情况如图1所示。与对照组相比,在25~10℃温度下降阶段,ACP活性呈升高趋势,至10℃时达到峰值,随后开始下降;虽然从5℃升高至10℃时其活性略有上升,但随后便迅速下降到和对照组相同的活性水平。t-test检验表明,温度变化后的活性水平与对照组相比,差异显著(P<0.05)。

图1 温度变化下的酸性磷酸酶(ACP)活性Fig.1 Changing of ACP activity in response to different temperature stress
2.2 温度变化对脊尾白虾碱性磷酸酶活性的影响
碱性磷酸酶(AKP)活性随温度变化的情况如图2所示。与酸性磷酸酶在温度下降阶段的活性变化情况相比,在25~5℃温度下降阶段,AKP活性则呈下降趋势,至5℃时达到最低值;随后随温度上升AKP活性开始增强,在20℃时恢复到对照组活性水平。t-test检验表明,温度变化后的活性水平与对照组相比,差异极显著(P<0.01)。
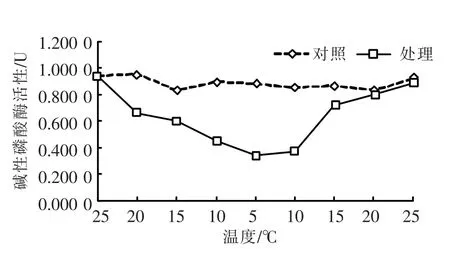
图2 温度变化下的碱性磷酸酶(AKP)活性Fig.2 Changing of AKP activity in response to different temperature stress
2.3 温度变化对脊尾白虾过氧化氢浓度的影响
过氧化氢(H2O2)浓度随温度变化的情况如图3所示。在25~5℃温度下降阶段,过氧化氢(H2O2)浓度为平稳中略有上升;在5~15℃温度上升阶段,过氧化氢(H2O2)浓度迅速升高,随后随着温度进一步升高,则又迅速下降,至20℃时恢复到对照组的浓度水平。t-test检验表明,温度变化后的活性水平与对照组相比,总体差异不显著(P>0.05),但在5~15℃温度上升阶段,呈极显著差异(P<0.01)。
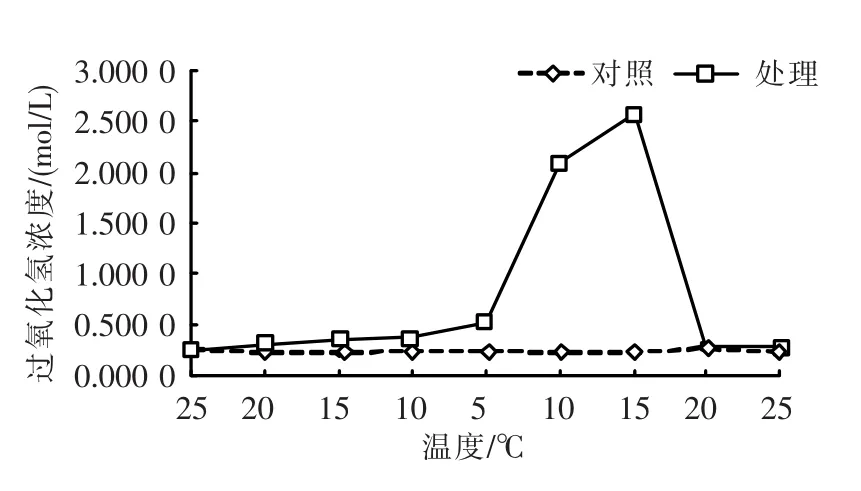
图3 温度变化下的过氧化氢(H2O2)浓度Fig.3 Changing of H2O2content in response to different temperature stress
2.4 温度变化对脊尾白虾过氧化物酶活性的影响
过氧化物酶(POD)活性随温度变化的情况如图4所示。在25~5℃温度下降阶段,过氧化物酶(POD)活性高于对照组,但差异并不显著(P>0.05);在5~15℃温度上升阶段,过氧化物酶(POD)活性迅速升高并在15℃时达到峰值,随后随着温度进一步升高,则又迅速下降。t-test检验表明,温度变化后的过氧化物酶活性水平与对照组相比,差异显著(P<0.05)。

图4 温度变化下的过氧化物酶(POD)活性Fig.4 Changing of POD activity in response to different temperature stress
2.5 温度变化对脊尾白虾总抗氧化能力的影响
总抗氧化能力(T-AOC)随温度变化的情况如图5所示。在25~10℃温度下降阶段,总抗氧化能力(T-AOC)呈上升趋势,随后在10~5℃温度下降期间,活性降低;而在5~10℃温度升高阶段活性又升高,随后10~25℃温度升高阶段则呈下降趋势,在恢复到25℃时,总抗氧化能力(T-AOC)值甚至低于对照组。t-test检验表明,温度变化后的总抗氧化能力(T-AOC)值与对照组相比,差异显著(P<0.05)。

图5 温度变化下的总抗氧化能力(T-AOC)Fig.5 Changing of T-AOC value in response to different temperature stress
3 讨论
温度是影响生物生存和生长的最重要因素之一,尤其是对于属于变温动物的虾类生物影响更大。已有的研究表明,水温对生物机体内自由基水平及其抗氧化防御体系有着显著的影响[5],温差的急剧变化可造成机体自由基代谢紊乱,而大量的自由基在体内积累后会损害机体细胞和组织正常的生理机能和免疫防御能力[6]。因此,本研究选择了酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、总抗氧化能力(TAOC)、过氧化物酶(POD)和过氧化氢(H2O2)的活性或浓度等与氧化还原系统相关的指标来考察脊尾白虾在温度变化情况下的生理反应。
酸性磷酸酶(ACP)和碱性磷酸酶(AKP)都广泛存在于甲壳动物体内,作为巨噬细胞溶酶体酶的重要组成部分[7],是一种对底物专一性较低的磷酸单酯水解酶,参与机体内磷酸基团转移和代谢[8],因此它们也是与能量代谢相关的酶类。本研究中,酸性磷酸酶和碱性磷酸酶的活性在温度下降阶段正好相反,酸性磷酸酶呈上升趋势,而碱性磷酸酶则呈下降趋势。温度下降阶段酸性磷酸酶活性上升,说明该酶所催化的反应增强,这可能与温度下降阶段脊尾白虾需要更多的能量来应答环境变化有关,而温度上升阶段该酶活性下降也印证了这一推断。至于碱性磷酸酶,可能与酸性磷酸酶在体内的作用正好相反。
机体内的过氧化氢(H2O2)是一种对生物机体有害的物质,其可以形成活性氧,对机体产生危害[9]。本研究中,过氧化氢浓度在温度下降阶段变化不明显,而在温度从5℃起始升高阶段表达量则显著升高,这说明温度降低不会促使体内的氧化自由基增多,而温度升高则会显著促使此类氧化物质增加,而这也与抗氧化的POD酶活性的变化相一致。POD在生物体内主要起催化分解氧化物或过氧化物的作用[10],属于抗氧化酶类。本研究中,该酶在温度下降阶段,其活性变化虽然略呈升高状态,但是变化并不显著,在从5℃起始升高阶段表达量则显著升高,说明体内产生了大量的氧化自由基,机体为消除这些有害物质,而提高了抗氧化酶类的表达量,而且比较H2O2浓度和POD活性的变化曲线可以发现,二者具有一致性,说明二者间可能存在着内在的联系。
总抗氧化能力(T-AOC)可以代表体内各种抗氧化物的总体水平[11]。在温度下降阶段,脊尾白虾中的T-AOC活性逐步升高,在温度上升阶段又再一次升高并随后下降。这说明无论温度降低或升高的环境变化都可能导致机体内产生氧化自由基,并使机体作出相应的生理应答反应,提高抗氧化能力的水平。
[1] 王绪峨.脊尾白虾繁殖生物学的初步观察[J].动物学杂志,1987,22(1):7-10.
[2] 王兴强,阎斌伦,马甡,等.脊尾白虾生物学及养殖生态学研究进展[J].齐鲁渔业,2005,22(8):21-23.
[3] 孙益奎.盐田效益池秋冬季养殖脊尾白虾的探讨[J].苏盐科技,2002,12(4):12-13.
[4] 陈卫平.不同温度、盐度下脊尾白虾Exopalaemoncarinicauda(Holthuis)早期胚胎和幼体发育的观察研究[J].现代渔业信息,2005,20(5):23-26.
[5] 李大鹏,刘松岩,谢从新,等.水温对中华鲟血清活性氧含量及抗氧化防御系统的影响[J].水生生物学报,2008,32(3):327-332.
[6] 李强,李华,传俊,等.温度对凡纳滨对虾血淋巴免疫指标的影响[J].大连水产学院学报,2008,23(2):132-135.
[7] 郑慧,李彬,荣小军,等.盐度和溶解氧对刺参非特异性免疫酶活性的影响[J].渔业科学进展,2014,35(1):118-124.
[8] 吴维福,陈娈娈,李郁娇,等.三丁基锡对罗氏沼虾血清中免疫酶活力的影响[J].广东海洋大学学报,2014,34(3):17-21.
[9] 宋林生,季延宾,蔡中华,等.温度骤升对中华绒螯蟹(Eriocheirsinensis)几种免疫化学指标的影响[J].海洋与湖沼,2004,35(1):74-77.
[10] ASHIDA M,SÖDERHÄLL K.The prophenoloxidase activating system in crayfish[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1984,74(1):21-26.
[11] 金玲,黄国伟,石雁川,等.木瓜粉对缺血性脑梗塞患者总抗氧化能力的影响[J].天津医科大学学报,2002,8(4):435-436.

