中草药红茶菌的制备及其体内抗口蹄疫病毒活性
符乃方,吴俊才,符启俊,吕 律,何继军,李开绵,叶剑秋,蒋盛军* ,蒋小强,邱红辉,高李泽,何萍,谢峥嵘,陈吉雄
(1.中国热带农业科学院,热带作物品种资源研究所,海南儋州 571737;2.中国农业科学院兰州兽医研究所农业部畜禽病毒学重点开放实验室家畜疫病病原生物学国家重点实验室国家口蹄疫参考实验室,甘肃兰州 730046;3.海南东方市畜牧局动物疾病预防控制中心,海南东方 570100)
口蹄疫是由口蹄疫病毒(foot-and-mouth disease virus)引起的偶蹄类动物疾病。口蹄疫是影响畜牧业发展的最重要的动物传染病,在世界动物卫生组织列为A类传染病中的头号传染病,在我国,该病也列为一类动物疫病。口蹄疫的爆发会给当地畜牧业造成严重的损失。2001年英国爆发口蹄疫疫情,扑杀700万头牲畜,造成85亿英镑的损失,同时,该疫情还波及法国、荷兰、爱尔兰等国,这些国家共扑杀多达36万头牲畜[1]。在发展中国家,注射口蹄疫疫苗是预防口蹄疫最有效的措施之一。但由于口蹄疫病毒是RNA病毒,病毒的基因和病毒的抗原特性改变很快,因此,这显著增加了研制高效的口蹄疫疫苗的难度。虽然发达国家采用动物扑杀可以有效预防口蹄疫,但一旦爆发口蹄疫,大量没有免疫的动物面临更大的感染风险[2]。因此,口蹄疫的防控依然是畜牧业中动物疫控研究最重要的研究课题之一。采用有效的卫生措施也是预防口蹄疫的技术措施之一。
口蹄疫病毒是一种对酸高度敏感的病毒。这是因为口蹄疫病毒在酸性条件下脱下蛋白衣壳进行繁殖;如果它还没有侵染进入动物细胞,提前脱下蛋白衣壳将会影响病毒的繁殖而导致病毒的死亡[3-4]。中草药红茶菌是一种利用红茶菌发酵茶叶、罗汉果、甘草、野菊花等中草药提取液的新型红茶菌菌液。由于它保留了红茶菌的产酸特性,因此中草药红茶菌制剂可以体外有效杀灭口蹄疫病毒。茶叶、罗汉果、甘草、野菊花是一些具有药食两用的中草药植物,这些植物的提取液普遍具有提高动物免疫力、拮抗病原细菌、病毒等方面的作用。为了进一步挖掘中草药红茶菌抑制口蹄疫病毒潜力,笔者在此介绍了这种中草药红茶菌的制备、中草药红茶菌体内抗口蹄疫病毒活性的试验结果。
1 材料与方法
1.1 试验材料
1.1.1 中草药红茶菌的制备。所用红茶菌菌种购自北京食品研究所。红茶菌母液的制备参考吕爱军等提供的方法[5]。制备中药提取液是将0.2%茶叶、0.5%甘草、0.2%罗汉果和0.2%野菊花放入水溶液中煮沸,过滤后冷却到约30℃以下时加入20%红茶菌母液,静置发酵2周后用于检测或临床使用。
1.1.2 口蹄疫病毒。猪O型O/China/99株,系猪源O型口蹄疫乳鼠组织毒。该毒株对乳鼠半数致死量(LD50)为10-8.0,对猪半数感染量(SID50)为10-6.0,攻毒时用0.04 mol/L的磷酸盐缓冲液(pH=7.6)稀释成1 000 SID50病毒悬液,即 1∶1 000 倍稀释。
1.1.3 试验动物。2月龄左右健康试验猪,口蹄疫O型液相阻断ELISA检测口蹄疫O型抗体效价小于1∶4,非结构蛋白3ABC抗体阴性。试验用猪购自甘肃省庄浪县某小型养猪场。
1.1.4 检测试剂。O型口蹄疫抗体液相阻断ELISA检测试剂盒(LPB-ELISA)、口蹄疫病毒非结构蛋白3ABC抗体检测ELISA试剂盒(FMDV NSP 3ABC-I-ELISA Kit),均由中国农业科学院兰州兽医研究所提供。口蹄疫病毒实时定量RT-PCR检测试剂盒由国家口蹄疫参考实验室提供。
1.2 试验方法
1.2.1 试验动物分组及给药。随机选取阴性健康猪20头,随机分为4组,分别为H组(高剂量组)、M组(中剂量组)、L组(低剂量组)和C组(健康对照组),每组5头。试验组H组、M组、L组及C组给药时间、剂量、途径等按照表1操作。
表1 试验动物分组、给药量及时间
1.2.2 病毒复制水平检测。在给药第3天以及攻毒后第1、第3、第5、第7天采集抗凝血,应用real-time RT-PCR方法测定口蹄疫病毒复制copy数。
1.2.3 口蹄疫病毒抗体水平检测。给药第3天及攻毒后第3、第10天,用口蹄疫O型液相阻断ELISA方法检测猪体内O型口蹄疫病毒抗体水平。
1.2.4 攻毒试验。给药3 d后,进行O型口蹄疫毒株(猪O型O/China/99株鼠毒)攻毒试验。攻毒浓度为1 000 SID50,剂量为3 ml/头,耳后肌肉注射。对照组和试验组均攻毒。攻毒后连续观察10 d。攻毒期间各组按照不同给药比例继续给药。
1.2.5 体温测定。给药和攻毒期间,每天测定、记录直肠体温。攻毒后,体温仅为参考值,不做统计分析。
2 结果与分析
2.1 测试样品安全性评价 攻毒试验前,连续给药3 d,试验猪均未见明显的临床副反应,精神状态、采食等情况基本正常。表2显示,第1天有3头猪体温高于39.5℃,第2天有1头猪体温高于39.5℃,第3天有7头猪体温高于39.5℃,可见试验猪体温基本在正常范围。
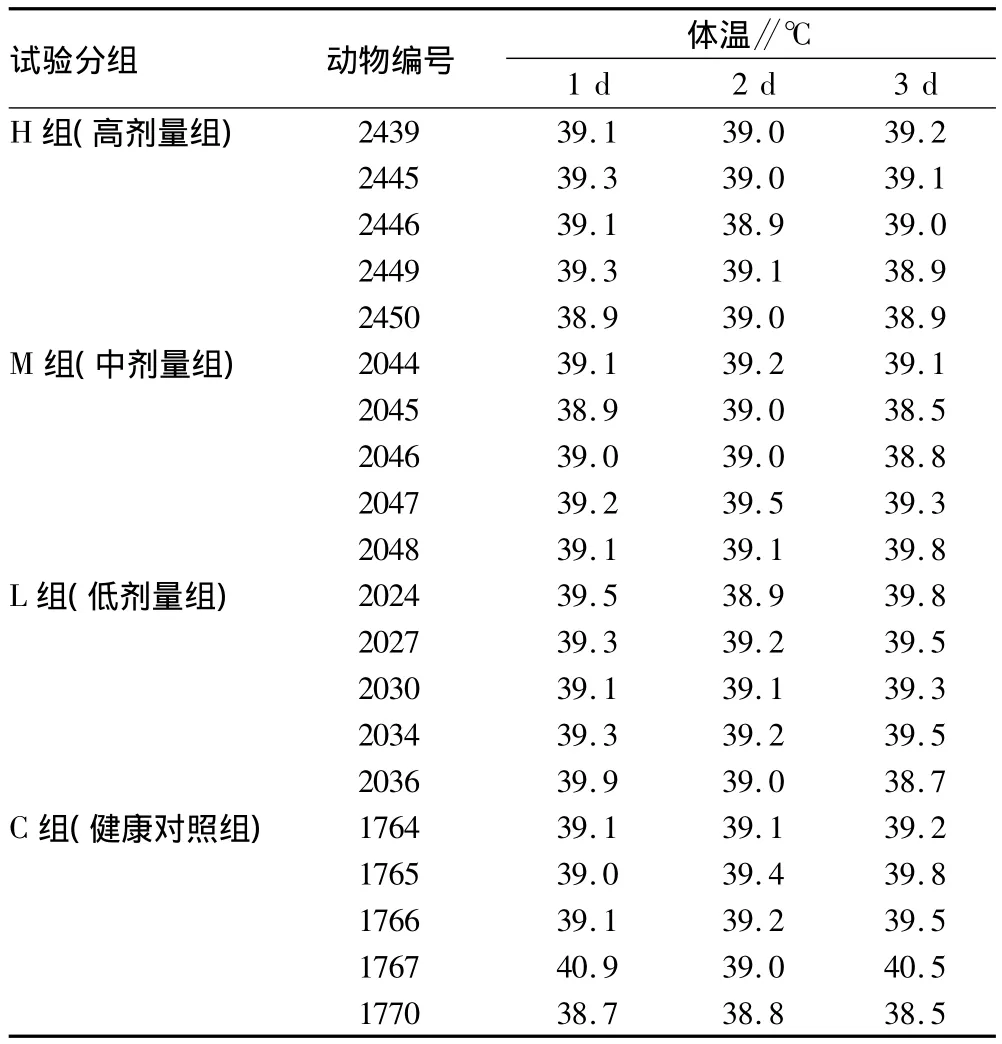
表2 试验猪攻毒前给药期间体温记录
2.2 攻毒试验结果 给药3 d后,进行O型口蹄疫攻毒试验,结果对照组全部发病(其中1只第3天发病,后表现为拉稀、体弱,于第6天死亡)。从H组、M组、L组攻毒结果(表3)可以看出,低剂量给药猪3/5保护,中剂量给药猪1/5保护,高剂量给药猪0/5保护;在低剂量给药条件下,攻毒保护效果优于中剂量和高剂量;攻毒后发病猪临床症状与对照组相似,试验组与对照组差异不明显。

表3 攻毒试验结果统计

续表3
2.3 病毒复制水平 荧光定量RT-PCR方法检测给药第3天采集的全血(本底样品),未检测到口蹄疫病毒copy数。试验对照成立。从攻毒后的第1天到第7天,陆续从试验猪全血中检测到口蹄疫病毒,M组复制水平最高,L组复制水平最低(表4)。

表4 不同试验组病毒copy数测定结果
2.4 口蹄疫病毒抗体水平检测 给药第3天及攻毒后第3、第10天,用口蹄疫O型液相阻断ELISA方法检测猪体内O型口蹄疫病毒抗体水平。结果(表5)显示,第3天仅有H组1头猪O型抗体≥1∶64,其他试验猪抗体水平均低于1∶64;第10天时,H组和M组试验猪口蹄疫抗体水平均≥1∶64;L组和C组各有1头猪抗体水平均低于1∶64。可见,给药组与对照组在攻毒后10 d,口蹄疫病毒抗体水平无差别。根据中草药红茶菌体内抗口蹄疫病毒试验结果,可以得出中低浓度的中草药红茶菌在体内对口蹄疫病毒具有一定的抑制作用。
3 讨论
一种理想的口蹄疫防控试剂应该具有在体外和体内均能杀灭或抑制口蹄疫病毒,且这种杀灭或抑制又是广谱性的;同时,这种制剂必须无毒副作用,可以经常性来使用;最好,这种制剂必须物美价廉,才能大量推广使用。如果使用这样的口蹄疫防控试剂,对动物养殖环境喷雾消毒,可以杀灭动物周围环境的病毒;如果对动物进行口服和鼻喷,让这样的制剂进入动物消化道和呼吸道,杀灭动物呼吸道和消化道内的口蹄疫病毒;口服进入体内后,这种制剂又能杀灭或抑制体内的口蹄疫病毒。因此,使用这样的制剂就可以构建一个立体的、多层次的口蹄疫防控体系,从而起到有效防控口蹄疫的发生。即使局部发生,这种制剂也可以达到快速使用来预防口蹄疫的目标。由于满足理想口蹄疫防控制剂的标准难度大,目前尚无这样的制剂出现,仅有一些具备某方面的口蹄疫防控制剂,如口蹄疫疫苗、口蹄疫消毒剂、RNA干扰剂等,所以利用上述制剂都难以构建一个完善的口蹄疫防控体系。
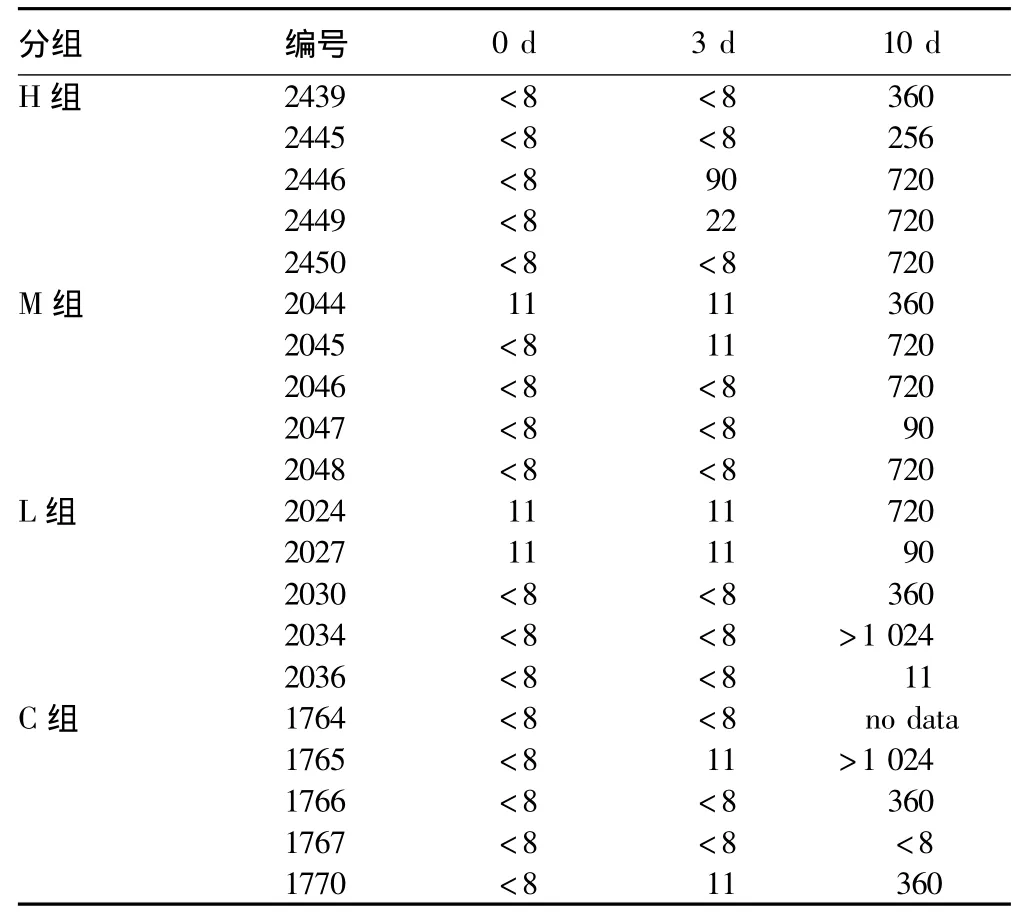
表5 不同试验组口蹄疫病毒O型抗体测定结果
红茶菌是一个以醋酸菌、酵母菌为主的复合共生菌群。醋酸菌是自然界产酸性最强的产酸菌之一,因此,醋酸菌和酵母菌所形成的复合共生菌群是产生最强的复合产酸菌群之一。相对于其他产酸的益生菌如单一的乳酸菌、酵母菌,红茶菌通过产生大量有机酸可以有效抑制口蹄疫病毒在体外以及动物消化道或呼吸道的繁殖。在红茶菌基础上研制的中草药红茶菌,含有大量广谱性抗病毒的中草药如甘草、菊花、茶叶等提取液成分,因此,动物口服中草药红茶菌后,在体内也可以有效抑制口蹄疫病毒在体内的繁殖。这种机制有可能是如其中的甘草提取液中的甘草多糖可以刺激细胞产生干扰素来提高动物机体的抗病毒特性[6-7]。由于中草药红茶菌是利用红茶菌发酵常见的中草药提取液而成,生产工艺简单,本身无毒副作用,因此,可以广泛用于对口蹄疫的防控。由于中草药红茶菌对口蹄疫病毒在体外和体内均有良好的抑制作用,因此,对动物养殖场地喷雾消毒、对偶蹄类动物口服(口喷)和鼻喷就可以形成有效预防口蹄疫的三道防线,从而能够有效预防口蹄疫。中草药红茶菌预防口蹄疫的机理如图1所示。该研究表明,使用一次中草药红茶菌,在1周之内,从猪的粪便中分离出大量醋酸菌,表明红茶菌中的醋酸菌和酵母复合共生菌群在猪的消化道中能存活长达1周或更长的时间。因此,每周对动物喷雾1次左右,就可以实现对口蹄疫的长效预防。其次,对动物喷雾中草药红茶菌,还可以预防其他细菌性和病毒性疾病,因此,喷雾中草药红茶菌还可以带有其他额外的预防效益。当前,我国的口蹄疫无疫区建设正逐渐与国际接轨,逐渐从口蹄疫疫苗注射防控下的无疫区转向非免疫的无疫区。但我国的动物养殖规模大小不一、气候和环境多样性大,口蹄疫疫情复杂,因此,如何实现口蹄疫疫苗注射防控下的无疫区平稳转变为非免疫的无疫区,困难和挑战很多。中草药红茶制剂作为一种无毒、高效、低成本的非免疫的口蹄疫防控制剂和防控技术将会在我国未来的口蹄疫无疫区建设中发挥重要作用。
图1 喷雾中草药红茶菌预防口蹄疫的作用路线
[1]袁文泽,苏永生,李春阵,等.1990-2001世界口蹄疫流行情况及其防治对策[J].中国动物检疫,2002,19(2):43-44.
[2]PATON D J,SUMPTION K J,CHARLESTON B.Options for control of foot-and-mouth disease:Knowledage,capability and polity[J].PHil Trans R Soc B,2009,364:2657-2667.
[3]CURRY S,ABRAMS C C,FRY E,et al.Viral RNA modulates the acid sensitivity of foot-and-mouth disease virus capsids[J].J Virol,1995,69:430-438.
[4]JOHNS H L,BERRYMAN S,MONAGHAN P,et al.A dominant-negative mutant of rab5 inhibits infection of cells by foot-and-mouth disease virus:implications for virus entry[J].J Virol,2009,83:6247-6256.
[5]吕爱军,尹建美,胡秀彩,等.红茶菌形态及菌液抑菌作用的研究[J].徐州师范大学学报,2004,22(1):73-75.
[6]王彦芳,秦林,王焱,等.中药抗病毒研究进展[J].中医中药,2008,14(22):3488-3490.
[7]苏俊喜,周颖,门文军,等.甘草有效成分应用的研究进展[J].畜牧与饲料科学,2010,31(8):111-113.

