乙醇预处理麦秆的酶解性能研究
陈红梅,赵雪冰,刘德华
(清华大学 化工系 应用化学研究所,北京 100084)
木质纤维素是一种产量丰富、来源广泛、廉价 的可再生资源。近些年来,由于化石资源短缺和温室气体排放量大幅增加,木质纤维素转化生产燃料和化学品受到世界各国的广泛关注[1]。但由于木质纤维素本身结构复杂,特别是半纤维素和木质素限制了纤维素的酶催化水解性能。因此,木质纤维素原料往往需要经过预处理以破坏其抗生物降解屏障从而提高纤维素酶对纤维素的可及性[2]。木质纤维素生物转化的预处理方法有多种,常用的包括稀酸预处理、蒸汽爆破(或超临界CO2爆破)、热水预处理、氨纤维素爆破、氨水循环渗透和石灰预处理等[3-4]。有机溶剂预处理是采用有机溶剂或其水溶液在添加或不添加催化剂的条件下对木质纤维素原料进行预处理的方法。在有机溶剂预处理过程中,由于木质素和半纤维素的脱除,原料孔隙率增加,从而提高了纤维素与纤维素酶的可接触面积[5]。有机溶剂预处理一方面可以有效提高纤维素的酶解性能,另一方面在预处理过程中可水解半纤维素、溶解木质素,因而是一种分级预处理,有利于实现原料的分级加工利用[1]。
乙醇预处理是目前研究较多的有机溶剂预处理方法[6-8]。乙醇具有低毒、挥发性大、易回收利用的特点。目前,将乙醇作为溶剂处理木质纤维素原料研究较多的是自催化乙醇处理法和酸催化乙醇处理法[9-12]。自催化乙醇处理法通常是指除乙醇外,不添加任何化学药品作催化剂,而依赖于预处理过程中释放的有机酸(主要是乙酸)来提供所需酸度的乙醇处理法,反应温度通常为180~210℃。酸催化乙醇处理法是向体系中添加外源有机酸或无机酸作为催化剂,从而促进脱木素作用和半纤维素水解,加入酸性催化剂可降低反应温度和压力[12]。
为分析和比较乙醇预处理后麦秆的纤维素酶解特性,笔者分别在最优条件下对麦秆进行H2SO4催化和自催化乙醇处理,比较这2种乙醇法处理后麦秆的主要化学组成、纤维素酶解性能和半同步糖化发酵生产乙醇特性,并进一步获得物料衡算数据。
1 材料与方法
1.1 主要原料和试剂
实验所用的小麦秸秆产自山东省,风干后待用。将其破碎成<2 cm的片段。采用美国国家可再生能源实验室的方法测定[13]其主要化学组成:葡聚糖33.1%,木聚糖22.8%,酸溶木素2.21%,酸不溶木素 22.1%。乙醇、H2SO4、CaCO3、醋酸钠、吐温等试剂均为市售分析纯。高效液相色谱(HPLC)用标准品,包括葡萄糖、木糖、纤维二糖、阿拉伯糖、糠醛、甲酸、乙酸、乙醇等购自Sigma-Aldrich上海分公司。纤维素酶为诺维信公司生产的Cellic® CTec2。
1.2 主要仪器和设备
预处理反应器为天舟海泰(北京)科技有限公司的TFCF5-5型5 L不锈钢高压反应釜。液相色谱仪为日本岛津公司的HPLC系统,色谱柱为Bio-Rad公司的Aminex HPX-87H(300 mm× 7.8mm)填充柱,检测器为岛津公司RID-10A差示折光检测器。流动相为5 mmol/L稀H2SO4,流速为0.8 mL/min,柱温为65℃。紫外分光光度计为上海天美科学仪器有限公司的UI-VIS 85系列紫外/可见分光光度计。
1.3 实验方法
1.3.1 自催化乙醇处理
自催化乙醇是在笔者所在实验室之前优化后的条件下进行的。150 g麦秆置于高压反应釜中,加入1 500 mL体积分数65%的乙醇水溶液,在300 r/min下进行预处理。预处理温度为220℃,保温20 min。反应结束后冷却到40℃以下,离心,收集液体,固体用相同浓度的乙醇溶液以10∶1(mL/g)液固比洗涤,再离心,收集液体,将固体进行减压蒸发,回收乙醇。所得固体保存在自封袋中,放入4℃冰箱保存待用。
1.3.2 酸催化乙醇处理
H2SO4催化的乙醇预处理过程与自催化过程类似,不同的是乙醇质量分数60%,且在预处理过程中添加30 mmol/L H2SO4作为催化剂,并在190℃下保温1 h[5]。其他过程与自催化乙醇预处理相同。
1.3.3 酶解实验
预处理后固体的酶解在50 mL三角瓶、pH 4.8的醋酸缓冲溶液、50℃和150 r/min条件下进行。固体含量为10%或15%(10%和15%分别指100 mL液体中所含绝干固体质量为10 g和15 g)。纤维素酶用量为20 FPU(按1 g固体计)。间歇取样,测定液相中纤维二糖、葡萄糖和木糖的浓度。预处理后的纤维素酶解性能以液相中单糖浓度以及酶解聚糖转化率来描述。
酶解葡聚糖转化率的定义为酶解过程中转化为葡萄糖和纤维二糖的聚糖百分率:

式中:ρg、ρc分别为葡萄糖、纤维二糖质量浓度,g/L;xg表示预处理后试样中葡聚糖含量;1.1是葡聚糖转化为葡萄糖的转化系数;ρl,s为初始固体质量浓度,g/L。
1.3.4 半同步糖化发酵实验
预处理后固体的半同步糖化发酵(hSSF)在50 mL三角瓶中进行。将预处理后的纤维素固体(固体含量为10%)置于发酵培养基中,121℃下灭菌20 min,再用浓度为1 mol/L的NaOH溶液将液相pH调至5.0~5.5,加入纤维素酶液(1 g固体纤维素酶用量为20 FPU),进行预水解24 h(水解条件为50℃、130 r/min),随后按10%的接种量接入酿酒酵母(Saccharomices cerevisiae CICC 31014)种子液,进行乙醇发酵。发酵温度为37℃,摇床转速为150 r/min。
2 结果与讨论
2.1 预处理后固体主要化学组成
H2SO4催化和自催化乙醇处理后的麦秆的主要化学组成如表1所示。
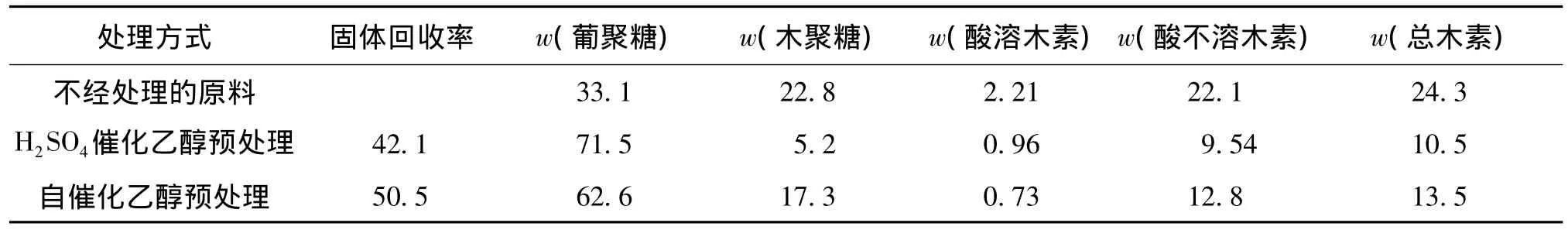
表1 H2SO4催化和自催化乙醇预处理固体主要化学组成比较Table 1 Main chemical compositions of wheat straw pretreated by sulfuric acid-catalyzed(SAC)and auto-catalyzed(AC)ethanol organosolv processes%
由表1可知:自催化乙醇处理的固体回收率为50.5%,而酸催化乙醇法处理的固体回收率相对较低,为42.1%。与自催化乙醇处理相比,酸催化处理的试样葡聚糖含量更高,而木聚糖和木素含量都更低,特别是木聚糖含量显著减少,木聚糖水解率超过90%。自催化乙醇预处理过程中木聚糖水解率仅为61.2%。这是因为H2SO4催化乙醇预处理过程中,添加外源无机酸促进了半纤维素水解。从木素含量来看,H2SO4催化的乙醇预处理后,总木素含量下降至10.5%,相应的木素脱除率为81.8%;自催化乙醇预处理后总木素含量为13.5%,相应的木素脱除率为71.9%。添加无机酸有利于木素的脱除,这是由于酸浓度较高的情况下更容易使半纤维素和木素之间以及木素分子内的连接键断裂,形成更多的木素碎片[10-11,14-15]。
2.2 纤维素的酶解性能
H2SO4催化和自催化乙醇预处理麦秆在10%和15%固体含量及添加不同浓度表面活性剂条件下的酶解时间曲线如图1和图2所示。由图1和图2可以看出,24 h之后葡聚糖酶解转化率无明显增加。H2SO4催化乙醇处理麦秆在2种固体含量下葡聚糖的最终转化率均为70%左右,而葡萄糖质量浓度分别为55和78 g/L。对自催化乙醇预处理的麦秆葡聚糖转化率最高可达80%,相应葡萄糖质量浓度分别为 50.2 和 79.2 g/L。
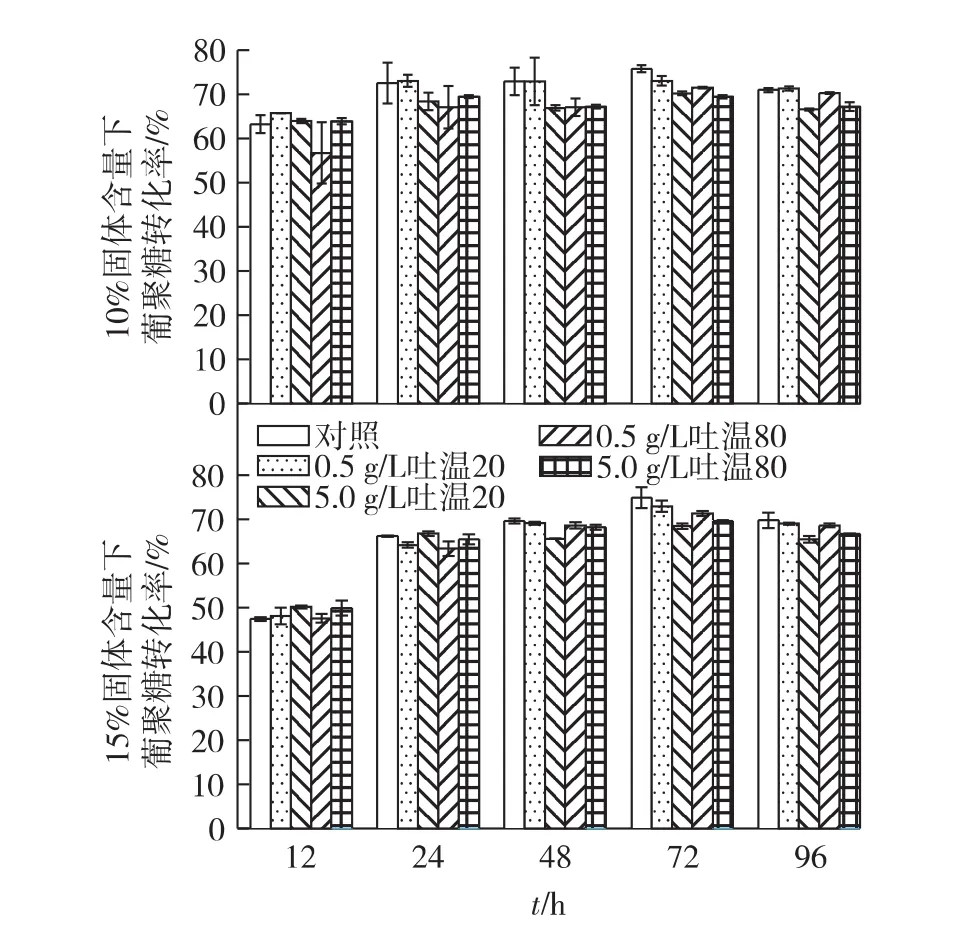
图1 H2SO4催化乙醇预处理麦秆的酶解Fig.1 Enzymatic hydrolysis of wheat straw pretreated by sulfuric acid-catalyzed(SAC)ethanol organosolv process
添加表面活性剂吐温20和吐温80对于2种预处理后固体的酶解性能具有不同的影响。对于H2SO4催化乙醇预处理的固体,添加表面活性剂不但未能促进纤维素的酶解,反而一定程度上抑制了酶解过程。特别是在10%固体含量的条件下,这种抑制作用更为明显。而对于自催化乙醇预处理,吐温20和吐温80对于纤维素的酶解具有明显的促进作用。例如,当添加0.5 g/L吐温20时,在10%和15%固体含量下,酶解24 h时,葡聚糖转化率可分别由未添加时的74.3%提高至81.0%及62.2%提高至75.0%。表面活性剂对于H2SO4催化和自催化乙醇预处理后的固体酶解性能具有不同影响作用的现象可能与H2SO4催化和自催化预处理后固体的木素含量及结构有关。已有的研究表明,表面活性剂提高预处理后纤维素酶解性能主要是通过降低木素对纤维素酶的无效吸附来实现的[12-13,16-17]。底物中木素表面有一定数量的位点,既可与表面活性剂结合,又可与纤维素酶结合。当表面活性剂用量达到一定程度时,这些位点全部吸附表面活性剂,从而阻止木素对纤维素酶的无效吸附,使纤维素酶水解速度和得率提高。进一步提高表面活性剂用量反而抑制酶活,降低酶解性能[14,18]。H2SO4催化乙醇处理过后的固体中木素含量较低,能与表面活性剂结合的位点数量有限,因此即使添加少量的表面活性剂(例如0.5 g/L),亦能使木素的结合位点饱和,且表现出对酶催化过程的抑制作用。特别是,当固体含量较低时,未与木素结合的表面活性剂更多,对酶活的抑制作用更强烈,导致葡聚糖转化率明显降低。同种表面活性剂中,高浓度的表面活性剂比低浓度条件下的葡聚糖转化率稍低也验证了这一点。而自催化预处理后固体的木素含量较高,因此,表面活性剂对酶解表现为促进作用。此外,表面活性剂的作用还可能与木素结构有关。H2SO4催化预处理过程中由于酸浓度较高,更容易发生木素的缩聚反应,因而会降低木素分子中酚羟基的含量。而文献报道,酚羟基是木素无效吸附纤维素酶的一个主要官能团[15,19]。因此,木素官能团结构的变化可能是表面活性剂对H2SO4催化和自催化预处理后固体具有不同影响的主要原因之一。具体的机制还需进一步研究。

图2 自催化乙醇处理麦秆的酶解Fig.2 Enzymatic hydrolysis of wheat straw pretreated by auto-catalyzed(AC)ethanol organosolv process
H2SO4催化和自催化乙醇预处理麦秆亦有文献报道。Wildschut等[5]在相同条件下对麦秆进行H2SO4催化乙醇预处理,酶解聚糖转化率可达89.4%,但其酶解实验的固体含量为3%,最终葡萄糖与纤维二糖总质量浓度为22.1 g/L。而本文中,预处理后酶解葡萄糖最高质量浓度可达80.3 g/L(15%固体含量,未添加表面活性剂)。对于自催化乙醇预处理,Huijgen等[14]在60%乙醇、200 ℃、保温60 min、固液比1∶10(g/mL)的条件下对麦秆进行预处理,所得纤维素固体的酶解葡聚糖(酶解固体含量为3%,其余条件和本文的相同)转化率仅为52%左右。而本文中,麦秆通过自催化乙醇预处理后,最高葡聚糖转化率高于80%(10%、15%固体含量)。可见,笔者所采用的自催化乙醇预处理可以有效提高麦秆纤维素的酶解性能。
2.3 半同步糖化发酵生产乙醇
H2SO4催化乙醇处理麦秆半同步糖化发酵(hSSF)过程中乙醇浓度和葡萄糖浓度的变化如图3所示。从图3中可以看出,表面活性剂的添加对最终乙醇浓度并无显著影响。在预水解过程中(前24 h),葡萄糖浓度迅速增加,接种培养8 h后葡萄糖很快被消耗,相应的乙醇浓度迅速增加。接种培养12 h后乙醇浓度达到最大,此后乙醇浓度开始下降。这种现象可能是因为葡萄糖的产生速率不及其消耗速率,酵母菌在饥饿状态下开始反耗产生的乙醇,也可能是由于随着发酵过程进行,乙醇逐步挥发造成的。从图3中可知,发酵过程中乙醇质量浓度最高达到25 g/L左右,相当于62.2%的理论得率。

图3 H2SO4催化乙醇预处理麦秆半同步糖化发酵过程中乙醇和葡萄糖质量浓度的变化Fig.3 Ethanol and glucose concentration changes during hSSF of wheat straw pretreated by sulfuric acidcatalyzed(SAC)ethanol organosolv process
自催化乙醇处理麦秆hSSF过程中乙醇浓度和葡萄糖浓度的变化如图4所示。从图4中可以看出,表面活性剂的添加对乙醇的产生有较好的促进作用,不仅提高了最终乙醇浓度,而且减小了酵母菌对乙醇的反耗。在接种培养8 h之内,表面活性剂对乙醇产生的作用不明显,因为预水解过程产生了大量葡萄糖,使得该时间段内葡萄糖浓度较高,足够供酵母消耗产生乙醇。接种培养8 h后,乙醇浓度增长速度缓慢,接种培养24 h后乙醇浓度达到最大。未添加表面活性剂的对照组乙醇质量浓度最高为 20.1 g/L(接种培养 24 h后),相当于57.2%的理论得率;而添加表面活性剂的实验组乙醇质量浓度最高可达22.4 g/L(添加5 g/L吐温80,培养24 h),相当于65.4%的理论得率,比对照组提高了11.4%。与H2SO4催化的预处理相比,自催化预处理可获得类似的乙醇浓度和得率。
2.4 物料衡算
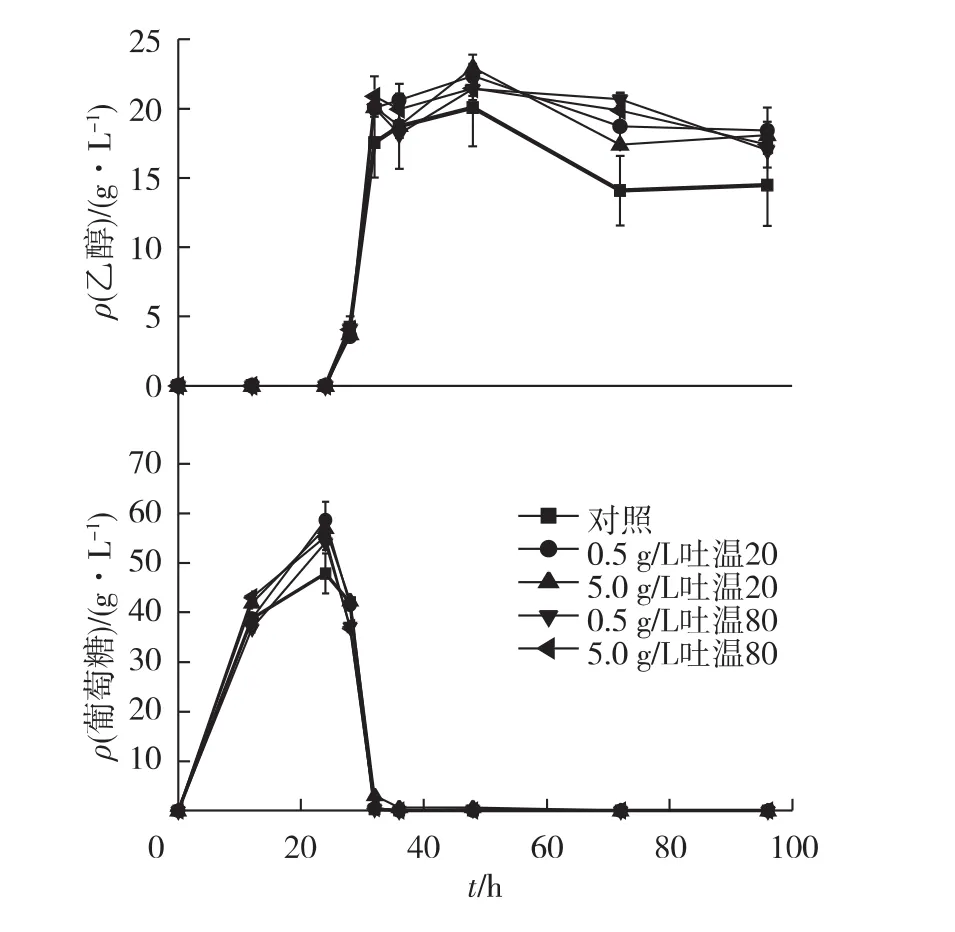
图4 自催化乙醇预处理麦秆半同步糖化发酵过程中乙醇和葡萄糖质量浓度的变化Fig.4 Ethanol and glucose concentration changes during hSSF of wheat straw pretreated by autocatalyzed(AC)ethanol organosolv process
进一步分析H2SO4催化和自催化乙醇处理麦秆的物料衡算,结果如图5、图6所示。从图5和图6可知:大部分葡聚糖以固体形式回收,并在后续酶解过程中转化为葡萄糖。H2SO4催化乙醇处理葡聚糖回收率为91.0%,自催化乙醇处理葡聚糖回收率为95.4%。H2SO4催化的预处理过程中,90.3%的木聚糖被水解,81.8%的木素被脱除;而自催化预处理过程中,木聚糖水解率为61.2%,木素脱除率为71.9%。从液相中的糖浓度来看,2种预处理过程中木糖浓度均很低,这可能是由于预处理在较为剧烈的条件下进行,木糖发生了显著降解。从图5和图6还可知:100 g麦秆原料通过酸催化乙醇预处理,最终能得到10.4 g乙醇,乙醇得率为理论得率的56%;而通过自催化乙醇预处理,最终能得到11.6 g乙醇,乙醇得率为理论得率的62.5%。由此可见,二者具有类似的乙醇得率。但H2SO4催化过程添加了外源无机酸,会一定程度上增加设备腐蚀性,且H2SO4需要中和处理。而自催化预处理需要更高的温度,因而要求设备具有更高的耐压性。因此,需要进一步结合后续产品分离以及设备投资等分析,来比较二者的经济性。
3 结论
通过比较H2SO4催化、自催化乙醇处理后麦秆固体的主要化学组成、酶解性能、半同步糖化发酵生产乙醇特性和物料衡算结果,可以得到以下结论:①乙醇预处理能够以固体形式回收大部分葡聚糖,H2SO4催化处理的葡聚糖回收率为91.0%左右,自催化乙醇处理的葡聚糖回收率为 95.4%。②H2SO4催化乙醇预处理可更多地水解半纤维素和脱除木素。③添加非离子表面活性剂吐温20和吐温80,对于H2SO4催化乙醇处理后麦秆的酶解和半同步糖化发酵生产乙醇无明显促进作用。而对于自催化乙醇处理后的麦秆的酶解和半同步糖化发酵具有显著的促进作用,最高酶解葡聚糖转化率可从72.7%提高到85.0%;最高乙醇浓度比未添加表面活性剂时提高了11.4%。④物料衡算结果表明,H2SO4催化的乙醇预处理和自催化乙醇预处理的麦秆半同步糖化发酵的乙醇得率分别为10.4和11.6 g(按100 g原料计)。
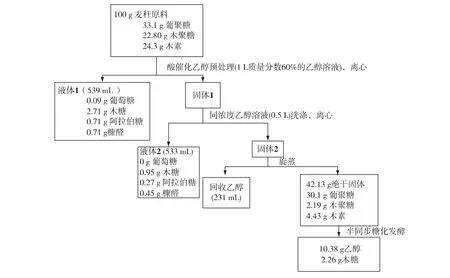
图5 H2SO4催化乙醇处理麦秆过程中的物料衡算Fig.5 Mass balance analysis of sulfuric acid-catalyzed(SAC)ethanol organosolv processe

图6 自催化乙醇预处理处理麦秆过程中的物料衡算Fig.6 Mass balance analysis of auto-catalyzed(AC)ethanol organosolv processe
[1] Zhao X,Cheng K,Liu D.Organosolv pretreatment of lignocellulosic biomass for enzymatic hydrolysis[J]. Appl Microbiol Biot,2009,82(5):815-827.
[2] Zhao X,Zhang L,Liu D.Biomass recalcitrance:part I.the chemical compositions and physicalstructures affectingthe enzymatic hydrolysis oflignocellulose[J].Biofuels Bioprod Bioref,2012,6(4):465-482.
[3] Wyman C E,Dale B E,Elander R T,et al.Coordinated development of leading biomass pretreatment technologies[J].Bioresour Technol,2005,96(18):1959-1966.
[4] Mosier N,Wyman C,Dale B,et al.Features of promising technologies for pretreatment of lignocellulosic biomass[J].Bioresour Technol,2005,96(6):673-686.
[5] Wildschut J,Smit A T,Reith J H,et al.Ethanol-based organosolv fractionation of wheat straw for the production of lignin and enzymatically digestible cellulose[J].Bioresour Technol,2013,135:58-66.
[6] AlviraP,Tomás-Pejó E,Ballesteros M,etal.Pretreatment technologies for an efficient bioethanol production process based on enzymatic hydrolysis:a review[J].Bioresour Technol,2010,101(13):4851-4861.
[7] Hendriks A T W M,Zeeman G.Pretreatments to enhance the digestibility of lignocellulosic biomass[J].Bioresour Technol,2009,100(1):10-18.
[8] Huijgen W J J,Smit A T,Reith J H,et al.Catalytic organosolv fractionation of willow wood and wheat straw as pretreatment for enzymatic cellulose hydrolysis[J].J Chem Technol Biot,2011,86(11):1428-1438.
[9] Xu F,Sun J X,Sun R,et al.Comparative study of organosolv lignins from wheat straw[J].Ind Crops Prod,2006,23(2):180-193.
[10] Jiménez L,Pérez J,García J C,et al.Influence of ethanol pulping of wheat straw on the resulting paper sheets[J].Process Biochem,2002.37(6):665-672.
[11] 张美云,蒲文娟,徐永健.非木材纤维自催化乙醇制浆的研究进展[J].中华纸业,2007,28(6):77-79.
[12] 蒲文娟,张美云,徐永建.非木材纤维原料乙醇制浆的发展前景与展望[J].中国造纸,2007,26(8):52-56.
[13] Sluiter A,Hames B,Ruiz R,et al.Determination of structural carbohydrates and lignin in biomass[EB/OL].[2013-10-28].http:∥www.nrel.gov/docs/gen/fy13/42618.pdf.
[14] Huijgen W J J,Smit A T,de Wild P J,et al.Fractionation of wheat straw by prehydrolysis,organosolv delignification and enzymatic hydrolysis for production of sugars and lignin[J].Bioresour Technol,2012,114(2):389-398.
[15] 陆强,赵雪冰,郑宗明.液体生物燃料技术与工程[M].上海:上海科学技术出版社,2013.
[16] Alkasrawi M,Eriksson T,Borjesson J,et al.The effect of tween-20 on simultaneous saccharification and fermentation of softwood to ethanol[J].Enzyme Microb Tech,2003,33(1):71-78.
[17] Kristensen J B,Börjesson J,Bruun M H,et al.Use of surface active additives in enzymatic hydrolysis of wheat straw lignocellulose[J].Enzyme Microb Tech,2007,40(4):888-895.
[18] 罗鹏,刘忠.表面活性剂对麦草同步糖化发酵转化乙醇的影响[J].过程工程学报,2009,9(2):355-359.
[19] Pan X J.Role of functional groups in lignin inhibition of enzymatic hydrolysis of cellulose to glucose[J].J Biobased Mater Bio,2008,2(1):25-32.

