高抗逆高丁比拜氏梭菌的选育及其性能考察
贺爱永,尹春燕,孔祥平,陈佳楠,姜 岷,吴 昊
(南京工业大学 生物与制药工程学院 材料化学工程国家重点实验室,南京 210009)
丁醇是重要的C4平台化合物之一,被广泛应用于各种精细化学品的制造中,同时是一种极具潜力的新型燃料[1-2]。在能源和粮食危机日益严峻的今天,面对国际能源安全和环境恶化的多重压力,利用生物质等可再生资源制备生物丁醇受到了广泛的关注[3-5]。
生物丁醇发酵通常是利用产丁醇梭菌在严格厌氧条件下进行的,其主要产物是丙酮、丁醇和乙醇,因此又被称为丙酮丁醇发酵,简称AB或ABE。传统发酵中,丁醇、丙酮和乙醇的体积比约为6∶3∶1,同时还伴随着副产物乙酸和丁酸,释放 H2和CO2,导致底物的转化利用率仅在 30% 左右[1,6]。因此,提高ABE中丁醇的含量,并有效改善底物的转化率成为近年来丁醇发酵的又一大热点。
目前,在农业、工业和林业等产业中存在大量的木质纤维原料的废弃物,如秸秆、甘蔗渣和木屑等[7-8],而这些木质纤维原料可通过预处理、糖化处理分解成葡萄糖、木糖等多种糖分,用以发酵[9]。然而制糖过程中都会产生一些有机酸类、糠醛类和酚类等抑制物,严重影响微生物的生长与发酵[7]。目前为止,还没有直接利用未脱毒的木质纤维原料酸解糖液高效制备丁醇的菌株报道。C.beijerinckii BA101是已报道的利用葡萄糖为原料产溶剂最高的菌株,但是该菌株不能直接利用未脱毒的玉米纤维水解糖液发酵产丁醇[4]。笔者所在课题组利用N+离子束诱变筛选得到的C.beijerinckii IB4,能够直接利用未脱毒的玉米芯水解液,其总溶剂产量仅达9.5 g/L,其中丁醇 6.8 g/L[1]。基于此,笔者通过清华大学研发的常压室温等离子体诱变(ARTP)育种机对拜氏梭菌进行诱变,再经高通量筛选平板复筛,以期选育出高抗逆、高丁比的丁醇生产菌株,并对其性能进行考察,为进一步选育极具工业化潜力的产丁醇梭菌奠定基础。
1 材料与方法
1.1 菌株
Clostridium beijerinckii IB4[1],南京工业大学材料化学工程国家重点实验室选育保藏。
1.2 培养基和酸解糖液的制备
1)种子培养基(g/L) 酵母粉3,蛋白胨5,可溶性淀粉10,乙酸铵2,NaCl 2,MgSO43,KH2PO41,K2HPO41,FeSO4·7H2O 0.1;pH 6.0。
2)固体培养基 在种子培养基础上再加琼脂20 g/L。
3)平板筛选培养基 在固体种子培养基中添加刃天青0.02 g/L。
4)发酵培养基P2 C源(葡萄糖、木糖、蔗糖、混合糖(酸解糖液的模拟体系)和玉米芯酸解糖液,分消),K2HPO40.5 g/L,KH2PO40.5 g/L,CH3COONH42.2 g/L,MgSO4·7H2O 0.2 g/L,MnSO4·H2O 0.01 g/L,NaCl 0.01 g/L,FeSO4·7H2O 0.01 g/L,玉米浆 1 g/L。
以上培养基在121℃灭菌15 min后备用。
4)玉米芯酸解糖液的制备[10]将粉碎后过0.42 mm筛的玉米芯纤维在稀H2SO4水解的预处理条件下(质量分数为2%的稀H2SO4,反应温度125℃,预处理时间120 min,200 g/L的玉米纤维)得到的糖液,经过Ca(OH)2中和pH至6.0,总还原糖约为55 g/L。其经过121℃、15 min灭菌后的主要成分:总还原糖(55.2±1.6)g/L、木糖(44.6±0.9)g/L、葡萄糖(4.7±0.4)g/L、阿拉伯糖(3.32±0.3)g/L、可溶性总酚(TPC)(2.77±0.48)g/L、5-羟甲基糠醛(5-HMF)(0.38±0.04)g/L和糠醛(furfural)(0.66±0.11)g/L。
1.3 培养条件
1)活化培养条件 将1.5 mL种子甘油管,接种于50 mL血清瓶的种子培养基中,装液30 mL,35℃厌氧培养12 h。
2)种子培养条件 将活化种子液按5%的比例转接到100和500 mL血清瓶的种子培养基中,装液分别为50 mL和300 mL,35℃厌氧培养12 h。
3)厌氧瓶发酵条件 将培养12 h后的种子液按10%的比例接种到100 mL血清瓶的发酵培养基中,装液量50 mL,35℃厌氧培养72 h。
4)发酵罐发酵条件 将培养12 h后的种子液按10%的比例接种5 L的KF-5L发酵罐(KoBio Tech.Co.Ltd)中,发酵培养基3 L,搅拌桨转速100 r/min,接种后通N210 min,35℃厌氧培养至葡萄糖消耗完,定时取样测定菌体密度(OD600)以及冷冻保存,发酵结束后,测定试样中的乙酸、丁酸和总溶剂浓度。
1.4 选育方法
1)ARTP诱变 以He作为放电气体,气体流量QHe为10 L/min,射频功率为100 W,等离子体发射源与菌膜之间的距离为2 mm,选用的时间范围为10~240 s,然后将诱变后的菌液稀释涂布至平板,计算其存活率。
2)高通量初筛 将洗脱后的菌液稀释成不同浓度涂布于含刃天青的培养基平板上,35℃厌氧培养12 h。从选择性平板中挑取变色圈较大,生长较快的菌株,在固体种子培养基平板上划线纯化。
3)摇瓶复筛 将上述挑选的菌株接种于种子培养基中,35℃厌氧培养12 h后,以10%的接种量接入含有总还原糖30 g/L玉米芯酸解糖液的P2发酵培养基中,通过摇瓶发酵实验进行复筛,根据实验结果筛选丁醇产量较高的突变株。对于发酵性能好的菌株进行7次传代实验验证突变菌株的遗传稳定性。
1.5 分析方法
1)菌体密度 利用752S紫外分光光度计(上海棱光技术有限公司),于600 nm处测定吸光值(OD600)。细胞干质量(DCW)=0.26×菌体密度[1]。
2)糖浓度的测定 葡萄糖利用SBA 240C型生物传感分析仪(山东省科学院生物研究所)测定。总还原糖浓度采用3,5-二硝基水杨酸(DNS)比色法[11]测定。其他糖采用高效液相色谱法(HPLC)[12]测定。具体条件为Bio-Rad公司Aminex HPX-87H型离子排斥色谱柱(7.8 mm×300 mm)、检测器为Shosex RI-101型示差折光检测器、流动相5 mmol/L H2SO4溶液、进样体积 20 μL、流动相流速0.6 mL/min、柱温55℃。
3)总酚(TPC)的测定 具体方法参照文献[13]。
4)产物(乙酸、丁酸及溶剂)检测 采用FULI 9710气相色谱仪(浙江福立分析仪器有限公司),氢火焰离子化(FID)检测器,色谱柱为石英毛细管柱(30 m ×0.32 mm ×1 μm,SE-30,交联,最高使用温度290℃)。柱箱温度90℃,检测器温度180℃,进样器180℃,载气为N2,流速30 mL/min,以异丁醇为内标物进行定量。
5)计算方法

2 结果与讨论
2.1 ARTP诱变条件的确定
ARTP诱变是通过破坏细胞结构导致基因断裂,而通过细菌自身DNA修复发生基因突变,因此找到最合适的诱变条件才能够实现快速高效的诱变。而诱变时间的选择通常是根据诱变存活率曲线(或死亡率曲线)来确定的。根据前期的研究报道,当存活率为10%左右时,具有较强的诱变效应,通常以该时间作为最佳诱变时间[14-15]。
图1为拜氏梭菌存活率曲线,诱变30 s时细胞存活率为42%;处理180 s,细胞存活率降至10%;处理240 s,基本无细胞存活。因此选用180 s作为最佳诱变时间。
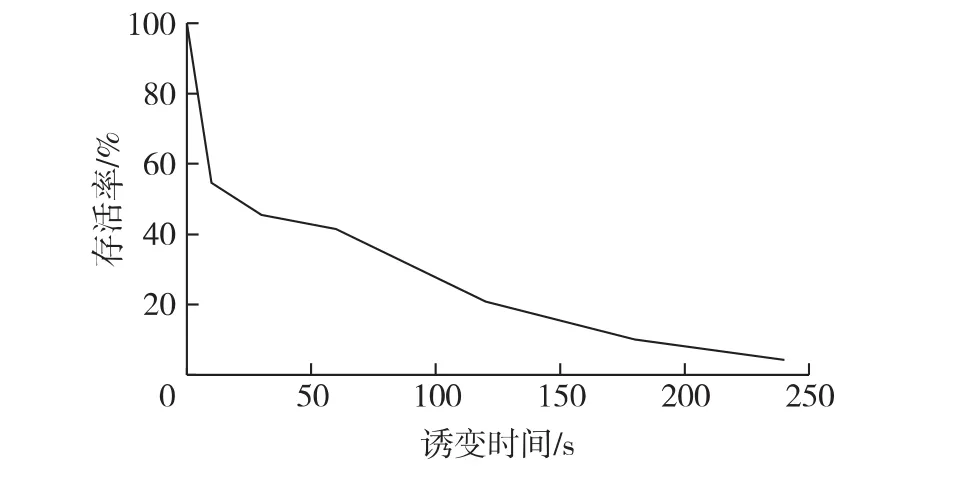
图1 Clostridium beijerinckii ARTP诱变存活率曲线Fig.1 Survival rate curve of plasma irradiated Clostridium beijerinckii cells
2.2 高通量筛选高抗逆高丁比突变株
C.beijerinckii经ARTP诱变后,经过刃天青平板涂布可快速、高效、便捷的筛选出透明圈大即还原力较强的突变菌株。最终,挑选出50株透明圈明显大于出发菌株的突变菌。进一步接种于含有总还原糖30 g/L玉米芯酸解糖液的P2发酵培养基中,通过摇瓶发酵实验复筛。根据发酵结果选出5株对玉米芯酸解糖液中抑制物耐受能力强,丁醇比高的突变菌株,结果见图2。由图2可知:IT111发酵发酵性能最好,总溶剂产量达到10.5 g/L,丁醇8.0 g/L,丁醇比高达76%,同时经过6代传代实验证明C.beijerinckii IT111发酵性能较为稳定,甘油管-70℃保藏用以进一步研究。
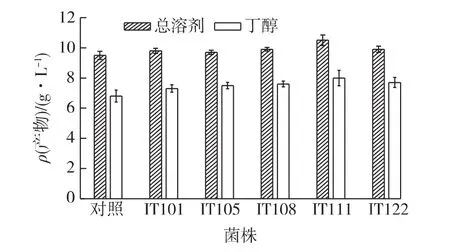
图2 突变株与出发菌株总溶剂和丁醇产量的比较Fig.2 Comparison of the mutants and the original strain on the yield of solvents and butanol
2.3 C.beijerinckii突变菌株利用不同C源的发酵结果
C.beijerinckii 天然具有利用多种不同的单糖及多糖类物质的能力[3,5]。在以总糖为30 g/L的葡萄糖、木糖、蔗糖、混合糖及玉米芯酸解糖液为C源,发酵培养基中35℃摇瓶培养72 h,考察出发菌株及C.beijerinckii IT111对不同C源的代谢情况,结果如表1所示。由表1可知:30 g/L葡萄糖为C源时,C.beijerinckii IT111可以产生最高的总溶剂(13.6 g/L),其中丁醇10.4 g/L,比例达到76%,分别较出发菌株提高了11.4%、16.9%和5.5%。其他C源与葡萄糖相比,利用率及转化率都有所降低。而以蔗糖为C源时,C.beijerinckii IT111代谢产物丁醇比更是高达85%。值得一提的是,IT111利用混合糖和玉米芯酸解糖液的代谢能力相当,说明该突变菌株具有较强的抑制物抗逆性能。

表1 出发菌株和突变株利用不同C源的发酵结果Table 1 Fermentation results using different carbon sources as substrate by wild type and mutant
2.4 C.beijerinckii突变株对抑制物抗逆性能的考察
玉米芯等木质纤维原料稀酸处理过程中产生多种抑制物,主要包含有机酸类、糠醛类和酚类[7-9]。C.beijerinckii IB4 是目前报道可直接利用未脱毒玉米芯酸解糖液发酵制备丁醇的菌株[1],该菌株对于木质纤维素酸解糖液中抑制物成分具有较高的抗逆能力。
考察以1 g/L糠醛、5-HMF、甲酸钠、乙酸钠、NaCl和Na2SO4及0.5 g/L6种不同的模式酚类物质对出发菌株IB4和C.beijerinckii IT111生长及代谢的影响,结果见图3。由图3可知:酸类及糠醛类对C.beijerinckii生长抑制影响较小,而酚类物质尤其是香草醛的抑制作用较明显。当香草醛的质量浓度为0.5 g/L时,出发菌株IB4和突变株IT111的细胞干质量浓度分别为0.7 g/L和1.1 g/L,分别比对照组降低了68%和52%。由图3也可知:突变株的丁醇产量均高于出发菌株,当糠醛和5-HMF的质量浓度为1 g/L时,C.beijerinckii IT111丁醇产量分别为9.0和9.1 g/L,比对照组的10.4 g/L略有降低,其丁醇抑制率分别为13%和12.5%。此外,当加入4种盐类(乙酸钠、甲酸钠、NaCl和 Na2SO4)时,C.beijerinckii IT111的丁醇产量均大于9.9 g/L,丁醇抑制率均小于5%。6种模式酚类对C.beijerinckii IT111发酵的影响差异较大,其中香草醛和丁香醛会使发酵延滞期延长,从而使得发酵时间延长。尽管阿魏酸和香豆酸结构相似,但香豆酸对发酵的抑制远高于阿魏酸。6种酚类化合物中对C.beijerinckii IT111的丁醇产量影响最高是丁香醛(9.6 g/L丁醇),丁醇产量最低的香草醛为4.5 g/L。
总体来说,糠醛和酸类对C.beijerinckii发酵影响较小,酚类物质对C.beijerinckii抑制作用较强,其中以香草醛为最。
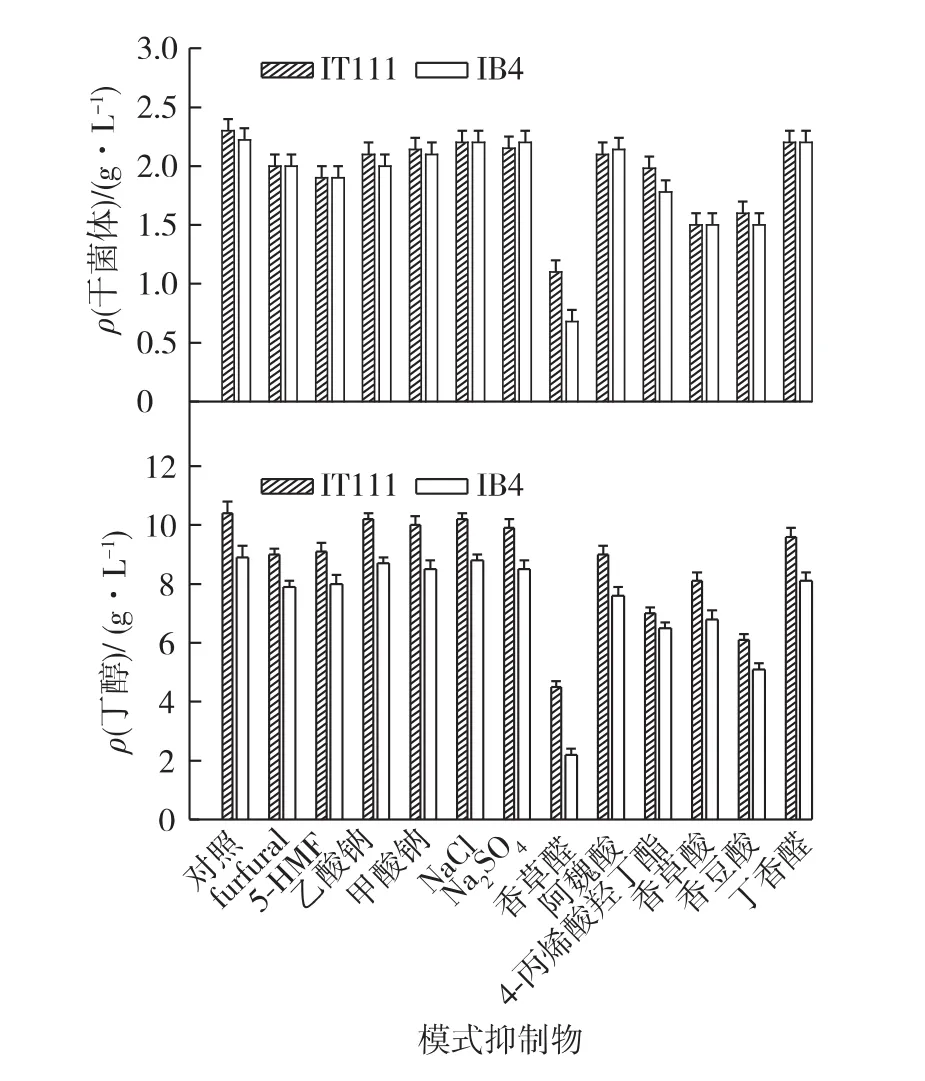
图3 不同抑制物对出发菌株和突变株C.beijerinckii IT111的生长和代谢的影响Fig.3 Effects of inhibitors on cell growth and butanol production by the original strain and C.beijerinckii IT111
3 结论
1)通过ARTP诱变及高通量筛选选育到一株生产性能优良的产丁醇拜氏梭菌IT111。
2)C.beijerinckiiIT111利用多种C源时均展现其高丁醇比的特性,以玉米芯酸解糖液为C源时,溶剂产量达到10.5 g/L,丁醇8.0 g/L,丁醇比高达76%。
3)糠醛和酸类对C.beijerinckii发酵影响较小,酚类物质对C.beijerinckii抑制作用较强,其中以香草醛为最。
[1] Guo T,Tang Y,Xi Y L,et al.Clostridium beijerinckii mutant with high inhibitor tolerance obtained by low-energy ion implantation[J].J Ind Microbiol Biotechnol,2012,39:401-407.
[2] Lee S Y,Park J H,Jang S H,et al.Fermentative butanol production by Clostridia[J].Biotechnol Bioeng,2008,101(2):209-228.
[3] Dürre P.New insights and novel developments in clostridial acetone/butanol/isopropanolfermentation[J].ApplMicrobiol Biotechnol,1998,49(6):639-648.
[4] Qureshi N,Ezeji T C,Ebener J,et al.Butanol production by Clostridium beijerinckiiBA101:I.use ofacid and enzyme hydrolysed corn fiber[J].Bioresour Technol,2008,99:5915-5922.
[5] Ezeji T C,Qureshi N,Blaschek H P,et al.Bioproduction of butanol from biomass:from genes to bioreactors[J].Curr Opin Biotechnol,2007,18(3):220-227.
[6] Qureshi N,Blaschek H P.Recent advances in ABE fermentation:hyper-butanol producing Clostridium beijerinckii BA101[J].J Ind Microbiol Biotechnol,2001,27:287-291.
[7] Cho D H,Lee Y J,Um Y,et al.Detoxification of model phenolic compounds in lignocellulosic hydrolysates with peroxidase for butanolproduction from Clostridium beijerinckii[J]. Appl Microbiol Biotechnol,2009,83:1035-1043.
[8] Ezeji T C,Blaschek H P.Fermentation of dried distillers'grains and solubles(DDGS)hydrolysates to solvent and value-added products by solventogenic Clostridia[J].Bioresour Technol,2008,99:5232-5242.
[9] Ezeji T C,Qureshi N,Blaschek H P.Butanol production from agricultural residues:impact of degradation products on Clostridum beijerickii growth and butanol fermention[J].Biotechnol Bioeng,2007,97(6):1460-1469.
[10] 姚嘉旻,姜岷,吴昊,等.稀酸水解玉米芯制备丁二酸[J].生物加工过程,2010,8(3):66-72.
[11] Ning Z X.Food analysis manual[M].Beijing:China Light Industry Press,1998.
[12] 杨卓娜,李建,黄秀梅,等.利用甘蔗糖蜜厌氧发酵产丁二酸的研究[J].中国酿造,2010(5):35-38.
[13] 杜腾飞,郭亭,贺爱永,等.甘蔗渣和糖蜜混合发酵制备燃料丁醇[J].生物加工过程,2012,10(4):12-15.
[14] Lu Y,Wang L Y,Ma K,et al.Characteristics of hydrogen production of an Enterobacter aerogenes mutant generated by a new atmospheric and room temperature plasma(ARTP)[J].Biochem Eng J,2001,55:17-22.
[15] Hua X F,Wang J,Wu Z J,et al.A salt tolerant Enterobacter cloacae mutant for bioaugmentation of petroleum-and saltcontaminated soil[J].Biochem Eng J,2010,49:201-206.

