金纳米分光光度法测定尿中痕量鸟苷
刘慧,徐薇,王永生
(南华大学公共卫生学院,湖南衡阳 421001)
鸟苷是嘌呤核苷类物质的一种,在药品和食品行业中是一种非常重要的中间体,并且它在制造无环鸟苷、三氮唑核苷、三磷酸鸟苷钠等药物当中充当主要原料。同时,鸟苷还在当今一些癌症的确诊中也突显出了其重要意义[1-2]。目前,检测鸟苷的主要手段有高效液相色谱法[3]、分子印迹固相微萃取[4]、毛细管电泳法[5]、薄层扫描法[6]等。虽然这些方法都有其优点,但普遍存在操作费时和设备昂贵等缺点。本研究基于鸟苷与金纳米间的相互作用可改变吸光度的原理,建立了检测鸟苷的金纳米分光光度的新方法。该方法不仅操作简单,而且还具备快速、廉价等优点。
1 实验部分
1.1 试剂与仪器
鸟苷、氯金酸、柠檬酸三钠、氯化钠、Britton-Robinson(BR)缓冲溶液等试剂均为分析纯;实验用水为双蒸灭菌水。
岛津UV2550紫外-可见分光光度计;TG16-WS离心机;AB204-S电子分析天平;PB-20酸度计。
1.2 金纳米粒子制备
根据文献[7-8],金纳米粒子可用柠檬酸还原法制得,再用0.22 μm的滤膜过滤。紫外-可见吸收光谱下520 nm 处消光系数为2.7 ×108(mol·cm-1),浓度约为8.1 nmol/L,粒径大小约(15±2)nm。
1.3 实验方法
在2 mL EP管中,依次加入pH 3.6 BR缓冲液100 μL,金纳米溶液 40 μL,放置 10 min,待反应完全后,加入鸟苷及氯化钠70 μL,并用双蒸灭菌水加至500 μL,放置5 min。在UV-2550紫外可见分光光度计上200~700 nm进行扫描,得到紫外吸收光谱。取λ630和λ530处的吸光度比值为检测信号,用ΔA630/A530与不同浓度鸟苷建立标准曲线进行定量分析。
2 结果与讨论
2.1 光谱特征
图1b为制得金纳米粒子(AuNPs)溶液的吸收光谱,其溶液为酒红色,最大吸收峰在530 nm附近加入鸟苷后,溶液颜色由酒红色变为蓝紫色,530 nm吸收强度减小,而在630 nm处出现一个新的吸收峰(见图1c)。将鸟苷加入AuNPs溶液后,引起了AuNPs的聚集,从而在630 nm出现了一个新的吸收峰。
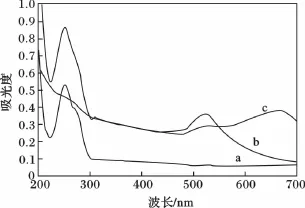
图1 鸟苷检测体系的吸收光谱图Fig.1 Absorption spectra of guanosine system
图2为鸟苷-AuNPs体系紫外-可见图谱。
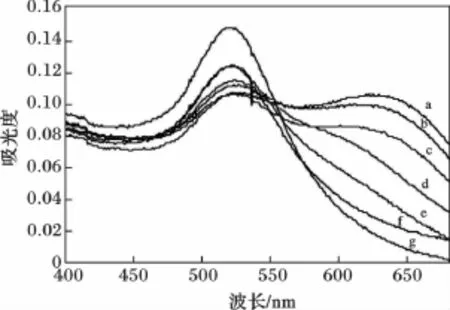
图2 AuNPs中加入不同浓度鸟苷的吸收光谱图Fig.2 Absorption spectra of AuNPs with different concentration of guanosinea.金纳米 +鸟苷1.41 ×10-6mol/L;b.金纳米 +鸟苷1.13 ×10-6mol/L;c.金纳米 +鸟苷8.47 ×10-7mol/L;d.金纳米 +鸟苷5.64 ×10-7mol/L;e.金纳米 + 鸟苷2.82 ×10-7mol/L;f.金纳米 +鸟苷1.76 ×10-7mol/L;g.金纳米
由图2可知,在pH 3.6 BR缓冲液中,随着加入鸟苷的体积增加,不同浓度鸟苷体系ΔA630/A530比值也不断增加且在一定范围内与吸收强度成线性关系。金纳米粒子由带负电荷的柠檬酸根保护,使得金纳米粒子在溶液中均匀分散。加入鸟苷后,金纳米粒子间的静电斥力减弱,使得金纳米粒子聚集,粒径增大,导致溶液颜色发生变化,同时体系的吸收光谱也发生变化。
2.2 实验条件的优化
2.2.1 体系酸度及用量的优化 由图3可知,在BR缓冲液中,随着pH增大,ΔA630/A530也相应增大,当pH在3.0~4.0时ΔA630/A530先缓慢增加后又会降低,当pH 达到3.6时,ΔA630/A530也达到最大,故本研究选定pH为3.6的BR缓冲溶液控制体系的酸度。另外,用量为100 μL时,ΔA630/A530最大。因此,本实验中我们选定BR缓冲液用量为100 μL。
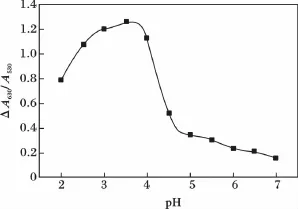
图3 pH值对体系的影响Fig.3 The effect of pH value on the system
2.2.2 AuNPs用量的优化 实验证实,随着AuNPs用量的增加,体系的吸光度也会随之发生一系列变化。当加入40 μL的金纳米时,ΔA630/A530最大。因此,本研究选定金纳米的加入量为40 μL。
2.2.3 反应时间的优化 将鸟苷加入金纳米溶液后,每间隔2 min用紫外分光光度计扫描一次。当两者反应10 min时,溶液颜色不再改变,再加入一定量的 NaCl溶液,并静置6 min,ΔA630/A530比值以及金纳米粒子颜色变化趋于稳定。因此,选择金纳米与鸟苷的反应时间为10 min,加入氯化钠静置时间为6 min。
2.2.4 试剂加入顺序的优化 在优化的实验条件下,做试剂加入顺序对反应体系影响的实验。结果表明,以BR→AuNPs→鸟苷→NaCl的加入顺序所得实验结果最好,且稳定时间长,故本实验选用BR→AuNPs→鸟苷→NaCl加入顺序。
2.3 干扰实验
在优化的实验条件下,鸟苷浓度为2.58×10-6mol/L,实验了可能共存的多种离子和物质对体系的影响。结果表明,当相对标准偏差≤±5%时,50 倍的 Al3+、Ca2+、Na+、Mg2+、Fe3+、Cu2+、F-、Cl-、Br-、HC、N、HS、S、腺苷、葡萄糖、EDTA,10倍的脱氧鸟苷等对本体系没有影响。说明这种方法有良好的选择性,取样后只需通过离心去除大分子物质便能够进行实时检测分析。
2.4 标准曲线、检出限及精密度
在优化实验条件下,通过加入不同体积的鸟苷标准溶液,绘制校正工作曲线。当鸟苷浓度在1.75×10-8~6.27 ×10-6mol/L 时,与体系 ΔA630/A530有较好的线性关系,线性方程为ΔA630/A530=1.33c×10-6mol/L+0.017 5,相关系数 r=0.997。根据11次空白样品的平行测定,按公式LOD=3Sb/k(Sb和k分别为空白管的标准差和直线回归方程的斜率)计算可得本研究的检出限为5.26×10-9mol/L。在最佳条件下,平行配制11管浓度分别为1.372×10-7,2.744 ×10-7,1.098 ×10-6mol/L 的鸟苷标准溶液进行精密度实验,相对标准偏差(RSD)分别为3.75%,2.98%和 1.42%。
2.5 样品分析
采集衡阳市南华大学第二附属医院尿样3份和南华大学健康学生尿样1份,样品通过离心机(2 000 r/min)离心10 min,取上清液测定样品中的鸟苷含量和加标回收率,结果见表1。
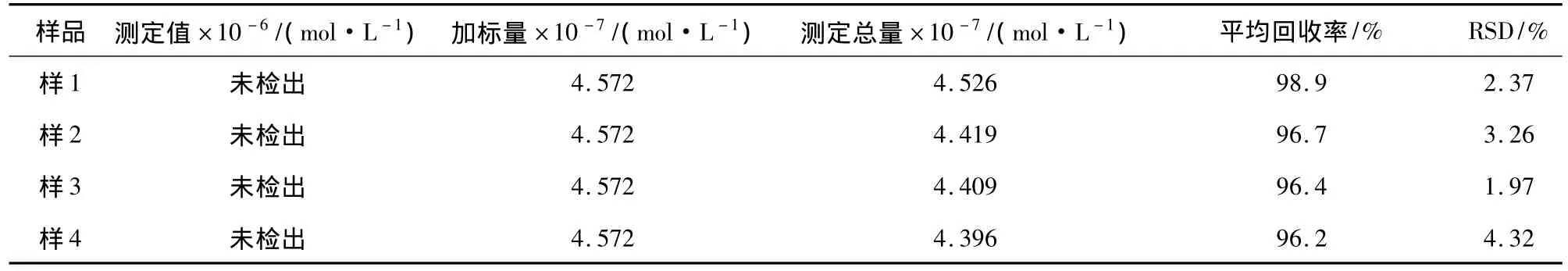
表1 尿样分析结果(n=6)Table 1 The determination results of guanosine in human urine samples
3 结论
在本实验条件下,鸟苷与AuNPs结合,屏蔽了金纳米粒子间的静电斥力,使金纳米聚集,导致体系的颜色及吸光度值发生变化,且在一定的浓度范围,体系吸光度比值与鸟苷的浓度具有良好的线性关系,据此建立了金纳米分光光度法测定尿样中痕量鸟苷的新方法。该新方法具有简单、快速、廉价、选择性好的优点。
[1]郑育杰,陈英杰,逢涛.肠癌患者尿中排放鸟苷的高效液相色谱法研究[J].色谱,2002,20(2):43-46.
[2]陈英杰,郑育芳,王凝芳.尿中核苷检测在胃癌诊断中的意义[J].癌症,2003,3(5):537-540.
[3]赵杨,靳凤云,伍庆,等.高效液相色谱法测定贵州不同产地半夏药材中鸟苷和腺苷的含量[J].时珍国医国药,2007,18(1):23-24.
[4]陈双喜,蔡显鹏,王仲石,等.鸟苷发酵的优化研究[J].微生物学通报,2002,29(5):65-69.
[5]王祝伟,孙毓庆.毛细管电泳法测定红毛五加茎皮中鸟苷的[J].应用化学,2004,21(1):32-34.
[6]高道侠,许敏.薄层扫描法测定金水宝胶囊中鸟苷的含量[J].江西中医学院学报,1998,10(3):131.
[7]Qian Q M,Wang Y S,Yang H X,et al.Colorimetric detection of metallothioneins using a thymine-rich oligonucleotide-Hg complex and gold nanoparticles[J].Anal Biochem,2013,436(1):45-52.
[8]Zhou B,Shi L F,Wang Y S,et al.Resonance light scattering determination of uranyl based on labled DNAzymegold nanoparticle system[J].Molecular and Biomolecular Spectroscopy,2013,110(6):419-424.

