基于文献计量学的我国期刊医疗器械风险管理研究热点分析
崔泽实,高小燕,王 菲,高于欣,李素敏,李传佳,高丽达
0 引言
风险管理进入医疗领域源于20世纪60年代的美国等国家[1],而医疗器械风险管理开始于20世纪90年代初[2],那个时期相继推出了相关标准EN1441:1997、ISO 14971:1998,后者后来过渡到 2000、2007版本[3],我国对应转化为 YY/T 0316—2000/—2003/—2008。我国于20世纪80年代在医院管理中引入风险管理理念[4],21世纪初有报道基于ISO 14971简介的风险管理在医疗器械中的应用[5]和开展医疗器械不良事件通报[6];颁布《医疗器械监督管理条例》;2009年,卫生部下发《综合医院评价标准(修订稿)》和《综合医院评价标准实施细则(征求意见稿)》的文件中提出“建立医学装备管理保障体系”;2010年,卫生部在《医疗器械临床使用安全管理规范(试行)》文件中要求“医疗机构应当对在用设备类医疗器械…进行…风险评估”。诸多报道表明,医疗器械导致的医疗风险不容忽视[7-9],加强医疗器械风险管理、建立安全有效的技术保障体系成为深化我国医药卫生改革进程中必须要解决好的一项重要课题[3,10]。
本研究应用文献计量学方法结合文献评阅,分析我国医疗器械风险管理研究的要素、聚焦领域及趋向。
1 材料与方法
采用3组检索策略:一组主题分别为“医疗器械”、“医疗设备”及“医学装备”+标题或关键词“风险管理”;另2组标题或关键词分别为“风险”和“安全管理”,其他与一组相同。以万方数据库(网络版)为基础扩展到CNKI数据库(新平台)及维普期刊资源整合服务平台进行检索(2003-2012年);整合检索结果输入统计软件查重,再沿参考文献追溯,获得样本文献;提取关键词等参量进行文献计量,运用SPSS17.0构建词篇矩阵、图形聚灯工具包(gCLUTO)做关键词词篇共现分析与聚类可视化分析[11],根据gCLUTO solution报告的文献编号进行文献评阅。
2 结果与分析
2.1 文献计量
(1)共检索到331篇文献,根据刊登栏目及文献评阅进行分拣,综述类文献203篇,占文献总数的61.33%;研究论著类128篇,占文献总数的38.67%。
(2)年代分布。基本呈逐年增加趋势,在2006年显现拐点,文献量达到了19篇,是2003年的2.71倍,之后陡增,2009年至2011年处于稳定后上升,2012年达到了67篇,如图1所示。
(3)期刊分布。源自113种期刊,CSTPCD收录期刊有38种,刊文170篇,占检索文献总数的51.36%;中国科技期刊要目总览(PKU,2011年北京大学发布)收录期刊34篇;中国科学引文数据库(CSCD)收录期刊 16篇[12-13]。

图1 医疗器械风险管理文献年代分布
(4)作者分布。第1作者单位203家;发文≥3篇的第1作者单位有20家,114篇;发文量≥3篇的第一作者有8位。文章来源于医疗机构的有188篇,占文献总数的56.80%;监督、监管机构的有108篇,占文献总数的32.63%;医疗器械生产与销售企业的有14篇;其余21篇出自高校、院所、中介、媒体等机构。
(5)采集关键词后经剔除宽泛词、合并同义词,获得97个关键词;统计频次,由高至低排序,见表1。

表1 文献关键词频次
2.2 聚类分析
将SPSS生成的97行×331列的关键词词篇共现矩阵导入gCLUTO进行聚类,聚类方法选择重复二分法(repeated bisection),相似性计算采用cosine函数,聚类标准函数为I2,结果见表2。
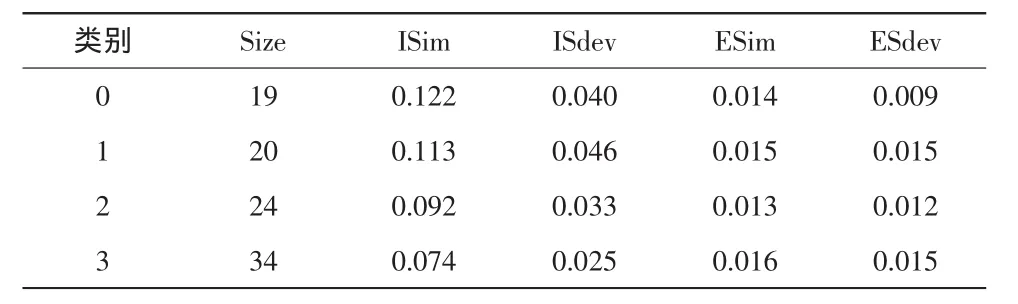
表2 关键词词篇矩阵双聚类分析
生成聚类可视化山峰图与可视化矩阵图,如图2、3 所示。
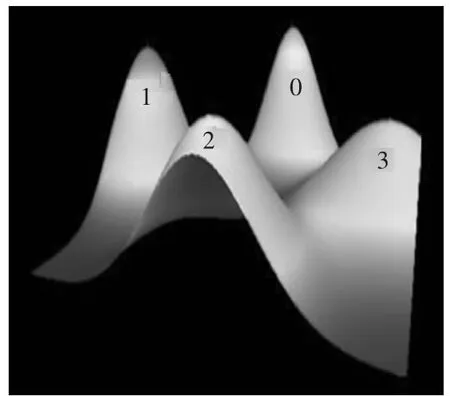
图2 可视化山峰图
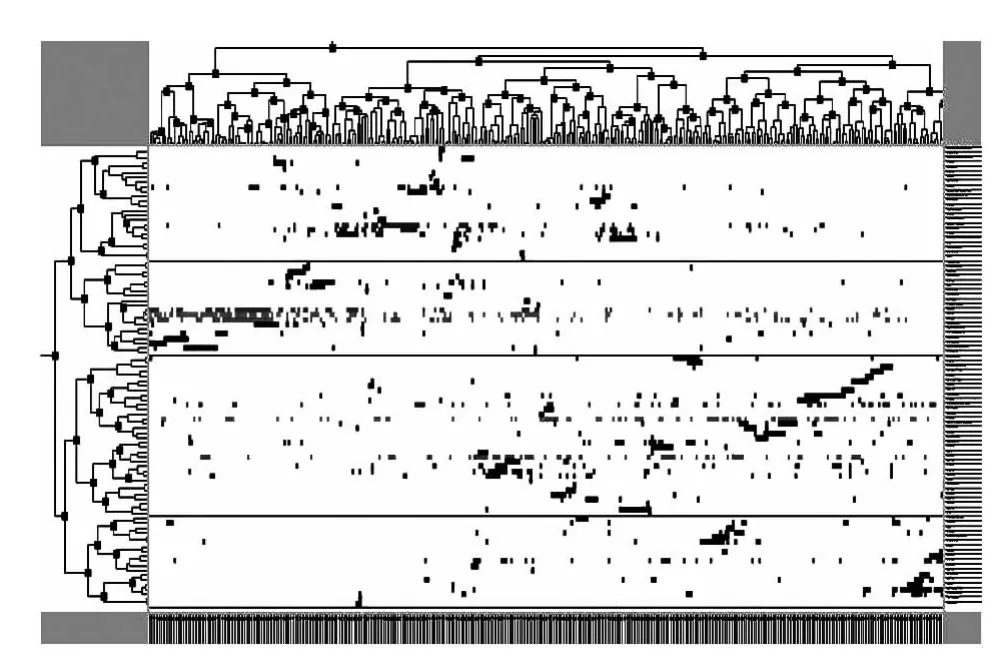
图3 可视化矩阵
山峰图反映各聚类的整体特征与效果,峰高与聚类内的相似性成正比;峰体积反映类内元素的数量;峰顶的颜色与类内偏差成反比,颜色越深偏差越小。可视化矩阵图的行距类左侧表示关键词聚类、右侧是对应的关键词,列聚类上方是文献聚类、下方是代表性文献,图中的颜色深浅表示频次高低[11]。根据ISim、ISdev、ESim、ESdev 4个指标及可视化矩阵与可视化山峰效果,聚为4类为佳。对图3做拉伸处理得出行聚类结果树状图谱,结合文献评阅进行分析:
(1)0类。关键词19个,聚类树状图谱如图4所示,山峰高度最高、峰顶颜色为红色、体积最小,ISim为0.122,表明集群内对象间相似性最高,主题很集中。涉及文献102篇,该类的显著特点是文献新(83篇代表文献发表在2008—2012年间)、研究论著文献多(63篇,占全部研究论著的50.78%),44篇文献的第一作者是临床一线医护人员,临床工程师与装备管理者33篇。从投资立项到提高认知、操作规范、人员培训等关键词的系列表达,映射出在用医疗器械风险控制研究的延伸趋向,涉及急诊、ICU、手术室、消毒供应、眼科、口腔等领域。史苏霞等调研了3所医院的114名ICU护士使用CRRT、呼吸机、吸引器等急救器材意外事件,从仪器故障、操作错误等10个指标进行分析,提出临床人员应与临床工程人员合作防范风险[14];伍燕平等运用失效模式与效应分析(FMEA)探索持续改进CSSD无菌器材库存质量、降低风险[15];巫彩奕等基于安全管理系统提出了生命支持器材的风险控制措施[16];周丽华等在分析487份血液透析机不良事件报告基础上提出了风险控制对策[17];康杰等比较了施加培训干预前后呼吸机故障的发生原因[18];另有学者探讨了口腔医疗器械的风险因素,提出有针对性的风险控制措施[19]。风险控制是风险管理的落脚点,而在用医疗器械风险管理的最终目标是与医疗风险管理汇聚,保障医疗质量。因此,应促进管理、医工、医护技等人员广泛参与、多方合作开展研究。通过提高风险管理认知、制定基于临床路径的操作规范、加强人员培训、避免使用因素风险、精细实施临床技术流程与医疗器械质控[20]等系列运作最大限度地控制风险。6篇相关文献源于企业,研究了企业风险管理水平的影响因素、高压灭菌器的风险控制,提出要实现产品质量要求与标准、供方、顾客、企业实际的无缝衔接才可能保障风险控制效果的建议[21-22]。
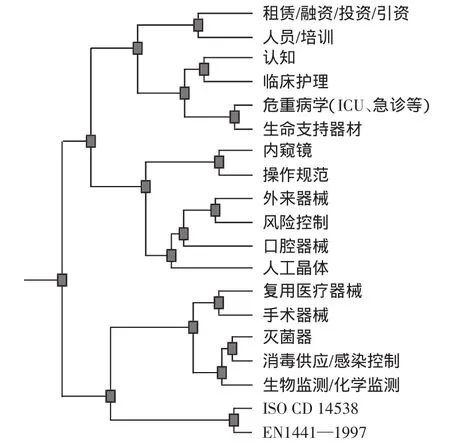
图4 0类聚类树状图
(2)1类。聚焦在医疗器械不良事件的监测、报告、分析和预测。聚类树状图谱如图5所示,峰高仅低于0峰、峰顶红色、体积较小,ISim为0.113,表明集群内对象间相似性高、主题集中,关键词量20个,涉及文献179篇。医疗器械不良事件报告与监测是对医疗器械上市后使用情况的一项监管评价措施,也是风险管理的重要活动内容,1984年始于美国,之后扩展到北美、欧洲等国家。文献评阅揭示我国开展医疗器械不良事件监测研究经历了国外经验评介与对策建议、建立监测体系与工作评估、报告分析与结果运用3个阶段。国家与地方医疗器械监管机构发表论文79篇,占相关论文总数的44.13%,其中1位作者贡献了9篇。张素敏等比较了世界各国医疗器械不良事件监测现状[23];有学者结合国际经验讨论了在不同医疗器械应用阶段加强MDR的重要性;王兰明系统论述了不良事件监测与风险管理及建立监测体系的建议[6];有学者采用问卷方法对报告表评分,分析质量、影响因素及报告者认知程度,提出强化不良事件监测报告的效应需要企业、使用者、监管方及患者的共同努力及培训不良事件监测队伍的必要性;14篇研究论著系统研究了不良事件报告数据,分析产生原因,初步开展追踪回顾性评价,为加强风险管理提供了重要参考数据;最近有报道把不良事件分析结果与医疗器械准入、许可证审批等工作结合,提出引入法律机制。基层医疗机构的研究特色在于注重把不良事件分析结果反馈到在用医疗器械的质量改进、预防性维护等技术保障环节中。随着不良事件监测工作的逐步深入细化,将更深入到装备管理、研发生产、基层风险管理等实践。因此,在政策导向层面引导实现不良事件监测分析与生产及应用双向对接,将会发挥更大作用。
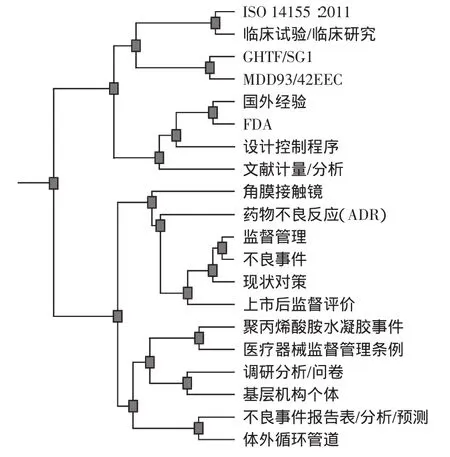
图5 1类聚类树状图
(3)2类。聚类树状图谱如图6所示,峰较高、峰顶颜色为黄色、体积相对较大,ESim为0.013,表明该类内容相对集中而独立。该类关键词24个,涉及文献125篇,主题聚焦在对医疗器械风险管理相关国际国内标准、法规的分析解读及比较研究上,多为综述类文献(102篇)。各专题文献数量的序位是YY/T 0316//ISO 14971、医疗器械临床使用安全管理规范、医用电气设备-安全通用要求(GB 9706/YY 0709/IEC 60601)、医疗器械监督管理条例、医疗器械质量管理体系(YY/T 0287/ISO 13485)等。监管机构率先示范,贡献了45篇论文;医疗机构发文32篇,反映出使用单位对国际国内标准、法规的关注与认知程度;企业、中介机构发表的文献主要集中在此类,分别为13篇和7篇。部分作者对某些专题内容进行了延拓细化,如对YY 0709—2009中医用报警系统测试的意义及适用性的探讨、无菌医疗器械实施GMP的建议等;另有7篇文献专题讨论了风险管理中生物学评价的作用。对各类国际国内标准、法规的参比研究也成为本研究领域的一个特色,在此基础上提出了风险管理体系和质量管理体系整合的需求和内容。这些研究对推动我国医疗器械风险管理工作起到了重要作用。
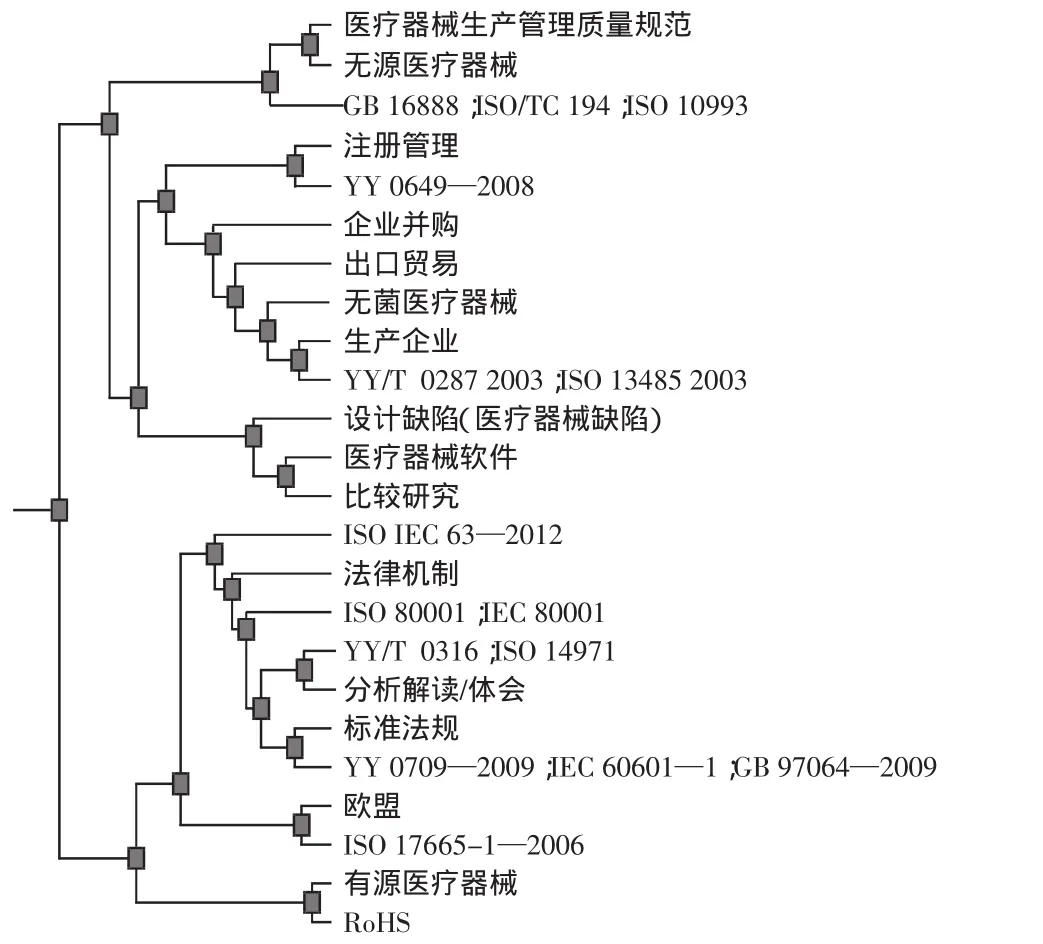
图6 2类聚类树状图谱
(4)3类。峰高度较高,峰顶颜色为绿色,体积较大,ISdev0.025、ESdev0.015,专业研究性强,涉及文献245篇,关键词最多(34个)。高频关键词为“风险评估、质量保证、预防性维护、安全管理”,表明了此类的核心内容与风险管理要围绕医疗器械的“生命周期”展开的“项目管理”原则,在此基础上强调从装备立项前期的风险评估到“操作规范、预防维护、政绩考核”等全程系列质量管理流程运作,透视出构建以安全有效、质量管理为核心的技术保障体系这一主题。针对该类山峰图体积大、包含元素量多的特点,进一步分析聚类树状图,可再细分为风险管理方法学、保障体系建设及专题医疗器械风险管理研究3个亚类,如图7所示。
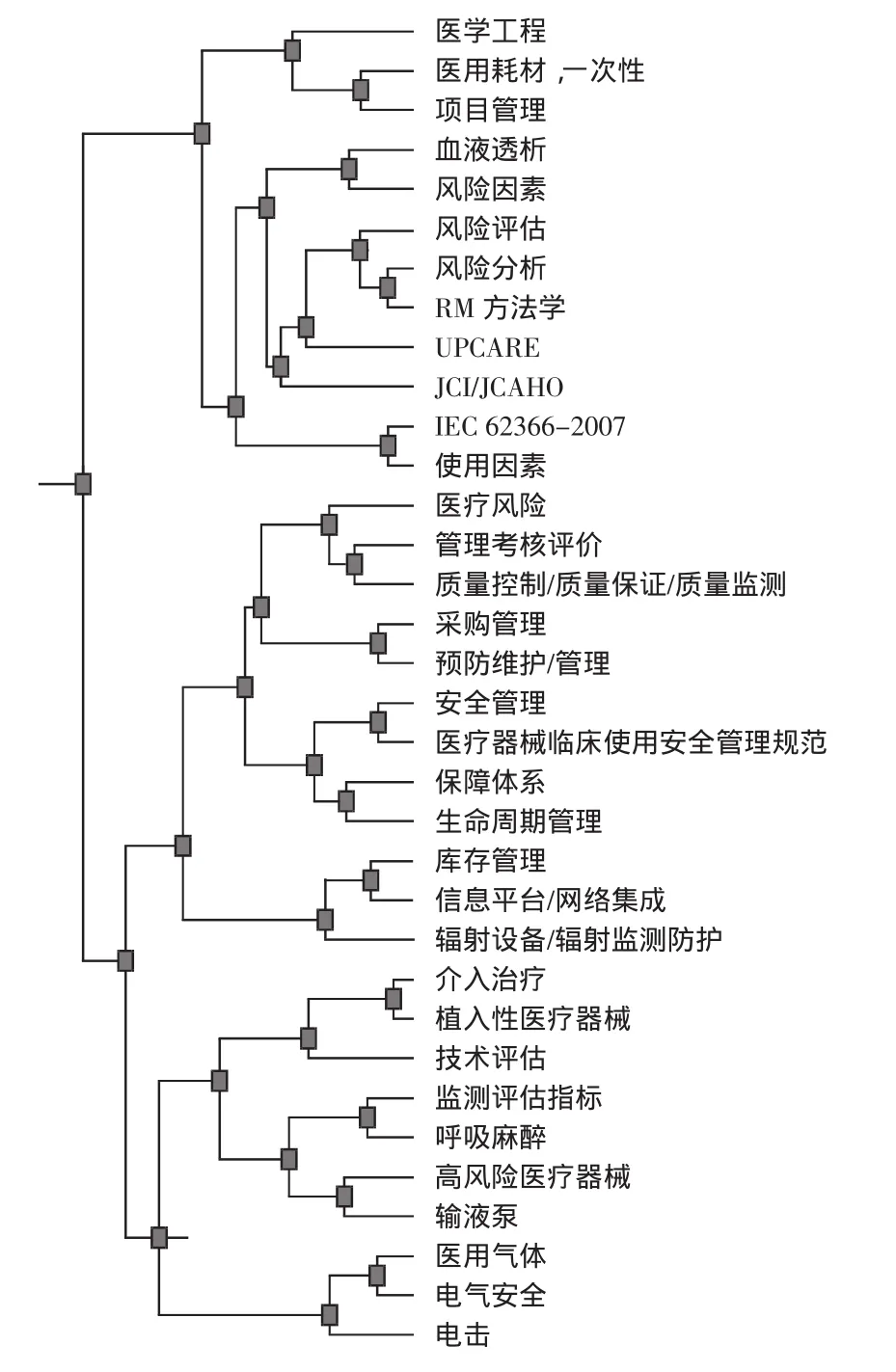
图7 3类聚类树状图谱
3-0类。以高风险器械、植入性器材、呼吸麻醉、输液泵、医用气体、电气安全等为样本的专题医疗器械风险管理研究。涉及69篇文献,其中研究论著46篇,占66.67%;基层医疗机构第一作者论文35篇,占49.28%;高校及研究机构8篇,企业5篇,其余出自监管机构。9篇报道运用技术评估分析安全有效性。
3-1类。该类涉及159篇文献,120篇源于医疗机构。这反映出我国在风险管理研究的基础上探讨构建技术保障体系进程中的3个基础路径:①起步于计量及医院自身质量保证要求的质量控制。20世纪90年代初陆续有对医用X线机等单项器材的质控研究的报道[24],扩布性展开是在部队医疗机构[25],发表有系列文章。②从临床工程学出发推进预防性维护。③安全管理。三者涉及到的一个共同理念是生命周期管理,研究趋向是在对在用医疗器械监测评价的基础上向装备流程的诸环节拓展,使采购前管理、从业人员培训、安全使用、维护保养、计量质控等方面纳入绩效评价实施风险管理全程监管,结合卫生部颁布的《医疗器械临床使用安全管理规范(试行)》建立安全质量管理保障体系,控制医疗风险,提高医疗服务质量。
3-2类。在分析风险因素的基础上,进行风险分析、风险评估及其方法学的研究是我国医疗器械风险管理学术发展的重要标志。尽管多数文献是基于ISO 14971从不同角度解读故障树法(FTA)、失效模式分析(FMEA)、效模式影响及危害分析(FMECA)、危害分析与关键控制点(HACCP)、危害和可操作性分析(HAZOP)等方法的应用,但不乏有专题研究报道。早在1997年杨建等就运用FTA进行了“NXS型X线机系统可靠性研究”[26],2001年谭杰文报道了“风险分析在高压氧治疗中应用的探讨”[27],而在本研究检索期间研究论著类陆续增多,累计达64篇。如:应用FTA研究“耳声发射检测系统的风险分析”、“血液透析机水路系统的风险分析”(找出主要风险因素是气泵和电磁阀故障)、“输注泵的安全性与风险管理”等报道;在分析评估方面,有专题研究使用检测仪器对某省医院在用麻醉呼吸机、输液泵、高频电刀等高风险医疗器械进行了量化监测评价;另有研究者结合工作实践对风险分析方法学进行了拓展研究,刘胧、王竹等人对比分析了现有风险管理方法,结合模糊数学和灰色关联理论对定量评估方法进行了改进,提出了面向医疗机构的风险分析模型,形成了以FMEA为核心的风险控制流程体系[28],并以C臂X线机为样本探索FMECA应用[29];文强等基于轨迹交叉理论建立有源医疗器械不良事件致因模型,研究了40例上市后有源医疗器械导致/可能导致伤害事件的发生原因[30];还有学者对采购、库存、装备项目、贷款等进行风险分析,研究辐射至配置管理环节,并结合临床工程学学科发展和医院认证强化风险管理。这些研究为有针对性地实施预防性维护、风险控制、制定操作规范与应用培训内容提供了重要参考依据。
3 讨论
近十几年来,我国管理、生产、应用追踪国际趋势,并密切结合国情积极开展研究,研究热点由21世纪初的国外经验评介、标准法规解读、决策建议逐步聚焦在对在用医疗器械不良事件的分析与预测,风险分析、评估及控制以及在此基础上整合的安全管理、质量管理技术保障体系建设方面;研究报道逐年增加、内容逐步深入,研究结论对政府制定加强医疗器械生产及临床使用管理决策起到参考作用,促进了医疗产品质量和医疗质量的提升。进一步深入研究,必将对我国卫生事业发展产生积极影响。
3.1 研究体系的双向对接与效应拓展
文献分析表明,现期研究多是单向从医疗器械入手,研究者多为管理与工程技术人员,偏重于关注医疗器械的物质属性和风险事件发生后的研究;同步对医疗风险研究的文献评阅发现,在诸多报道医疗风险评估指标体系或研究要素中并没有明确把医疗器械风险作为一项评价指标,这可能与对医疗风险管理的界定尚未统一认知有关[31]。在用医疗器械风险管理实质上是医疗风险管理的一部分,是一项全员、全技术流程、全生命周期管理工作的系统工程,而最直接的风险是存在于各临床路径之中,临床技术流程的逐项环节中均涉及到医疗器械的运用。应把医疗器械风险管理研究切合到沿临床路径延伸与医疗器械相关的交汇点上,动员医护、医技人员广泛参与,开展多学科、多专业、一定样本量的系统研究,并将研究成果纳入临床技术规范。另一方面,需要在风险管理研究信息与企业产品质量提升之间建立有效对接机制,以取得应用安全有效与我国相关产业发展的双重效应。
另在本研究采集到的文献中只有8篇标注基金项目,同期的学位论文也仅21篇,在某种程度上也反映出立项支持的课题研究甚少。因此,需要临床医学、医院管理、卫生经济等学术领域乃至各级科研管理机构给予足够的关注。
3.2 风险管理与保障体系建设路径
加强以安全管理和质量控制或质量增进[32]为主题的风险管理研究、构建医疗器械技术保障体系已成为深化我国医药卫生改革的迫切需求[33]。因此,首先需要在统一对风险管理认知的基础上凝练出加强保障体系建设的基本路径。
(1)建立有效的信息交互机制。信息技术是卫生技术体系中的重要支撑技术[34],有必要在运用文献计量学等手段对现有医疗器械风险管理信息资源进行挖掘、分析、整理的基础上,结合现场调研,建立医疗器械风险管理数据资源平台和全国性或区域性网络,实现监管、应用、生产三方信息便捷交互。
(2)提高研究质量,丰富工作实践。目前在风险分析、风险评估和风险控制3个方面,讨论风险因素的内容较多,而充分运用风险分析方法学的研究较少,更缺乏串联系列医疗器械事件的综合分析。风险评估对促进质量监测和预防性维护等起到较好作用,但评估指标需要与临床结合延拓细化。风险控制研究尚缺乏结合临床有目的的科学设计、干预措施与结果评估;实施质量控制是一项重要举措,但不同于产品质控过程,在用医疗器械风险控制涉及到多方面因素,需将质量控制纳入质量管理体系才能发挥更好的效应[35]。建议在分析风险事件的前期与后期分别引入技术评估机制与循证医学手段,开展安全有效性评估,有目的地收集、分析证据,将利于优化风险控制解决方案。
[1] 卢祖洵,程峰.风险管理方法及其在医院管理工作中的应用[J].中国卫生事业管理,1996,12(8):395-396,407.
[2] 李大平.医疗技术临床试验的风险管理[J].中国医院管理,2006,26(5):20-22.
[3] 蒋海洪,梁学林,奚健,等.对在用医疗器械实施风险管理的思考[J].中国医疗器械杂志,2012,36(2):128-132.
[4] 孙纽云.我国医疗安全与风险管理的政府职能变化历程[J].中国医院,2012,16(1):36-39.
[5] 吴俊华.风险分析在医疗器械中的应用简介[J].中国医疗器械信息,2000,6(2):4-5.
[6] 王兰明.医疗器械不良事件监测与风险管理浅议[J].中国药房,2003,14(9):516-519.
[7] 陈爱民.从5693例三类医疗器械不良事件看高风险医疗器械风险管理[J].兵团医学,2009,21(3):40-43.
[8] 欧阳昭连,池慧,杨国忠.在用医疗器械风险管理问题及对策研究(一)[J].中国医疗器械信息,2007,13(12):43-47.
[9] ECRI.Top 10 health technology hazards for 2013[J].Health Devices,2012,41(11):1-25.
[10]李军,许倩倩.YY/T 0316《医疗器械风险管理对医疗器械的应用》标准实施研究[J].中国医疗器械信息,2012,18(11):35-39.
[11]KarypisLab.gCLUTO-GraphicalClusteringToolkit[DB/OL].(2011-03-27)[2013-01-04].http://glaros.dtc.umn.edu/gkhome/views/cluto.
[12]中国科学技术信息研究所.2012年版中国科技期刊引证报告(核心板)中国科技核心期刊(中国科技论文统计源期刊)[M].北京:科学技术文献出版社,2012:12.
[13]朱强,蔡蓉华,何俊.中文核心期刊要目总览[M].6版.北京:北京大学出版社,2011.
[14]史苏霞,周立.ICU护士使用急救仪器的安全管理现状[J].解放军护理杂志,2010,27(8):561-565.
[15]伍燕平,杨海轶,李杏华,等.应用失效模式与效应分析方法改进一次性无菌物品库存管理[J].中国护理管理,2011,11(1):24-25.
[16]巫彩奕,王志望.生命支持设备的安全管理实践与效果[J].当代护士:学术版,2012(2):182-183.
[17]周丽华,刘坤涛,谢鹏程,等.血液透析装置临床应用中不良事件分析及风险管理[J].中国医疗设备,2011,26(8):74-76.
[18]康杰.对长期机械通气患者呼吸机的安全管理[J].中国医疗设备,2008,23(4):93-94
[19]李秀娥,王春丽,严红,等.口腔门诊护理中器械、药品风险分析及应对措施[J].护士进修杂志,2010,25(7):591-592.
[20]陈宇珂,郑理华,潘泽森,等.加强医疗设备质量控制体制建设探讨[J].医疗卫生装备,2012,33(1):109-110.
[21]李非,吕大雷,梁文,等.医疗器械生产企业风险管理水平的影响因素研究及对策[J].中国医疗器械信息,2010,16(4):74-77.
[22]陈锡阗.对接口问题的研究探讨[J].中国医学装备,2009,6(6):32-35.
[23]张素敏.医疗器械不良事件监测和再评价相关法规解读[J].中国医疗器械信息,2005,10(1):7-10.
[24]于建华,张建明,隋寿亭.威海市医用诊断X射线机的质量控制测试与评价[J].中国辐射卫生,1993,2(1):12.
[25]袁永林.以卫生装备质量控制为牵引 推动全军医学计量工作再上新台阶——总后卫生部袁永林副部长在卫生装备质量控制工作动员部署暨医学计量科委会管理专业委员会成立大会上的讲话(摘要)[J].医疗卫生装备,2008,29(5):1-2.
[26]杨健,贾高顺.NXS型X线机系统可靠性研究[J].中国医疗器械杂志,1997,21(1):11-15.
[27]谭杰文,许俭兴,李建军.风险分析在高压氧治疗中的应用探讨[J].中国组织工程研究与临床康复,2001(23):92-93
[28]刘胧,王竹,李萍.医疗设备使用风险分析方法的对比改进与应用[J].工业工程与管理,2011,16(6):133-138.
[29]王竹,刘胧,马帅.医疗设备使用风险评估中的FMECA新方法[J].工业工程, 2012,15(2):109-114.
[30]文强.基于轨迹交叉理论的有源医疗器械不良事件致因模型研究[J].中国药物警戒,2011,8(1):34-37.
[31]陈校云,孙纽云,林琳,等.我国医疗风险的研究要素和范畴[J].中国循证医学杂志,2011,11(5):479-482.
[32]ECRI.Risk Management,Quality Improvement,and Patient Safety[J].Healthcare Risk Control,2009(2):1-17.
[33]王羽.建立医疗风险监测预警体系,提高医疗质量,保障患者安全[J].中国循证医学杂志,2006,6(1):1-2.
[34]Ambrose E Wasunna, D Y Wyper.Technology for health in future[J].Wld hlth statist Quart,1998,51:33-34.
[35]杜和诗.医学计量、质量控制与医学装备质量保证的关系[J].医疗卫生装备,2013,34(6):120-123.

