威灵仙不同提取部位对脂多糖诱导的RAW264.7细胞NO生成及iNOS和TNF-α表达的影响
刘光耀 王海燕 白彩虹 贺海波 邓 为陈置丰 龚学谦 次旦多吉 颜为红
(1.三峡大学 医学院,湖北 宜昌 443002;2.三峡大学 中医临床医学院/宜昌市中医医院,湖北 宜昌443001;3.天然产物研究与利用湖北省重点实验室(三峡大学),湖北 宜昌 443002)
威灵仙系毛茛科铁线莲属植物威灵仙(Clematis chinensis Osbeck)、棉团铁线莲(Clematis hexapetala Pall.)或东北铁线莲(Clematis manshurica Rupr.)的干燥根和根茎,别名灵仙、黑须公、铁灵仙、铁扫帚.威灵仙味辛、咸,性温,为临床广泛使用的中药.具有祛风除湿、通络止痛之功,传统多用于治疗风湿性关节炎、类风湿关节炎、骨鲠咽喉、乳腺炎、痈疮等[1-2].其化学成分主要有三萜及皂苷、黄酮、挥发油(有机酸、有机酸酯、苯丙素、倍半萜、酚类)、生物碱、香豆素、木脂素、甾体、烷烃及Zn、Ca、Fe、Ni、Mg等[3-4].随着对其化学成分的日渐明晰,学者们发现,威灵仙除了有着突出的抗炎镇痛作用外,在抗肿瘤、抗菌抑菌、抗利尿、抗疟、降血糖、降血压、利胆等方面的显示了较好的疗效[4-6],能显著降低实验小鼠血尿酸、血沉和C反应蛋白的水平[7],抑制T淋巴细胞的过度增殖、抑制细胞因子TNF-α、IL-1β和PEG2来发挥抗类风湿性关节炎作用[8].但威灵仙中各种部位间抗炎作用有否有差异及对巨噬细胞分泌炎症因子的干预作用研究鲜有报道.基于此,本研究拟考查威灵仙不同提取部位(石油醚、乙酸乙酯、正丁醇和水萃取部位)对脂多糖(LPS)诱导的RAW264.7细胞NO生成及iNOS和TNF-α表达的影响,比较其作用的差异,明确威灵仙脂多糖诱导RAW264.7巨噬细胞炎症反应的活性部位,为其抗炎镇痛的临床应用和进一步研究开发提供理论依据.
1 材 料
1.1 实验药物
威灵仙根和根茎购自宜昌市中医医院,经天然产物研究与利用湖北省重点实验室(三峡大学)汪鋆植教授鉴定为威灵仙(Clematis chinensis Osbeck),植物标本现保存于天然产物研究与利用湖北省重点实验室(标本编号:20120824).
1.2 细胞株
小鼠巨噬细胞株RAW264.7购自中国科学院上海细胞研究所.
1.3 仪器与试剂
电子分析天平,中国上海梅特勒-托利多有限公司;旋转蒸发仪,中国无锡市星海王生化设备有限公司;Labconco低温冷冻干燥仪,美国Labconco公司;UV-2000型紫外-可见分光光度计,尤尼柯仪器有限公司;LDZ5-2自动平衡离心机,北京医用离心机厂;GENios酶标仪,瑞士Tecan公司;NU-4750E型CO2培养箱,Nu Aire公司;SW-4T-2F洁净工作台,上海博讯实业有限公司医疗设备厂;LS-B50L立式压力蒸汽灭菌器,上海华线医用核子仪器有限公司;EcoTM实时荧光定量PCR仪.RPMI1640细胞培养基、胰酶、二甲基亚砜(DMSO):Gibco公司;胎牛血清:杭州四季青生物材料有限公司;四甲基偶氮唑盐(MTT)、LPS:美国Sigma公司;诱导型一氧化氮合酶(iNOS)、一氧化氮(NO)测试试剂盒:南京建成生物工程研究所;小鼠TNF-αELISA检测试剂盒,北京达科为生物技术有限公司;iNOS、TNF-α以及GAPDH(上海生工生物工程有限公司合成,具体引物序列见表1);Trizol和DEPC(上海生工生物工程有限公司);Prime ScriptTM RT reagent Kit、Taq DNA 聚合酶(大连宝生物工程有限公司);其他试剂均为市售分析纯.

表1 实时定量PCR引物序列
2 方 法
2.1 威灵仙不同部位的制备
威灵仙根和根茎粉成粗粉,以95%乙醇为溶剂,在65℃条件下常压回流提取,提取液过滤后用旋转蒸发仪浓缩(温度55℃),得深棕色浸膏,将浸膏在通风橱中挥干至无醇味,加入蒸馏水混悬溶解,依次用石油醚、乙酸乙酯、水饱和的正丁醇萃取.在旋转蒸发仪上浓缩并回收萃取液,回收后的溶剂继续用于萃取.合并每一种萃取溶剂的萃取物,于通风橱中挥干溶剂,在冷冻干燥仪上干燥.实验时用DMSO溶解样品配制成质量浓度为10mg/mL提取物药液,再以细胞培养液稀释成所需浓度,经过0.22μm孔径滤膜过滤除菌后供实验用,使用时用含10%血清的DMEM培养液稀释成目标浓度.
2.2 RAW264.7细胞培养
RAW264.7细胞在37℃,5%CO2条件下,用含10%小牛血清、青霉素(1×105U/L)及链霉素(100 mg/L)的DMEM培养液传代培养,实验用细胞均处于对数生长期.
2.3 威灵仙不同提取部位对RAW264.7细胞的毒性作用
RAW264.7细胞按5×105/孔接种于96孔板中,贴壁4h后,加入不同质量浓度(0、25、50、100、200μg/mL)的威灵仙不同提取部位,每组设置3个复孔,孵育24h后,每次加入新配制的5mg/mL MTT液20μL,37℃避光孵育4h,终止培养.吸去上清液,每孔加入DMSO 150μL,置摇床上低速振荡10min后,用酶标仪于490nm处测量各孔的吸光度值(OD490nm)根据公式:细胞抑制率=(1-药物孔OD值/阴性对照孔OD值)×100%.
2.4 LPS对RAW264.7细胞的毒性作用
为了确定LPS刺激RAW264.7细胞分泌炎症介质和促炎因子的作用浓度,需要确定LPS影响RAW264.7细胞安全浓度.取RAW264.7细胞按5×105/孔接种于96孔板中,贴壁4h后,加入不同质量浓度LPS(0.125、0.25、0.5、1、2μg/mL),空白对照组只加入培养基,每组设置3个复孔,作用24h,然后测定细胞活性,检测方法同2.3.确定无细胞毒性的最大浓度,以下进行LPS刺激RAW264.7细胞分泌炎症介质和促炎因子实验时按照此浓度进行.
2.5 威灵仙不同提取部位对LPS刺激RAW264.7细胞释放NO的影响
RAW264.7细胞按5×105个/mL接种于48孔板中,贴壁4h后,然后分别加入不同质量浓度(25、50、100μg/mL)的威灵仙不同提取部位孵育2h,再加入终质量浓度为1μg/mL的LPS刺激24h,正常对照孔或模型对照孔加入等体积的培养基),每组设置6个复孔.作用24h后,收集上清,采用Griess法[9]测定上清中NO含量,具体操作按试剂盒说明书进行.
2.6 威灵仙不同提取部位对LPS刺激RAW264.7细胞iNOS活性的影响
RAW264.7细胞按5×105个/mL接种于48孔板中,贴壁4h后,然后分别加入不同质量浓度(25、50、100μg/mL)的威灵仙不同提取部位孵育2h,再加入终质量浓度为1μg/mL的LPS刺激24h,正常对照孔或模型对照孔加入等体积的培养基),每组设置6个复孔.作用24h后,收集上清液,测定上清液中iNOS,具体操作按试剂盒说明书进行.
2.7 威灵仙不同提取部位对LPS刺激RAW264.7细胞分泌TNF-α的影响
RAW264.7细胞按5×105个/mL接种于6孔板,贴壁4h后,然后分别加入不同质量浓度(25、50、100μg/mL)的威灵仙不同提取部位孵育2h,再加入终质量浓度为1μg/mL的LPS刺激24h,正常对照孔或模型对照孔加入等体积的培养基),每组设置3个复孔.作用24h后,收集上清液,测定上清液中TNF-α含量,具体操作按各ELISA试剂盒说明书进行.
2.8 实时荧光定量PCR法检测威灵仙不同提取部位对RAW264.7细胞iNOS和TNF-αmRNA表达量的影响
RAW264.7细胞按5×105个/mL接种于6孔板,贴壁4h后,然后分别加入不同质量浓度(25、50、100μg/mL)的威灵仙不同提取部位孵育2h,再加入终质量浓度为1μg/mL的LPS刺激24h,正常对照孔或模型对照孔加入等体积的培养基),每组设置3个复孔.作用24h后,移走培养液,用PBS轻轻洗涤一遍,加入1mL Trizol,室温静置5min,用移液枪吹打细胞,使其充分裂解.将Trizol转移至1.5mL无RNase的EP管中,4℃,12000rpm离心5min,弃沉淀,将上清转移至另一个1.5mL无RNase的EP管中,按照0.2mL氯仿/mL Trizol加入氯仿,振荡混匀.室温静置15min.4℃,12000rpm 离心15min.吸取上层水相至另一个1.5mL无RNase的EP管中.按0.5mL异丙醇/mL Trizol加入异丙醇,混匀,室温静置10min.4℃,13000rpm离心10min,弃上清,RNA沉于管底.按1mL 75%乙醇/mL Trizol加入75%乙醇,温和振荡离心管,悬浮沉淀.4℃,13000 rpm离心15min,尽量弃上清.室温晾干.用20μL E-lution buffer溶解RNA样品.立即进行逆转录.逆转录完成后的样品,立即进行荧光定量或放入-80℃保存备用.以GAPAH为内参照检测iNOS和TNF-α基因的表达.每组样本重复3次,以空白对照组RAW264.7细胞的检测基因表达量为1,2-ΔΔCT法计算各组相对表达量,计算公式为:fold=2-ΔΔCT=2-(Δct实验组-Δct空白对照组),ΔCT=CT待测样品-CT内参.
2.9 统计学分析
3 结 果
3.1 威灵仙不同提取部位对RAW264.7细胞的毒性作用
利用MTT法测定不同浓度威灵仙不同提取部位对RAW264.7细胞的存活率,确定威灵仙不同提取部位是否对细胞有毒性作用.图1结果显示,威灵仙不同提取部位(25、50、100μg/mL)对 RAW264.7细胞的存活率没有影响,但是威灵仙不同提取部位在200μg/mL时明显降低RAW264.7细胞的存活率,同时显微镜下观察细胞状态与MTT实验结果一致.表明威灵仙不同提取部位对RAW264.7细胞无明显毒性,以下研究均在200μg/mL以下进行,即选择威灵仙不同提取部位质量浓度为25、50、100μg/mL进一步观察威灵仙不同提取部位的抗炎作用.

图1 威灵仙不同提取部位对RAW264.7细胞的毒性影响
3.2 LPS对RAW264.7细胞的毒性影响
LPS处理细胞24h后,随着LPS浓度的升高RAW264.7细胞存活率有所下降,当浓度达到2μg/mL时,可使RAW264.7细胞存活率显著降低,与空白对照组比较具有显著性差异(P<0.01).因此,本实验选取的LPS刺激RAW264.7细胞的安全浓度为1.0μg/mL作用时间为24h,以此来进一步观察威灵仙不同提取部位的抗炎作用及机制.
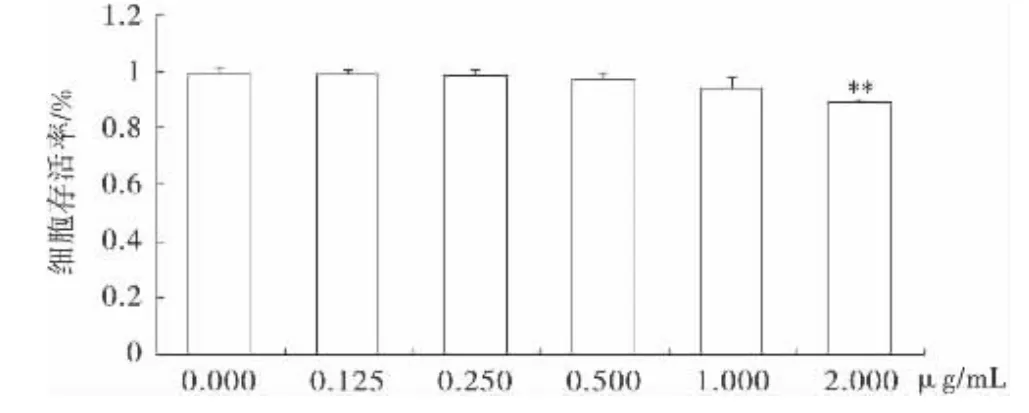
图2 不同浓度LPS对RAW264.7细胞的毒性影响
3.3 威灵仙不同提取部位对LPS刺激RAW264.7细胞的NO释放影响
如图3所示,模型组RAW264.7细胞释放NO显著增加,与空白对照组比较具有显著性差异(P<0.01);用威灵仙不同提取部位处理后,它们对激活状态RAW264.7细胞NO释放均具有不同程度的抑制作用,并呈良好的剂量依赖关系.实验结果表明威灵仙不同提取部位均能够抑制LPS诱导的RAW264.7细胞NO释放,其作用强弱依次为威灵仙乙酸乙酯部位、石油醚部位、正丁醇部位和水部位.

图3 威灵仙不同提取部位对LPS刺激RAW264.7细胞释放NO的影响
3.4 威灵仙不同提取部位对LPS刺激RAW264.7细胞iNOS的活性影响
图4所示,模型组iNOS活性明显增加,与空白对照组比较具有显著性差异(P<0.01);用威灵仙不同提取部位处理后,它们对激活状态RAW264.7细胞iNOS活性均具有不同程度的抑制作用,并呈良好的剂量依赖关系.实验结果表明,威灵仙不同提取部位均能够抑制LPS诱导的RAW264.7细胞iNOS表达,其作用强弱依次为威灵仙乙酸乙酯部位、石油醚部位、正丁醇部位和水部位.

图4 威灵仙不同提取部位对LPS刺激RAW264.7细胞iNOS的活性影响
3.5 威灵仙不同提取部位对LPS刺激RAW264.7细胞分泌TNF-α的影响
图5所示,模型组TNF-α含量明显增加,与空白对照组比较具有显著性差异(P<0.01);用威灵仙不同提取部位处理后,它们对激活状态RAW264.7细胞TNF-α含量均具有不同程度的抑制作用,并呈良好的剂量依赖关系.实验结果表明威灵仙不同提取部位均能够抑制LPS诱导的RAW264.7细胞TNF-α分泌,其作用强弱依次为威灵仙乙酸乙酯部位、石油醚部位、正丁醇部位和水部位.

图5 威灵仙不同提取部位对LPS刺激RAW264.7细胞分泌TNF-α的影响
3.6 威灵仙不同提取部位对LPS刺激RAW264.7细胞iNOS和TNF-αmRNA表达量的影响
图6所示,模型组RAW264.7细胞iNOS和TNF-αmRNA表达量显著升高,与空白对照组比较具有显著性差异(P<0.01);用威灵仙不同提取部位处理后,它们均能降低iNOS和TNF-αmRNA表达量,其作用强弱依次为威灵仙乙酸乙酯部位、石油醚部位、正丁醇部位和水部位.

图6 威灵仙不同提取部位对LPS刺激RAW264.7细胞iNOS和TNF-αmRNA表达量的影响
4 讨 论
炎症发生时,机体组织常常会分泌许多抗炎症因子来保护组织免受损伤.在生理条件下,促炎因子(TNF-α、IL-1β、IL-6等)和抗炎因子(IL-4、IL-10等)的分泌在体内保持一种动态的平衡状态.然而,当持续过量产生促炎症因子会使得整个炎症因子调节网络的平衡被打破,进而诱发炎症的级联反应而导致不良的免疫反应和炎症失调的疾病,如风湿性关节炎、类风湿关节炎等.中药威灵仙为传统的抗炎中药,近年来研究发现其对促炎因子具有显著的抑制作用[4],然而对其不同提取部位间作用的差异性却鲜见报道.基于此,本研究LPS刺激RAW264.7细胞炎症模型,比较其不同提取部位对LPS刺激的RAW264.7细胞分泌促炎因子的差异.实验发现威灵仙威灵仙石油醚部位、乙酸乙酯部位、正丁醇部位和水部位均能不同程度抑制RAW264.7细胞分泌产生NO、iNOS、TNF-α,其作用强弱依次为乙酸乙酯部位、石油醚部位、正丁醇部位和水部位.
NO是具有广泛生物活性的气体分子,同时也是细胞间信息传递的重要调节因子,具有介导细胞免疫和炎症反应的功能.NO是以左旋精氨酸为底物,在一氧化氮合酶(nitric oxide synthase,NOS)催化下合成的,它分为:结构型(constructive NOS,cNOS)和诱导型(inducible NOS,iNOS)两种,其中iNOS主要存在于巨噬细胞内,生理条件下钙/钙调蛋白非依赖的NOS无活性表达,LPS仅刺激与炎症有关的iNOS的表达,促使NO水平升高.研究发现机体内NO的过量生成与炎症的发生密切相关[10-11],在炎症区域,由于促炎因子的异常分泌,使得NO合成和释放大量增加.大量生成的NO一方面可对细胞产生较强的细胞毒性,另一方面与氧自由基结合,生成毒性更强的ONOO-等物质,从而进一步加剧炎症的损伤[12],因此抑制机体NO的异常合成和释放是治疗炎症相关疾病的重要手段.实验发现,RAW264.7细胞经LPS刺激后,其分泌iNOS水平明显升高,NO释放显著增加,用威灵仙不同提取部位处理后,它们对激活状态RAW264.7细胞iNOS活性和NO释放均具有不同程度的抑制作用,并呈良好的剂量依赖关系.
LPS可刺激单核/巨噬细胞分泌多种促炎因子(如TNF-α、IL-6等)来诱导和加强局部炎症反应,它们往往具有多种生物学活性,在炎症的发生、发展以及炎症的调控中发挥重要作用.在炎症初期,炎症区域的巨噬细胞分泌TNF-α,通过细胞因子级联激活其它细胞因子(如IL-6、IL-1β等)加速炎症部位的炎症反应[13];在这个过程中,NF-κB扮演着极为重要的角色.炎症初期,炎细胞分泌的 TNF-α、IL-6、IL-1β可诱导NF-κB核移位,加速促炎因子的转录,形成恶性循环[14].研究结果显示LPS刺激RAW264.7巨噬细胞后,可见TNF-α分泌的大量增加;威灵仙不同提取部位均能明显抑制LPS诱导RAW264.7巨噬细胞分泌TNF-α,并呈剂量依赖效应.
综上所述,威灵仙具有潜在的抗炎药理作用,其不同提取部位均能明显抑制LPS诱导RAW264.7巨噬细胞分泌TNF-α、iNOS炎症因子,并且同提取部位的抗炎作用效果不同,其作用强弱依次为威灵仙乙酸乙酯部位、石油醚部位、正丁醇部位和水部位.目前的研究初步证实,抑制炎症因子的分泌和释放可能是威灵仙发挥抗炎作用机制之一,但其具体的抗炎通路还有待进一步研究.
[1]国家药典委员会.中华人民共和国国药典:一部[M].北京:中国医药科技出版社,2010:234-235.
[2]Hsieh M S,Wang K T,Tseng S H,et al.Using 18FFDG MicroPET Imaging to Measure the Inhibitory Effects of Clematis Chinensis Osbeck on the Pro-inflammatory and Degradative Mediators Associated with Inflammatory Arthritis[J].J Ethnopharmacol,2011,136(3):511-517.
[3]Liu L F,Ma X L,Wang Y X,et al.Triterpenoid Saponins from the Roots of Clematis Chinensis Osbeck[J].J Asian Nat Prod Res,2009,11(5):389-396.
[4]赵燕强,杨立新,张宪民,等.威灵仙的成分、药理活性和临床应用的研究进展[J].中药材,2008,31(3):465-470.
[5]Wu W,Xu X,Dai Y,et al.Therapeutic Effect of the Saponin Fraction from Clematis Chinensis Osbeck Roots on Osteoarthritis Induced by Monosodium Iodoacetate Through Protecting Articular Cartilage[J].Phytother Res,2010,24(4):538-546.
[6]柯颂远.介入化疗联合威灵仙外治老年人头颈部癌的临床研究[J].中国老年学杂志,2003,23(4):256-257.
[7]徐先祥,夏伦祝,戴 敏,等.威灵仙总皂苷抗炎镇痛作用研究[J].中药药理与临床2005,21(4):34-35.
[8]李 特,李运曼,刘丽芳,等.威灵仙总皂苷抗类风湿性关节炎的作用机制[J].中国药科大学学报,2009,40(2):157-160.
[9]Shin K M,Kim Y H,ParkW S,et al.Inhibition of Methanol Extract from the Fruits of Kochia Scoparia on Lipopolsaccharide Induced Nitric Oxide,Prostaglandin E2,and Tumor Necrosis Factor-a Production from Murine Macrophage RAW264.7Cells[J].Boil Pharm Bull,2004,27(4):538-543.
[10]胡亚娥,茅家慧,刘 霞,等.氧化苦参碱对脂多糖诱导的RAW264.7细胞一氧化氮及其诱导型合酶表达的影响[J].南通大学学报:医学版,2011,31(3):166-169.
[11]李晓红,齐 云,蔡润兰,等.芦荟大黄素对LPS诱导的RAW264.7细胞NO生成及iNOS表达的影响[J].中国药理学通报,2010,26(4):488-492.
[12]Lala P K,Chakraborty C.Role of Nitric Oxide in Carcinogenesis and Tumour Progression[J].Lancet Oncol,2001,2(3):149-156.
[13]Fleshner M,Johnson J D.Exogenous Extra-Cellular Heat Shock Protein 72:Releasing Signal(s)and Function[J].Int J Hyperthermia,2005,21(7):457-471.
[14]Xiao C,Li J,Dong X X,et al.Anti-Oxidative and TNF-αSuppressive Activities of Puerarin Derivative(4AC)in RAW264.7Cells and Collagen-Induced Arthritic rats[J].Eur J Pharmacol,2011,666(1-3):242-250.
