脑室内注射胰岛素改善心肺复苏后大鼠神经功能及其机制的研究*
何婧瑜 王 晶﹡
①首都医科大学宣武医院急诊科 北京 100053
我国每年约54.4万患者需进行心肺复苏(cardiopulmonary resuscitation,CPR)[1]。CPR后患者全脑缺血再灌注(ischemia/reperfusion,I/R)损伤,神经元凋亡显著,神经功能严重障碍,最终导致患者死亡或丧失生活能力,抑制神经元凋亡成为当前促进脑复苏的研究热点[2-3]。胰岛素是临床常用的降糖激素,随着医学科学研究的进展,胰岛素抑制神经元凋亡的作用逐渐被人们所了解。Duarte等[4]利用皮层神经元I/R模型,发现胰岛素可抑制促凋亡基因Caspase-3 mRNA的表达,减少神经元凋亡。目前,胰岛素对于CPR后神经系统凋亡的影响研究尚少,本试验研究通过经食道超速起搏诱发室颤,制备大鼠CPR模型,研究脑室内注射胰岛素通过调节Caspase-3 mRNA的表达,抑制神经元凋亡,改善神经功能的机制。
1 材料与方法
1.1 药品与试剂
0.1%盐酸肾上腺素注射液(天津金缕氨基酸有限公司,批号为0508201);恩弗烷(河北九派制药有限公司);In Situ Cell Death Detection Kit(POD:11 684 817 910);Real-time PCR引物(上海生工生物技术公司);PCR产物纯化试剂盒(美国Qiagen);电子血糖仪(ACCU-CHEK Active)(德国罗氏);Opticon2 real time PCR and System(美国Transgenomic);PCR仪(美国Bio-RAD)。
1.2 动物及分组
30只健康成年雄性无特定病原体(specific pathogen free,SPF)级SD大鼠,体重为330~360 g,由首都医科大学宣武医院动物实验室提供。随机分为:①假手术对照组(对照组6只);②心肺复苏组(复苏组12只);③心肺复苏后胰岛素干预组(胰岛素组12只)。
1.3 经食道超速起搏诱发室颤建立大鼠心肺复苏模型
大鼠术前不禁食,经口气管插管以1%~2%恩弗烷联合30%氧气、70%笑气混合吸入全麻。分离左侧股动静脉外接MP150生理记录仪(美国BIOPAC),监测动物血压、心电图及肛温改变,维持体温(37±0.5)℃。根据Jia等[5]和Song等[6]提供的方法,经大鼠食管超速起搏心脏诱发室颤,6 min后CPR,经股静脉注射40 μg/kg肾上腺素;根据大鼠体重,由Harvard小动物呼吸机(美国MA1 55-7058)自动设定通气频率,潮气量为6 ml/kg;人工手法行胸外心脏按压,频率为200次/min,按压深度为大鼠胸廓前后径1/3;持续3 min,未复苏大鼠进行5 J非同步电除颤;总复苏时间>15 min剔除。大鼠恢复室上性心率,收缩压>60 mm Hg并持续10 min以上,认为复苏成功。建模期间不使用其他药物,复苏过程中检测各组大鼠血气改变,确保胰岛素组和复苏组大鼠血气无统计学差异,差异显著予以剔出。
1.4 给药方式
建模成功后10 min,大鼠分别置于立体定位仪下,于前囟后1.2 mm、左中线水平旁开1.5 mm及深3.5 mm处行脑室内微量注射,胰岛素组大鼠注射胰岛素12.5 μl(1U)、其余组大鼠注射9%生理盐水12.5 μl,注射过程缓慢,>10 min。
1.5 各组大鼠神经功能缺失评分(neurologic deficit scores,NDS)
按照Jia等[6]提供国际通用的NDS80分进行评分,评价大鼠的神经功能改变,0分代表脑死亡,80分代表大脑功能正常,分值越高其神经功能越好。NDS>60作为大鼠神经功能预后良好的独立预测因子。复苏前3 d评价大鼠神经功能,剔出NDS最好或最差的大鼠,排除个体差异所造成的试验误差;自主循环恢复(return of spontaneous circulation,ROSC)24 h、72 h和7 d后由受专业训练的两个实验员对各组SD大鼠采用双盲法进行独立评分,最终NDS取两者平均值。
1.6 dUTP缺口末端标记(dUTP nick end labeling,TUNEL)法染色
CPR后7 d,将大鼠麻醉后灌注取脑,制备海马石蜡切片。取视交叉以后由3 mm向后冠状切开,每隔3张取1张切片,厚度为4 μm,连续取5张。采用末端脱氧核糖核苷转移酶介导的TUNEL法,严格按照试剂盒说明进行(原位细胞凋亡检测试剂盒POD:11684817910)。在光学显微镜下观察海马CA1区神经元的形态,凋亡细胞表现为核棕染,着色不均,染色质向外周分散。400倍显微镜下计数每1 mm2高倍视野下凋亡细胞数目。5张切片凋亡细胞计数取平均值作为最终结果
1.7 实时聚合酶链反应(real-time polymerase chain reaction,RT-PCR)测定
(1)引物设计。参照gen bank公布的引物序列进行[7]。引物序列如下:Rat Caspase-3_F:5'-AACCTCCGTGGATTCAAAATC-3;Rat_Caspase-3_R:5'- TTCAAGAGTAATCCATTTTG TAAC-3(NM_012922)Rat_GAPDH_F:5'-CCCCCAATGTATCCGTTGTG-3';Rat_GAPDH R:5'-TAGCCCAGGATGCCCTTTAGT-3'(NM_01008)。
(2)RT-PCR检测扩增产物特异性。大鼠断头取脑冰上剥离海马,取海马CA1区0.1 g组织Trizol法提取大鼠海马总RNA;利用RT-PCR反应检测产物的分子量,保证产物的特异性。
(3)荧光实时定量PCR半定量Caspase-3 mRNA的表达量(Opticon2实时定量PCR和系统:美国Transgenomic)。在同一反应中,用标准曲线校正不同实验组大鼠海马组织中GAPDH、Caspase-3 mRNA表达水平,测得的值分别与该组的GAPDH比较得出每个细胞内Caspase-3的mRNA表达水平的相对定量。
1.8 监测心肺复苏组及胰岛素组血糖改变
测定大鼠心肺复苏前、复苏时、复苏后1 h、复苏后2 h以及复苏后24 h血糖。
1.9 统计学方法
统计结果由计算机统计包Spss 17.0进行统计分析,计量资料采用均数±标准差(),组间比较采用单因素方差分析;计数资料采用中位数(25 th~75 th百分位数),组间比较采用秩和检验,以P<0.05为差异有统计学意义。相关性统计应用Pearson相关分析进行统计。
2 结果
2.1 胰岛素组与复苏组大鼠海马CA1区不同时间点促凋亡基因Caspase-3 mRNA表达量
CPR后24 h和72 h,胰岛素组促凋亡因子Caspase-3 mRNA表达量低于复苏组,胰岛素组及复苏组Caspase-3 mRNA表达分别为:CPR后24 h(0.43±0.03,1.39±0.36,P<0.05);CPR后72 h(0.63±0.06,1.08±0.05,P<0.05);胰岛素组72 h促凋亡因子Caspase-3 mRNA表达量高于24 h(0.43±0.03,0.63±0.06,P=0.006),复苏组各时间点Caspase-3 mRNA表达量无差异(1.39±0.36,1.08±0.05,P>0.05)。
2.2 各组大鼠CPR后7 d海马CA1区神经元TUNEL染色的结果
经400倍显微镜放大观察,胰岛素组与复苏组海马与皮层散布棕色细胞,以海马区最为密集(如图1所示)。
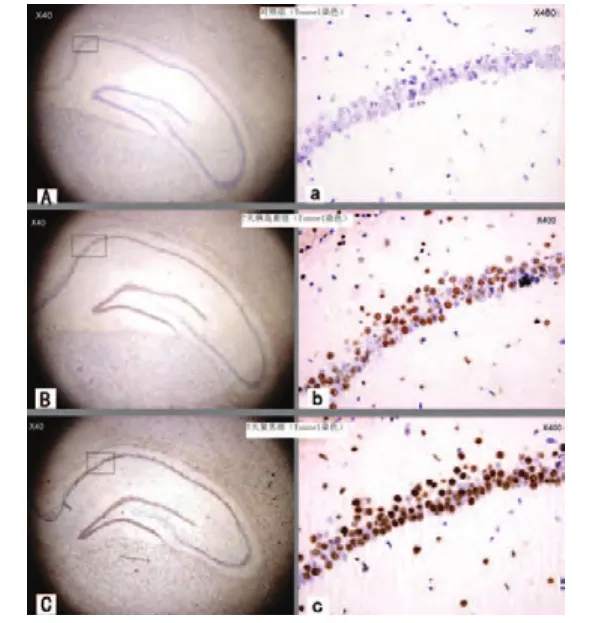
图1 各组大鼠海马CA1区TUNEL染色情况
在高倍视野下计数1 mm2阳性染色细胞数发现,与对照组凋亡细胞(5.12±3.26/mm2)比较,复苏组凋亡细胞(124.75±17.35/mm2)明显增高,其差异有统计学意义(F=586.229,P<0.001);胰岛素组凋亡细胞(92.79±7.5/mm2)低于复苏组凋亡细胞(124.75±17.35/mm2)(F=5.853,P=0.02);但胰岛素组凋亡细胞高于对照组凋亡细胞,其差异有统计学意义(F=1685.336,P<0.001)。
2.3 各组大鼠复苏前、复苏后24 h、72 h和7 d的NDS
复苏前各组大鼠无显著的神经功能缺陷;建模成功后对照组大鼠各时间点无功能缺陷。与对照组相比,复苏组及胰岛素组大鼠CPR后24 h和72 h神经功能缺失显著;CPR后7 d,NDS恢复,其结果复苏组与对照组相比24 h和72 h均为P<0.001;而7 d则P=0.395;胰岛素组与对照组相比24 h和72 h均为P<0.001;而7 d则P=0.394。胰岛素组与复苏组比较CPR后24 h,胰岛素组NDS高于复苏组,其差异有统计学意义;72 h评分胰岛素组略高于复苏组,但两者比较无统计学意义(P=0.114);CPR后7 d胰岛素组与复苏组比较差异无统计学意义(P=0.973)(见表1)。

表1 各组大鼠不同时间NDS评分结果
2.4 相关性检测
①24 hNDS评分与24 hCaspsase-3 mRNA、72 h Caspase-3 mRNA表达量负相关(r=-0.961,P=0.002;r=-0.903,P=0.014)。
②24 h NDS,72 h NDS与7 d凋亡细胞数目显著负相关(r=-0.893,P=0.03;r=-0.767,P=0.026)。
2.5 脑室内注射1U胰岛素对于血糖的影响
胰岛素组与复苏组CPR前、CPR时和CPR后1 h、2 h和24 h静脉血糖值比较差异无统计学意义。CPR前胰岛素组与复苏组血糖(mmol/L)分别为44±1.61和6.32±0.74,P>0.05;CPR时血糖为0.06±2.31和9.24±2.66,P>0.05;CPR 1 h时血糖为8.46±3.16和7.78±3.28,P>0.05;CPR 2 h时血糖为5.10±1.82和6.3±3.84,P>0.05;CPR 24 h时血糖为6.40±2.27和7.40±1.17,P>0.05。
3 讨论
CPR后脑缺血缺氧再灌注损伤,导致TFN-α,IL-6等大量释放,与神经元受体表面死亡受体Fas等结合,激活外源性凋亡通路如Caspases(半胱氨酸天冬氨酸特异性蛋白酶)级联反应,导致DNA断裂,神经元凋亡[8]。
目前,已经发现14种不同的Caspases,活化的Caspases参与许多细胞学凋亡特征的改变。正常神经元中Caspase-3主要以惰性蛋白酶原Procaspase-3的形式存在于胞质中,其分子量为32 kDa,仅存在微量表达的Caspase-3的活性亚基。Guan等[9]应用大鼠血管夹闭全脑缺血再灌注模型发现,缺血、缺氧等伤害性刺激促使Caspase-3表达增高,胞质内无活性的Procaspase-3惰性蛋白酶原裂解为分子量12 kDa和17 kDa的Caspase-3活性亚基,通过多条细胞信号转导通路触发细胞内源性和外源性凋亡通路,促进神经元凋亡;全面抑制Caspases级联反应或仅抑制Caspase-3激活、表达均表现出抑制神经元调亡的作用。Teschendorf等[10]利用6 min室颤法制备CPR模型证实,Caspase-3表达与海马CA1区神经元凋亡显著正相关。Caspases-3是细胞凋亡的主要效应器,是脑缺血过程中肯定的负面恶化因素[9-10]。
本实验研究发现对照组大鼠为排除体内过剩及有害的细胞,维持正常的生理机能,仅小部分细胞自发性凋亡(如图1A所示);6 min室颤后大鼠CPR全脑严重缺血再灌注损伤,其机体病态启动神经元凋亡程序,诱导大量神经元凋亡,CPR后7d海马及其对皮层神经元凋亡显著,以海马区域最为密集(如图1B、图1C所示):CPR造成以凋亡为特点的严重的迟发性神经元损伤,以海马最为严重[11]。CPR后10 min一次性脑室注射1 U胰岛素,至少可以在7 d内抑制海马CA1区神经元凋亡(如图1B所示)。
探究胰岛素抑制神经元凋亡的作用机制,动态监测胰岛素对于外源性抑制凋亡因子Caspase-3表达的影响发现,复苏组大鼠CPR后72 h Caspase-3 mRNA表达量略低于24 h,但两者比较无统计学差异,表明CPR后24 h和72 h Caspase-3 mRNA在一定水平稳定表达持续介导神经元凋亡。CPR后24 h和72 h胰岛素组Caspases-3 mRNA表达量显著低于复苏组,表明胰岛素能够抑制Caspases-3的表达,影响外源性凋亡通路,抑制神经元凋亡;胰岛素组72 h Caspases-3定量高于24 h,表明胰岛素可能延迟了Caspase-3产生高峰从另一侧面发挥抗凋亡效应;同时表明,胰岛素抗凋亡作用存在“剂量依赖效应”,随着时间的推移,脑室胰岛素代谢增加,胰岛素浓度水平降低,抑制凋亡的作用降低。由此推测,胰岛素一次性干预不足以完全阻断凋亡级联放大反应过程取得最好的疗效,持续给予胰岛素可能会收到更好的效果。
应用NDS评价胰岛素对于CPR后神经功能的影响发现,胰岛素能够改善CPR后大鼠NDS;胰岛素组神经功能评分均>60,提示大鼠预后良好。结合NDS与Caspase-3 mRNA及凋亡细胞计数相关性分析,24 h NDS评分与24 h和72 h促凋亡因子Caspase-3表达呈显著负相关,与7 d凋亡细胞计数呈显著负相关,而CPR后72 h其NDS与上述检测指标相关性降低,甚至不相关,此现象表明:①CPR后24 h Caspase-3表达越高,高峰持续时间越长,神经元凋亡越多,神经评分越低,大鼠神经功能损伤越严重[12];②胰岛素通过抑制促凋亡因子的表达,抑制神经元凋亡,改善CPR后神经功能障碍;③24 h NDS评分对于神经元凋亡程度具有一定的预测价值;超出24 h其NDS与凋亡指标的相关性降低,NDS对于凋亡的预测能力降低,因此需要探索其他方法预测凋亡。
本试验发现,脑室内注射胰岛素对于外周血糖无影响,表明胰岛素通过与中枢胰岛素受体结合启动特异的神经保护机制[13]。独立于降低应激后血糖的作用发挥神经系统的保护作用与Hui等[14]的试验结果一致。
综上所述,本试验从基因半定量、形态学及功能评分等多方面的研究表明,一次性脑室内注射胰岛素至少在7 d内能够调节CPR后抑凋亡因子Caspases-3的表达,抑制神经元凋亡,改善神经功能评分,发挥神经保护作用[15]。而胰岛素如何通过胰岛素信号转导通路调节Caspases-3的表达机制尚有待进一步研究。
[1]胡大一.推动AED任重而道远[J].临床心电学杂志,2008,17(4):244-245.
[2]Xing B1,Chen H,Zhang M,et al.Ischemic Postconditioning Inhibits Apoptosis After Focal Cerebral Ischemia/Reperfusion Injury in the Rat[J].Stroke,2008,39(8):2362-2369.
[3]Xu X1,Chua CC,Gao J,et al.Neuroprotective effect of humanin on cerebral ischemia/reperfusion injury is mediated by a PI3K/Akt pathway[J].Brain Res,2008,1227:12-18.
[4]Duarte AI,Santos P,Oliveira CR,et al.Insulin neuroprotection against oxidative stress is mediated by Akt and GSK-3βsignaling pathways and changes in protein expression[J].Biochim Biophys Acta,2008,1783(6):994-1002.
[5]Jia X,Koenig MA,Shin HC,et al.Improving neurological outcomes post-cardiac arrest in a rat model:immediate hypothermia and quantitative EEG monitoring[J].Resuscitati on,2008,76(3):431-442.
[6]Song FQ,Xie L,Chen MH.Transoesophageal cardiac pacing is effective for cardiopulmonary resuscitation in a rat of asphyxial model[J].Res uscitation,2006,69(2):263-268.
[7]Jiang JL,Peng YP,Qiu YH,et al.Effect of endogenous catecholamines on apoptosis of Con A-activated lymphocytes of rats[J].Journal of Neuroimmunology,2007,192(1-2):79-88.
[8]Teschendorf P,Vogel P,Wippel A,et al.The effect of intracerebroventricular application of the caspase-3 inhibitor zDEVD-FMK on neurological outcome and neuronal cell death after global cerebral ischaemia due to cardiac arrest in rats[J].Resuscitation,2008,78(1):85-91.
[9]Guan QH1,Pei DS,Liu XM,et al.Neuroprotection against ischemic brain injury by SP600125 via suppressing the extrinsic and intrinsic pathways of apoptosis[J].Brain research,2006,1092(1):36-46.
[10]Teschendorf P,Padosch SA,Spöhr F,et al.Time course of caspase activation in selectively vulnerable brain areas following global cerebral ischemia due to cardiac arrest in rats[J].Neuroscience Letters,2008,448(2):194-199.
[11]Suh GJ,Kwon WY,Kim KS,et al.Prolonged therapeutic hypothermia is more effective in attenuating brain apoptosis in a Swine cardiac arrest model[J].Crit Care Med,2014,42(2):e132-e142.
[12]Teschendorf P1,Vogel P,Wippel A,et al.The effect of intracerebroventricular application of the caspase-3 inhibitor zDEVD-FMK on neurological outcome and neuronal cell death after global cerebral ischaemia due to cardiac arrest in rats[J].Resuscitation,2008,78(1):85-91.
[13]Voll CL,Auer RN.Insulin attenuateds ischemic brain damage independent of its hypoglycemic effect[J].J Cereb Blood Flow Metab,1991,11(6):1006-1014.
[14]Hui L,Pei DS,Zhang QG,et al.The neuroprotection of insulin on ischemic brain injury in rat hippocampus through negative regulation of JNK signaling pathway by PI3K/Akt activation[J].Brain Res,2005,1052(1):1-9.
[15]He Q,Liu T,Zhou L,et al.[Effect of mild to moderate hypothermia on casepase-3,Bcl-2 and Bax expressions in brain tissue of rats after cardiopulmonary resuscitation][J].Nan Fang Yi Ke Da Xue Xue Bao,2013,33(10):1489-1493.