自体骨髓干细胞移植治疗足毁损伤伴重度皮肤缺损的临床研究
刘仪红,王普杰,田浩明,周毅,邓勇(绵阳市解放军第50医院糖尿病防治中心,四川绵阳6000,四川大学华西医院内分泌代谢科,泸州医学院附属医院泌尿外科)
自体骨髓干细胞移植治疗足毁损伤伴重度皮肤缺损的临床研究
刘仪红,王普杰,田浩明1,周毅,邓勇2
(绵阳市解放军第520医院糖尿病防治中心,四川绵阳621000,1四川大学华西医院内分泌代谢科,2泸州医学院附属医院泌尿外科)
目的:评价自体骨髓间充质干细胞(mesenchymalstem cells,MSCs)移植治疗对足毁损伤伴皮肤缺损临床疗效及观察有无移植相关排异反应和成瘤性。方法:确诊的2型糖尿病患者车祸后右足毁损伤伴重度皮肤缺损患者1例,将自体MSCs混悬液注射移植到该患者的足部缺损伤口,术后实时跟踪伤口恢复情况,并随访34个月观察干细胞移植后致瘤性和修复后的皮肤组织学变化。结果:患者在采用外科常规治疗及缺损创面进行了两次自体皮肤移植等治疗64 d无效后,即给予足部皮肤缺损处先后两次行自体MSCs移植术,术后第3 d开始,患者右足疼痛、冷感和麻木感开始好转,皮肤缺损处脓性分泌物开始减少,局部肿胀开始消退,伤口逐渐缩小,第二次术后第36 d伤口痊愈。未出现任何并发症和不良反应。34个月后随访发现,接受MSCs移植的足底局部情况稳定,无移植相关的免疫排斥等并发症的发生。同时手术切取已愈合伤口的局部皮肤组织,行病理切片检查发现,与正常皮肤组织病理上无显著差异,且无成瘤迹象。结论:采用自体MSCs移植治疗糖尿病足毁损伤伴皮肤缺损的临床疗效显著且相对安全,该疗法对糖尿病术后及各种外伤所致皮肤缺损的治疗提供现实依据和临床参考。
骨髓间充质干细胞;自体移植;足毁损伤;皮肤缺损;成瘤性
近年来,随着细胞组织工程学(tissueengineering,TE)的发展,利用骨髓间充质干细胞MSCs的种种优点,用于细胞治疗、基因治疗以及组织工程的细胞源已成为目前研究的热点之一[1-2]。2002年,Inaba等[3]和TateishiYuyama等[4]在国际上率先报道了应用骨髓造血干细胞移植治疗周围血管病。目前,动物实验表明自体骨髓单个核细胞植入缺血的肢体可分化成血管内皮细胞,而促使局部血管形成,均提示了干细胞移植可以用于治疗糖尿病肢体缺血性疾病及皮肤严重缺损[5-7]。
我们于2011年1月25日起,先后两次为糖尿病患者车祸后致右足毁损伤伴皮肤缺损实施了自体MSCs移植术,术后对临床疗效、有无移植相关排异反应及成瘤性等并发症方面进行全面的临床观察和研究。现报道如下。
1 材料和方法
1.1 患者基本情况
患者男,59岁,工人,因车祸致右足毁损伤3 h于2010年11月22日以“右足毁损伤”收入我院手足外科住院治疗。10年前,在地方医院确诊为“糖尿病”,并长期服用降糖药物,血糖控制不佳。体格检查:生命体征平稳。神志清楚,精神欠佳,急性痛苦病容,被动体位,查体欠合作。心肺腹部均未见异常。专科情况:右足可见皮肤挫伤创面约10.0 cm×15.0 cm(见图1,A),右足背皮肤撕脱,可见大量断裂的血管神经肌腱,第一楔骨脱位外露,创面挫伤污染严重,足背动脉搏动消失,远端各趾皮色苍白、无血运。初步诊断:右足血管神经肌腱断裂;右足背、足底皮肤大面积缺损;右足第一楔骨骨折并脱位;右下肢皮肤大面积挫伤;2型糖尿病。入院后立即急诊在硬膜外麻醉下行“清创探查血管神经肌腱修复术、骨折内固定术”,并先后两次行“自体皮肤移植术”,但术后出现移植皮肤坏死并伴大量脓性渗出物及腥臭味,创面肉芽组织生长缓慢。经过全院专家会诊后认为,建议实施右足截肢术,但患者本人不同意而自愿选择自体干细胞移植术。因此,在我院伦理委员会讨论通过及患者签订知情同意书后,于2011年1月25日及2011年2月11日,先后2次为患者行自体干细胞移植术。术后第3 d开始,患者右足疼痛、冷感和麻木感开始好转,皮肤缺损处脓性分泌物开始减少,局部肿胀开始消退,伤口逐渐缩小,第2次术后第36 d伤口痊愈出院。移植术治疗前后,患者血糖控制基本达标(见表1)。
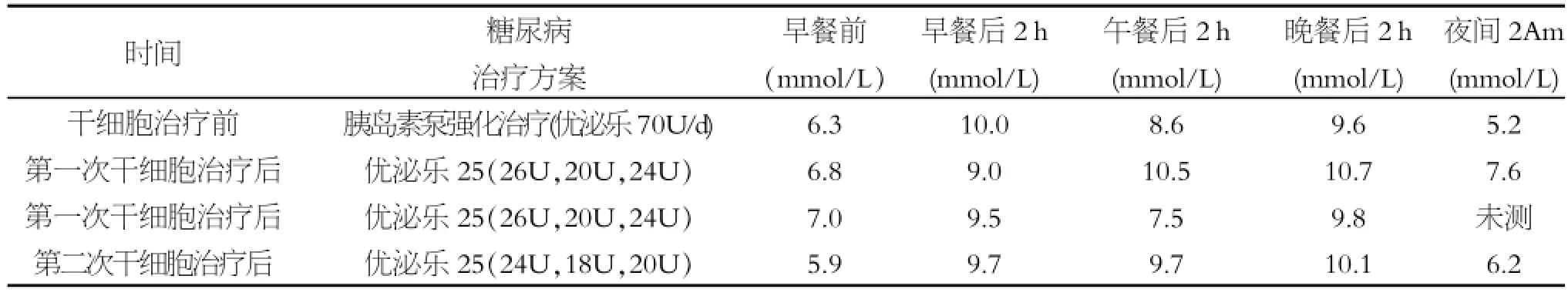
表1 自体骨髓干细胞移植治疗前后糖尿病治疗方案及血糖监测表
1.2 试剂
淋巴细胞分离液购自上海前尘生物科技有限公司;二甲苯,苏木精伊红染液购自上海源叶生物科技有限公司;DMEM完全培养基购自Invitrogen公司;青链霉素购自南京凯基生物发展有限公司;胎牛血清购自Gibco公司。
1.3 自体骨髓采集
患者完成术前检查后,在手术当天晨禁食水,在手术室取俯卧位,常规消毒铺巾,准备好血袋和保养液,局麻下取两侧髂后上棘为采髓部位,沿髂骨上缘外侧每隔1cm为一个皮肤进针点进行骨髓采集,每点每次抽吸骨髓10ml,共采集骨髓约50m l。
1.4 骨髓间充质干细胞分离
在无菌超净台上将采集的骨髓用2倍量的生理盐水稀释,吸取稀释液小心加在淋巴细胞分离液上(两者比例为2∶1)。室温下离心20min,离心速度为1800~2000 r/min。小心吸取离心管中白膜层,转移至洁净离心管中,离心速度为1500 r/min,离心时间10 min。分离出单个核细胞后在体外扩增14 d后传至第3代,沉淀物用30ml生理盐水稀释成适用浓度的干细胞悬液,取1μl稀释后于显微镜下观察形态和细胞计数为6×106/m l以备用。
1.5 自体骨髓间充质干细胞移植
在手术室严格无菌条件下操作,在硬膜外麻醉下,首先将患者右足底及足背皮肤缺损处常规清创后,将MSCs干细胞混悬液一次性注射在缺损创面,术后用无菌纱布及绷带保护创面。
1.6 伤口恢复观察
患者足部皮肤缺损部位的术前创面和术后恢复情况用数码相机拍照记录,同时观察患者有无移植排异反应和手部炎症肿胀情况。
1.7 HE染色
移植术后30个月,手术取右足局部已痊愈的皮肤组织,大小约0.5 cm×0.2 cm,经4%多聚甲醛固定过夜。乙醇梯度脱水后进行石蜡包埋。切片后二甲苯脱蜡透明,并重新水化。切片由苏木素伊红顺次染色。封片并显微观察皮肤病理变化。
2 结果
2.1 症状和体征
移植后第3 d天开始,患者即感觉右足疼痛、冷感和麻木感开始好转,局部脓性分泌物明显减少,局部肿胀开始减轻,局部缺血状况也逐渐改善,缺损面逐渐缩小。
2.2 感染伤口愈合情况
第一次移植术后第3 d观察发现,右足底皮肤缺损伤口处脓性分泌物开始减少,肿胀有所减轻(见图1,B),第9d后伤口大小由原来的10.0cm×15.0cm逐渐缩小成9.0 cm×13.0 cm,局部缺血状况也逐渐改善;第二次移植术后第3 d观察发现,局部伤口脓性分泌物明显减少,肿胀减轻,伤口大小缩小成7.0 cm×11.0 cm(见图1,C),第7 d局部伤口表面无脓性分泌物渗出,可见新生肉芽组织形成,伤口缩小成7.0 cm×10.0 cm(见图1,D),第二次移植术后第36 d,伤口痊愈(见图1,E)。
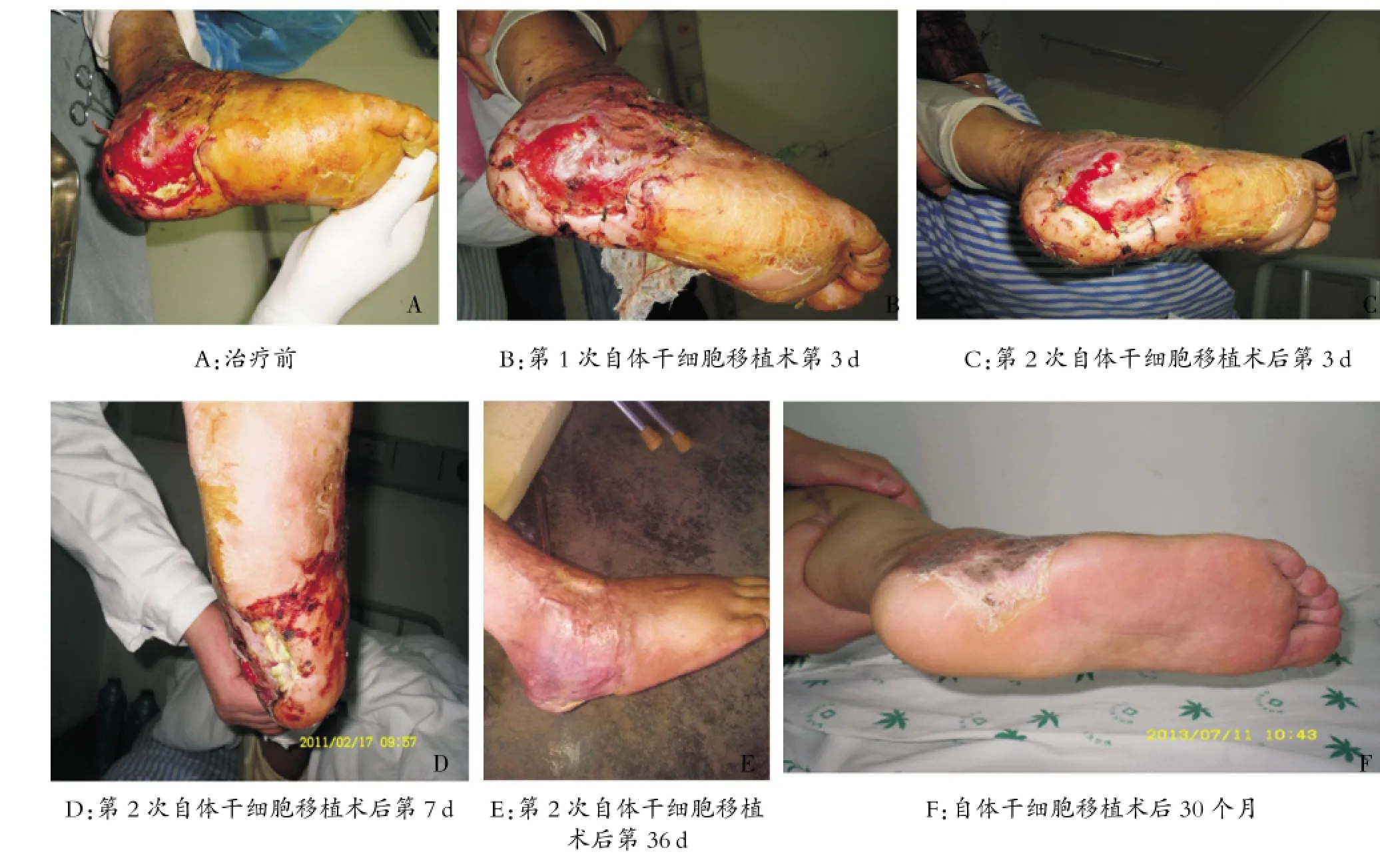
图1 右足自体骨髓干细胞移植术前后伤口愈合情况
2.3 相关并发症
患者骨髓干细胞移植后骨髓穿刺点伤口很快愈合,无异常症状或体征出现;血、小便、大便三大常规及肝、肾功能等生化检查均未见异常。
2.4 组织学观察新生皮肤
该患者30个月后再次来我院门诊随访复查发现,接受骨髓干细胞移植的右足局部情况稳定,无移植相关的免疫排斥等并发症的发生(见图1,F)。同时手术切取了已愈合伤口的局部全层皮肤组织一块,大小为0.5 cm×0.2 cm,并行病理切片HE染色检查。结果发现,表皮轻度增生伴角化过度,局灶区基底细胞色素增加,真皮浅层胶原纤维增生、变性和小血管周围少量淋巴细胞浸润。但与正常皮肤组织在病理上无显著差异,且无肿瘤迹象(见图2)。
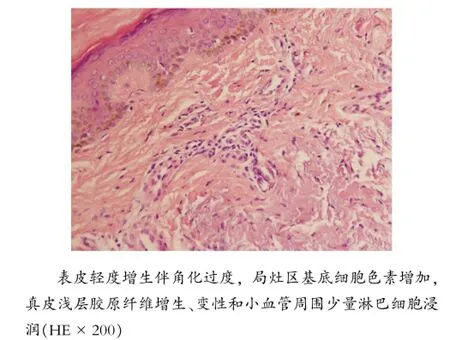
图2 右足干细胞移植术后痊愈皮肤局部病理切片(术后30个月)
3 讨论
大量的动物实验证实,利用MSCs作为种子细胞构建组织工程皮肤对皮肤缺损具有显著促愈作用,创面经修复后具有全层皮肤结构[8-10]。方利君等[11]通过动物实验的研究,发现创面愈合过程中,MSCs与肉芽组织中小血管的形成密切相关。因此在创面微环境下,MSCs可分化为血管内皮细胞,并参与皮肤缺损创面的修复。研究表明,MSCs可分化成血管内皮细胞并应用于治疗缺血性疾病[12-15]。Rathnavelpandian S等[16]等利用单个核细胞治疗了6例糖尿病严重肢体缺血及皮肤缺损,临床效果显著,接受自体干细胞移植的患者全部避免了截肢。
本例系一例糖尿病患者车祸后右足毁损伤致伤口严重感染伴皮肤重度缺损,伤口局部出现明显血运不良及顽固性伤口不愈合等,入院后经常规胰岛素泵强化治疗、抗感染及伤口局部清创换药等综合治疗64 d余,病情未见好转,但采用自体MSCs移植治疗72 h后患者即感觉右足疼痛、冷感和麻木感开始好转,局部肿胀也开始消退,感染伤口脓性分泌物明显减少,伤口面积逐渐缩小,直至完全愈合,临床疗效较显著,并且避免了截肢。但由于目前有不少学者质疑[17-19],MSCs移植到体内会不会使得细胞产生多种形式的基因突变,会不会如肿瘤细胞一样无限增殖和生长,甚至引发肿瘤的形成等安全性方面的担忧。然而,据专家们预测人类诱导多能干细胞(human induced pluripotentstem cells,IPSC)其潜在的致瘤性等于或高于胚胎干细胞。因此,基于以上种种对干细胞成瘤性的担忧,我们针对该患者进行了进一步的随访观察和临床研究。在患者出院30个月后,再次联系到我院门诊随访复查,结果发现接受自体MSCs移植的右足已痊愈的伤口局部情况稳定(见图1,F),无移植常见的免疫排斥等并发症的发生,同时取已愈合伤口的局部行全层皮肤组织病理切片检查发现,与正常皮肤组织在病理上无明显差异,且无肿瘤的形成(见图2)。因此,在临床采用自体MSCs体外扩增移植疗法可能成为一种简便、有效的治疗严重皮肤缺损的新手段、新策略,同时也可以解决创伤后皮肤重度缺损伤口的严重感染及局部血运不佳等问题,且无移植相关排斥反应及肿瘤形成等,从而达到治疗的目的。另外,本研究还可以为在临床上应用自体MSCs移植技术治疗各种外伤所致皮肤缺损提供一条新的治疗路径。
我们认为,今后在临床上开展自体MSCs移植治疗各种外伤所致皮肤缺损的临床试验的方法学还有待于提高,应当进行高质量的多中心、随机、双盲对照试验,以进一步证实这种新的治疗方法的临床疗效。目前MSCs的分化机制和诱导条件及其治疗皮肤缺损确切的机制方面尚不清楚,但推测其可能的机制[11]为,在创面微环境中MSCs可分化为血管内皮细胞而参与创面修复,促进新生血管的形成,此外,MSCs在移植局部被诱导分化为内皮细胞,并在局部释放多种细胞因子以及信号的传导等相关问题,都还有待于我们通过动物实验及基础研究得到进一步的证实。此外,对自体MSCs移植相关的免疫排异反应、成瘤性及远期疗效等方面做进一步更加严密的科学观察和临床研究还是很有必要的。
1.Gu YQ.Determ ination of amputation level in is chaem ic low er limbs[J].ANZJSurg,2004,74(1~2):31~33.
2.Yamamoto K,Kondo T,SuzukiS,et al.M olecular evaluation ofendo thelialprogenitor cellsin patientswith ischem ic limbs:therapeuticeffect by stem cell transplantation[J].A R terioscler Thromb Vasc Biol,2004,24(12):192~196.
3.Inaba S,Egashira K,Komori K,et al.Peripheral-blood or bonemarrow mononuclear cells for therapeutic angiogenesis [J].Lancet,2002,360(9350):2083.
4.Tateishi-Yuyama E,Matsubara H,Murohara T,et al. Therapeutic angiogenesisforpatientsw ith limb is chaemia by autologous transp lantation of bone-marrow cells:a pilot study and a random ized controlled trial[J].Lancet,2002,360(9331):427~435.
5.Hershey JC,Baskin EP,Glass JD,etal.Revascularization in the rabbithindlimb:dissociation between capillary sprouting and arteriogenesis[J].Cardiovasc Res.2001,49:618~625.
6.HeilM,Ziegelhoeffer T,M eesB,etal.A different outlook on the role of bonemarrow stem cells in vascular grow th: bonemarrow deliverssoftwarenothardware[J].Circ Res,2004,94:573~574.
7.ChappellDC,VarnerSE,Nerem RM,etal.Oscillatory shear stressstimulatesadhesionmoleculeexpression in cultured human endothelium[J].CircRes,1998,82:532~539.
8.Bickenbach JR,Chism E.Selection and extended grow th of murineepidermalstem cellsin culture[J].ExpCellRes,1998,244:184~195.
9.Oshima H,Rochat A,Kedzia C,et al.M orphogenesisand renewalofhair follicle from adultmultipotent stem cells[J]. Cell,2001,104:233~245.
10.TaylorG,LehrerMS,Jensen PJ,etal.Involvementof follicular stem cells in form ing not only the follicle but also the epiderm is[J].Cell,2000,102:451~461.
11.Fang LiJun,Fu Xiao-bing,Sun Tong-zhu,etal.Anexperimentalstudy on the differentiatio n of bonemar row mesenchymalstem cellsinto vascularendothelial cells[J].Chin J Burns,February2003;19(1):22~24.
12.Bjornson CR,Rietze RL,Reynolds BA,etal.Turning brain into blood:ahematopoietic fateadopted by adultneuralstem cellsin vivo[J].Science1999;283:534~537.
13.Mezey E,ChandrossKJ,HartaG,etal.Turning blood into brain:cellsbearingneuronalantigensgenerated in vivo from bonemarrow[J].Science,2000,290:1779~1782.
14.AsaharaT,MuroharaT,Sullivan A,etal.Isolation ofputative progenitorendothelialcellsforangiogenes[J].Science,1997, 275(5302):964~967.
15.Isner JM,Asahara T.Angiogenesisand vasculaogenes isas therapeuticsstrategies for postnatalneovascularization[J].J Clin Invest,1999,103(9):1231~1236.
16.Rathnavelpandian S,Joseph A,Rajendran S,etal.Application ofautologousbonemarrow mononuclear cellsin six patientsw ith advanced chronic critical limb ischem iaasa result of diabetes:our experience[J].Cytotherapy,2011,13:993~999.
17.YamanakaS.Strategiesand new developmentsin thegeneration ofpatient-specific pluripotentstem cells[J].CellStem Cell,2007,1:39~49.
18.W ang Y,Huso DL,Harrington J,etal.Outgrow th ofa transformed cell population derived from normal human BM mesenchymalstem cell culture[J].Cytotherapy,2005,7(6): 509~519.
19.Chen Y,Shi L,Zhang L,etal.Themolecularmechanism governing theoncogenic potentialofSOX2 in breast cancer [J].JBiolChem,2008,283:17969~17978.
(2013-12-02收稿)
Bone-m arrow stem cellautotransp lantation treating one caseof footdestructive injuryw ith severeskin defect
Liu Yihong,Wang Pujie,Tian Haoming1,Zhou Yi,Deng Yong2
Diabetic Centre of Control and Prevention,the PLA 520 Hospital;1Department of Endocrinology and Metabolism,WestChina Hospitalof Sichuan University;2DepartmentofUrological Surgery,the Affiliated Hospitalof LuzhouMedicalCollege
Objective:Toevaluate thecurativeeffectof autotransplantation ofmesenchymalstem cells(MSCs)on foot destructive injury with infection and severe skin defectand to observe if there were rejection and tumorigenic change.Methods:A patientwith foot destructive injury,and a ten-year history of type 2 diabetes,after in effective routine therapy and twice skin grafting was treated with MSCs autotransplantation.MSCs were harvested from the patient'sbonemarrow.The autologousMSC suspensionwas twice injected into the skin defectof foot after theblood glucose levelbeing stabilized.The patientwas followed up.Results:36 daysafter the second autotransplantation,the skin defect healed.During 34 month postoperative follow-up,the patient showed immediate recovery with no transplant-related complications,or tumorigenic changes.Conclusion:The transplantation of autologous MSCs is effective in the clinical treatmentofskin defecteitherafter surgery ofdiabetic patientsor resulted from other various traumas.
Stem cells;Autotransplantation;Destructive injuryof foot;Skin defect;Tumorigenic change
R658
A
10.3969/j.issn.1000-2669.2014.02.017
刘仪红(1970-),女,主任医师,E-mail:lyh9504@126.com

