大豆蛋白酶解过程中聚集行为的研究
赵沙沙 孔祥珍 苏 芮 华欲飞
(江南大学食品学院食品科学与技术国家重点实验室,无锡 214122)
大豆以及大豆产品如豆浆、豆腐等具有丰富的营养价值。大豆中的蛋白质主要包括储藏蛋白和生理活性蛋白,其中储藏蛋白中约65%为大豆球蛋白(glycinin),35%为 β-伴球蛋白(β-conglycinin)[1],根据其沉降系数分别又称作11S和7S。11S分子质量为340~375 ku,主要由酸性亚基(A1、A2、A3、A4、A5和 A6)和碱性亚基(B1、B2、B3、B4、B5和B6)通过二硫键连接形成(A4酸性亚基除外)。7S分子质量为180~210 ku,主要由α、α'和β 3种亚基组成[2]。
对大豆蛋白进行酶水解是一种提高其功能性质的有效方法。水解后可以提高大豆蛋白的溶解性、乳化性、起泡性[3]。但是另一方面,水解却带来了一个弊端,即在水解过程中会形成不溶性聚集体,使得大豆蛋白的水溶性降低,从而降低了得率。目前,大豆分离蛋白、大豆球蛋白酶解过程的聚集现象研究已较多,对于酶解过程中聚集机理研究也较为透彻[4-6]。但是,在酶解过程中大豆球蛋白以及β-伴球蛋白各自所起的作用以及β-伴球蛋白对大豆球蛋白酶解过程的聚集的影响却鲜有报道。Kuipers等[7]对大豆蛋白的酶解聚集方面进行了研究,即制备不同水解度的酶解物,研究酶解物在不同pH下的溶解情况,以期获得7S、11S酶解物对聚集的作用。
本研究在Kuipers等[7]的研究基础上,从另一角度出发,主要通过监测酶解液的浊度变化研究不同大豆蛋白(7S、11S、SPI即大豆分离蛋白)在酶解过程中的聚集现象,通过与模拟浊度值比较更直观地获得7S/11S不同比例的蛋白在酶解过程中的聚集行为,并采用液相色谱法以及电泳技术探究酶解过程中7S和11S酶解物对聚集的贡献,并以此初步探究酶解过程中7S酶解物对11S酶解物聚集的抑制机理。
1 材料与方法
1.1 材料
脱脂豆粕:山东万德福有限公司;碱性蛋白酶(Alcalase):诺维信生物技术有限公司;苯甲基磺酰氟(PMSF):生工生物工程(上海)股份有限公司;乙腈,色谱纯:国药;其余试剂均为分析纯。
1.2 仪器及设备
高效液相仪、LGJ-10高速冷冻离心机:日本日立公司;LGJ型冷冻干燥机:北京四环科学仪器厂;DYY-8C电泳仪:北京六一仪器厂;GX-2005循环水浴锅:上海比朗仪器有限公司;868型pH计:上海热电仪器公司。
1.3 试验方法
1.3.1 大豆蛋白的制备
大豆蛋白的提取采用Nagano等[8]法并稍作改良。醇洗脱脂豆粕按1∶10的料液比加入去离子水,充分溶解后,用2 mol/L NaOH溶液调节至7.0,室温下低速搅拌1 h,以10 000 r/min,4℃下离心30 min,弃去沉淀,上清液用2 mol/L HCl溶液调节至4.5,以10 000 r/min,4℃下离心30 min,弃去上清液,得到的蛋白质凝乳使用大体积去离子水洗3次除去残留的盐离子。得到的凝乳加入少量去离子水并用2 mol/L NaOH将溶液回调至7.0,经搅拌充分溶解后,溶液在10 000 r/min离心30 min以弃去少量不溶物质,上清液经冷冻干燥,干燥的大豆分离蛋白在4℃条件下保存。11S的提取过程与SPI的提取方法类似,具体步骤见图1。
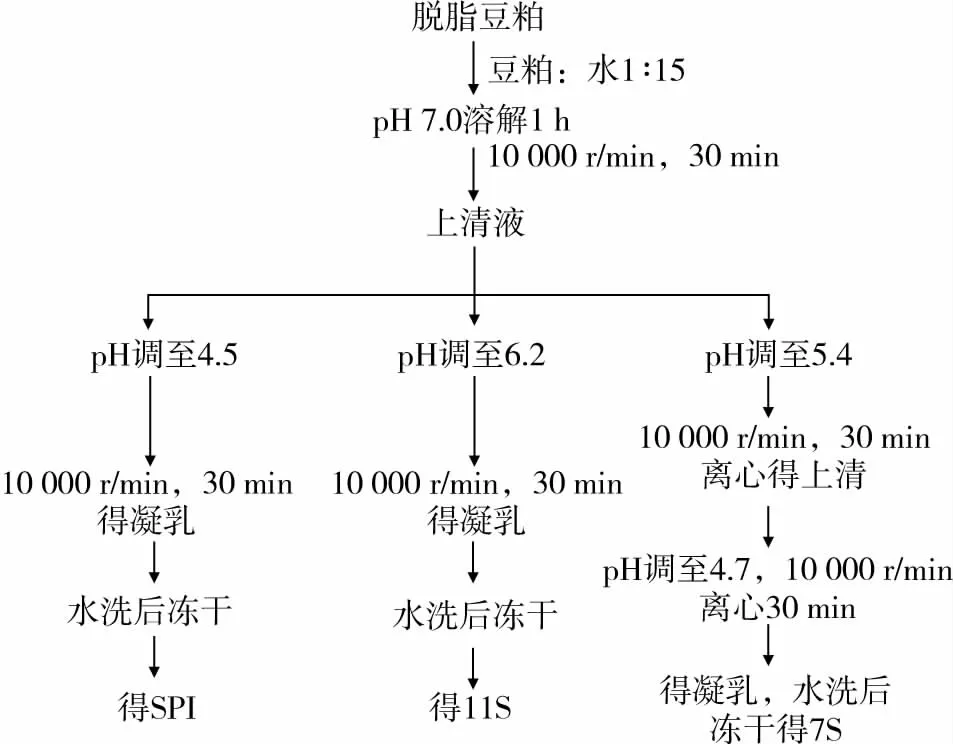
图1 大豆蛋白(SPI、11S、7S)的提取工艺流程图
1.3.2 Alcalase 水解大豆蛋白
大豆蛋白10%溶于pH 8.0的去离子水中,常温下搅拌2 h,充分溶解后于19 000 r/min离心30 min以除去少量不溶性物质。离心后取上清液,凯氏定氮测定溶液中蛋白浓度,此溶液为母液,每次酶解前均需新鲜配制。将此溶液准确稀释至蛋白浓度为2%,置于200 mL的酶解器中,于60℃预热搅拌10 min,加入Alcalase进行酶解。其中,底物与酶的比例为100∶1。酶解至一定水解度后,加入酶抑制剂PMSF,使其终浓度为1 mmol/L,终止反应。取酶解液于19 000 r/min离心30 min,以获得水溶性成分和水不溶性成分,其中水不溶性成分即为酶解过程中产生的聚集体。
1.3.3 水解度的测定

水解度的测定采用pH-stat法[9]。水解过程中逐渐滴加0.1 mol/L的NaOH以维持Alcalase的最适pH 8.0。其中水解度(DH)的计算公式为:式中:B为NaOH的体积/mL;Nb为NaOH的浓度,0.1 mol/L;1/α为α-氨基的平均解离度(60℃,pH 8.0条件下为1.08);Mp为溶液中蛋白质的质量/g;htot为底物中肽键的含量/meqv/g蛋白。
1.3.4 浊度的测定
酶解液的浊度变化采用分光光度计监控。用spectrumlab22PC分光光度计在室温下操作,载样的比色皿为厚度1 mm的玻璃比色皿。每隔一段时间取出一定量的酶解液于660 nm下测定溶液的吸光度。
1.3.5 聚集物干物质产率的测定
当水解结束后,加入PMSF终止反应。取出一定量溶液,准确称其质量,记为m1,置于105℃烘箱中烘干,恒重后称其质量为m2;另取一部分溶液,准确称其质量为m3,并于19 000 r/min离心30 min,弃去上清,得沉淀于105℃烘箱恒重至m4。聚集物占总蛋白干基的比率计算公式为:

1.3.6 高效液相测定酶解液分子质量分布
采用高效液相色谱法(HPLC)测定酶解后水溶性成分和水不溶性聚集体的分子质量分布。上清液溶于纯水中,水不溶性成分溶于8 mol/L盐酸胍或30 mmol/L DTT中,样品浓度均为10 mg/mL。色谱柱:TSKgel2 000SWXL 300 mm × 7.8 mm(Tosoh,Tokyo,Japan);流动相:乙腈/水/三氟乙酸,45/55/0.1;检测波长:UV(220 nm);流速:0.5 mL/min;柱温:30℃;分子质量校正曲线所用标准品:细胞色素C(MW 12 500 u),抑菌肽(MW 6 500 u),杆菌肽(MW 1 450 u),Gly-Gly-Arg-Tyr(MW 451 u),Gly-Gly-Gly(MW 189 u)。
1.3.7 SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析
SDS-PAGE凝胶电泳法参照Laemmli法[10]。分离胶和浓缩胶浓度分别为12.5%和4%,恒流电泳,电流先调至10 mA,待样品进入浓缩胶后调至30 mA。样品为不同水解度的上清液和水不溶性聚集体。
2 结果与讨论
2.1 不同大豆蛋白Alcalase酶解液聚集的观察
溶液在可见光范围内的吸光度可以作为样品溶液中颗粒大小和浓度的测定指标[11],因此,测定大豆蛋白溶液酶解过程中的吸光度,可以动态地跟踪水解过程蛋白质及聚集物的浓度和大小的变化趋势。11S、SPI以及7S使用Alcalase进行酶解,底物浓度均为2%,底物与酶的比例为100∶1。由图2可以看出,在相同蛋白浓度下使用Alcalase进行酶解时,11S的浊度增加要比7S、SPI剧烈,11S酶解液的浊度在较短时间内(18 min)就达到了最大值,达到最大值之后浊度缓慢减小。浊度的变化说明酶解过程可以分为2个阶段:第1阶段为浊度上升的阶段,在这一阶段小分子肽段的聚集要快于酶对蛋白和聚集体的降解,可以认为酶对蛋白的降解是这一阶段的限速反应;第2阶段为浊度下降的阶段,在这一阶段酶对蛋白和聚集体的降解快于肽的聚集,从而导致了浊度的下降。
与11S相比,SPI的聚集程度明显降低,而且聚集开始的时间(第55 min)也比11S延迟很多,从浊度开始上升到最大值出现所用的时间也较11S长。而7S的浊度自始至终(2 h内)都没有明显变化,这说明在2 h的酶解过程中,7S酶解物并没有出现聚集现象。比较三者可以得出,在蛋白浓度相同时,11S的Alcalase酶解物更易发生聚集,而且聚集物的产量也较大,但聚集产物并不稳定,易于降解,SPI酶解过程中出现了轻微的聚集现象,而7S酶解物基本不会发生聚集。
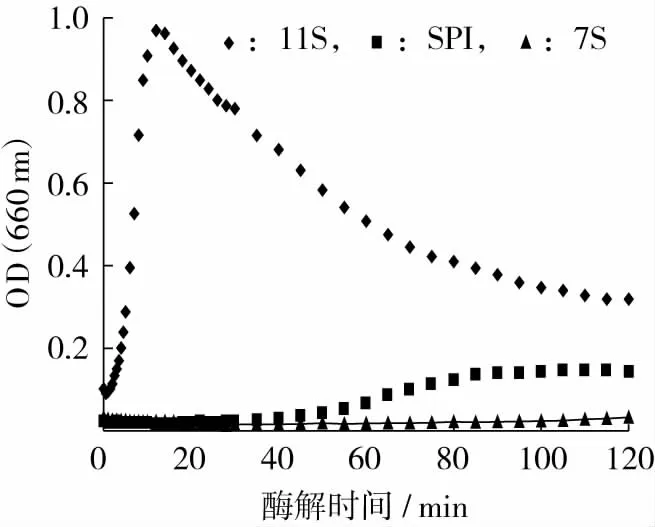
图2 不同蛋白Alcalase酶解时浊度变化曲线
2.2 不同11S/7S比例对聚集的影响
基于图2中11S与7S酶解液浊度随酶解时间的变化结果,模拟11S/7S不同比例的蛋白混合物的浊度随酶解时间的变化情况(图3)。所模拟的11S/7S的比例分别为 50∶1、25∶1、10∶1、5∶1 以及 1.76∶1。其中当11S/7S为1.76:1时与SPI中11S/7S比例相当。由图3可以看出,随着7S比例的增大,相同时刻的浊度值逐渐减小。
同时,对不同比例的11S/7S蛋白,采用Alcalase进行酶解,并对酶解物的浊度随酶解时间的变化进行了试验测定,结果如图4所示。试验通过固定11S的浓度和酶解溶液的体积,添加不同量的7S来完成。由于添加不同量的7S,导致总蛋白浓度发生了变化,但是7S的浓度始终未达到2%。由图2可以看出,当7S浓度为2%时,酶解时间在2 h之内均未出现聚集现象。由此可以忽略总蛋白浓度的变化对聚集的影响。随着蛋白混合物中7S比例的增大,相同酶解时刻的浊度呈现逐渐减小的趋势,并且浊度最大值出现的时间点随7S/11S比例的增大而增大。假定7S与11S混合后,其酶解互不影响,那么酶解物浊度值随酶解时间的变化应该如图3所示。但结合图4的结果分析比较可知,不同比例7S和11S混合后酶解,酶解液实际的浊度测定结果要小于理论模拟值,并且浊度最大值出现的时间较模拟值推迟。这说明7S和11S混合酶解后,浊度的变化不单单是由于二者比例的变化从而造成浊度的下降,最主要的原因是由于添加7S与11S混合酶解,对酶解物的聚集产生了抑制。

图3 11S/7S不同比例下浊度模拟图
大豆分离蛋白中含有较高含量(约65%)的11S蛋白,在其酶解时发生的聚集程度较大,更容易发生聚集。若大豆蛋白中7S蛋白含量增大,整体蛋白的聚集现象减弱。在11S浓度不变的情况下,通过添加不同量的7S对11S酶解过程中肽的聚集有影响,即7S酶解物对11S酶解物聚集有一定的抑制作用,而且随着7S添加量的增大,其抑制作用更为明显。

图4 不同比例11S/7S酶解过程中浊度变化曲线
定义浊度最大值时的吸光度为OD1,吸光值稳定时的浊度为OD2。则ΔOD=OD1-OD2,ΔOD可以作为聚集物产量的一个指标。由表1可以看出,随着11S/7S比例的逐渐减小,OD1与OD2之间的差距即ΔOD逐渐缩小,这说明在酶解过程中的聚集体的产量随7S添加量的增加而减小。而且,随着11S/7S比例的减小,OD2呈现先减小后增大的趋势,这说明7S对11S酶解物的聚集有一定的抑制作用,并且对聚集物的稳定性有一定的作用。11S/7S为1.76的浊度曲线与SPI的浊度曲线对比可以发现,相同时刻混合样品(11S/7S=1.76)的浊度值要大于SPI的浊度值。

表1 不同11S/7S比例的OD值(660 nm)
2.3 聚集物产量的表征
对DH=5时不同比例的11S/7S酶解后不溶性聚集物的产量进行了测量。聚集物占总蛋白的比例见图5。由图5可以看出随着11S/7S比例的减小,聚集物占总蛋白的比例也逐渐减小,这说明7S酶解产物对11S酶解产物的聚集有抑制作用,这与浊度检测的结果是一致的。

图5 不同比例11S/7S在DH=5聚集物产量占总蛋白的比(干基)
2.4 不同比例11S/7S水解产物的HP-SEC图谱分析
采用HP-SEC对不同比例的11S/7S在DH=5时制备的酶解物上清液和不溶性聚集体的分子质量进行表征,结果如表2~表4所示。其中上清液使用超纯水溶解,样品可以完全溶解。水不溶性聚集体使用8 mol/L盐酸胍溶液可以完全溶解,使用30 mmol/LDTT不能完全溶解。由表2和表3对比可以看出,上清液中分子质量分布主要集中于大于10 000 u以及5 000 u以下部分,而沉淀中组分的分子质量主要集中于5 000 u以下。这说明上清液中既有大分子质量的组分,也有小分子质量的成分。而沉淀主要是一些小分子质量的组分,这说明在酶解过程中形成聚集体主要是一些分子质量较小的肽段。这与于鸿鹏等[12]的结论相符。沉淀中可以溶于30 mmol/L DTT溶液中的成分的分子质量主要分布于5 000 u以下,约占90%。这说明DTT处理沉淀可以得到一些小分子质量且可溶于水的亲水性肽段。这些小肽以二硫键连接的形式结合在聚集体上。

表2 不同比例11S/7S上清液分子质量分布/%

表3 不同比例11S/7S酶解不溶性聚集物分子质量分布/%
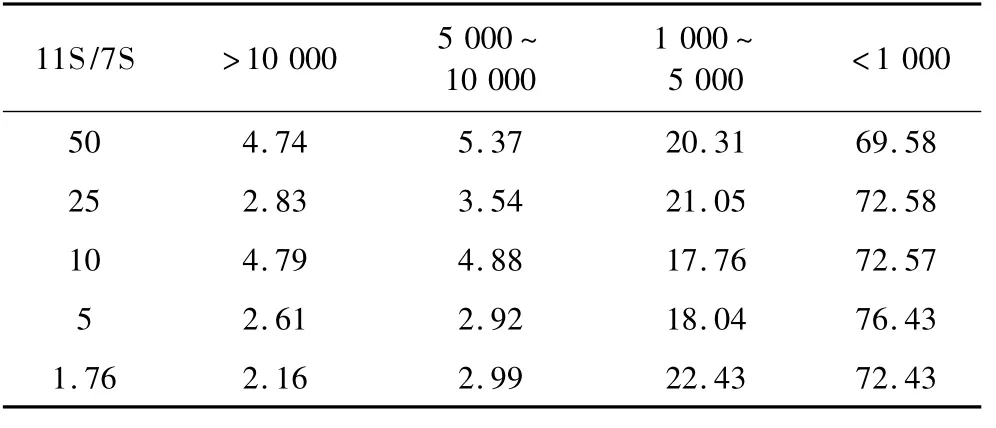
表4 DTT处理不同比例11S/7S不溶性聚集物分子质量分布/%
2.5 SDS-PAGE分析
不同比例的11S/7S酶解后进行离心,得到的上清液进行SDS-PAGE。图6a中的条带1是AB肽链聚合体,条带2可能是酶解过程中产生的可溶性聚合体,条带3为A5B3聚合体。区域1是在酶解过程中形成的一些小分子质量肽段,与还原后的SDSPAGE(图6b)相比,区域1基本消失,说明这些肽段含有二硫键,还原后形成了一些分子质量更小的片段。由图6b可以看出,7S的α'与α亚基已被完全降解,而β亚基仍有残留,这说明β亚基不易被Alcalase降解。11S的A肽链有少许残留,B肽链仍有较多的残留。

图6 上清液SDS-PAGE图
3 结论
本研究表明,大豆中的7S、11S、SPI蛋白在使用Alcalase进行酶解时,产生的聚集现象不同。其中11S酶解物最易发生聚集,而SPI酶解物稍有聚集现象,但不明显,而7S在酶解时基本不会有聚集现象发生。在改变7S与11S的比例进行酶解时发现,固定11S的浓度不变,随着7S添加量的增大11S酶解物聚集现象有所减小,这说明7S酶解物对11S酶解物的聚集有抑制作用,而抑制的机理还需进一步探究。
[1]Liu C,Wang X S,Ma H,et al.Functional properties of protein isolates from soybeans stored under various conditions [J].Food Chemistry,2008,111(1):29 -37
[2]Remkema J M S,Knabben J H M,Vliet T V.GEL formation by β - conglycinin and glycinin and their mixtures[J].Food Hydrocolloids,2001,15(4 -6):407 -415
[3]Panyam D,Kilar A.Enhancing the functionality of food proteins by enzymatic modification [J].Trends in Food Science& Tchnology,1996,7(4):120 -125
[4]Nagai K,Inouye K.Insights into the reaction mechanism of the coagulation of soy protein isolates induced by subtilisin carlsberg[J].Journal of Agricultural and Food Chemistry,2004,52:4921 -4927
[5]Inouye K,Nagai K,Takita T.Coagulation of soy protein isolates induced by subtilisin carlsberg[J].Journal of Agricultural and Food Chemistry,2002,50:1237 -1242
[6]Kuipers Bas J H,Harry G.Identification of strong aggregating regions in soy glycinin upon enzymatic hydrolysis[J].Journal of Agricultural and Food Chemistry,2008,56:3818 -3827
[7]Kuipers Bas J H,Gerrit A,Arno C,et al.Opposite contributions of glycinin and β-conglycinin derived peptides to the aggregation behavior of soy protein isolate hydrolysates[J].Food Biophysics,2006(1):178 -188
[8]Nagano T,Motoyoshiya J,Kakehi A,et al.Dynamic viscoelastic study on the gelation of 7S globulin from soybeans[J].Journal of Agricultual and Food Chemistry,1992,40(6):941-944
[9]Adler- Nissen J.Enzymic hydrolysis of food proteins[M].London:Elsevier Applied Science Publishers,1986,122 -123
[10]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage[J].Nature,1970,227:680-685
[11]Berne B J.Interpretation of the light scattering from long rods[J].Journal of Molecular Biology,1974,89:755 - 758
[12]于鸿鹏,唐传核,曾庆孝,等.大豆分离蛋白水解多肽聚集物的组成及相互作用[J].华南理工大学学报,2006,34(8):105-109.

