谷氨酰胺转氨酶对小麦蛋白凝胶性的影响研究
董建云 钟昔阳 罗水忠 蔡 静 姜绍通 郑 志
(安徽省农产品精深加工重点实验室合肥工业大学生物与食品工程学院,合肥 230009)
小麦蛋白(俗称谷朊粉)是小麦淀粉加工的副产物,其蛋白质质量分数达72%~85%,是营养丰富、物美价廉的纯天然植物性蛋白源[1]。在食品中小麦蛋白通常作为食品添加剂,品质改良剂(主要为面筋增筋剂),还可以作为某些食品的替代品。由于小麦蛋白以疏水性氨基酸组成为主,在水中分散性较差,导致其凝胶性较弱且不稳定,限制了其在食品中的大规模应用。因此,需要对小麦蛋白进行适当改性,以拓宽其应用范围,提高产品的附加值。
目前,对植物蛋白的改性方法主要有化学改性[2]、物理改性[3]、酶法改性等。酶法改性由于可控性强、条件温和、耗能少、专一性强及副产物少,易于实现工业化生产而成为近年来研究的热点[4]。谷氨酰胺转氨酶(TG酶)是一种能催化多肽或蛋白质的谷氨酰胺残基的γ-羟胺基团与赖氨酸上的ε-氨基之间交联反应的酶,通过共价键的形成,可使蛋白质分子质量变大,形成强有力凝胶,从而改善各种蛋白制品的弹性、黏和性、保水性等品质,同时由于赖氨酸的引入使蛋白质的营养价值得到了提高。TG酶用于大豆分离蛋白改性时,能够显著改善大豆蛋白的凝胶性[5-6]及热稳定性[7-8]。酪蛋白和乳清蛋白经TG改性后其硬度和胶黏性都会得到一定程度的改善[9]。张崟等[10]研究表明在鳙鱼鱼糜中添加不同浓度的TG酶,均可使鳙鱼鱼糜形成致密、均匀的凝胶网络结构,其凝胶的破断强度、凹陷深度、凝胶强度及持水性增加,而对其颜色、白度无不良影响。可见,TG酶催化交联已成为提高大豆蛋白、乳蛋白、鱼肉蛋白等凝胶性能的一种高效、简单、实用的方法。当前,针对小麦蛋白的改性研究主要以改善其溶解度、乳化性等功能特性及酶解制备小分子活性肽为主,改善其凝胶特性的研究相对较少[11]。
本研究采用TG酶改性小麦蛋白,分析工艺参数对改性小麦蛋白凝胶特性的影响,并通过响应面分析法优化最佳改性加工条件,提高TG酶生物改性效果,获得凝胶性能良好的小麦蛋白产品,拓宽其应用范围,研究结果为小麦粉精深加工提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 试验材料
小麦蛋白:安徽瑞福祥食品有限公司;测定其组成如表1所示。

表1 小麦蛋白的组成/%
谷氨酰胺转氨酶(来源微生物链霉菌属,酶活120 U/g):南宁东恒华道生物科技有限公司。
1.1.2 仪器设备
721G可见分光光度计:上海精科仪器有限公司;JJ-1型数显电动搅拌器:江苏金坛市金城国胜实验仪器厂;TA-XT2i质构仪:美国TA仪器公司;FS-2可调高速分散器:江苏金坛市金城国胜实验仪器厂。
1.2 试验方法
TG酶改性小麦蛋白工艺:称取小麦蛋白,边搅拌边加到一定量的水中,配成一定浓度的悬浮液,用1 mol/L的NaOH调节反应体系pH值为所需值,添加TG酶,维持pH、温度不变,震荡水浴反应一定时间后取出。迅速置入冰箱冷冻结冰,真空冷冻干燥机干燥24 h,粉碎,过60目筛,即得TG酶改性小麦蛋白,密闭保藏。
通过单因素及响应面试验研究小麦蛋白浓度、TG酶浓度、反应温度、时间和pH值对小麦蛋白凝胶性的影响。试验指标为凝胶强度、持水性、黏度值。单因素试验初步参数:小麦蛋白质量浓度20 g/100 mL,酶浓度10 U/g小麦蛋白,温度30℃,反应时间2 h,反应pH 7.0。
1.3 分析方法
1.3.1 小麦蛋白组分测定方法
水分测定:GB 5009.3—2010;蛋白质测定:GB/T 5009.5—2010;灰分测定:GB 5009.4—2010;粗脂肪测定:GB 5009.6—2008;淀粉测定:GB/T 5009.9—2008。
1.3.2 蛋白溶解度的测定
采用双缩脲法[12]。
1.3.3 乳化性及乳化稳定性测定
参照文献[13]并略加修改。在烧杯中用0.05 mol/L的磷酸缓冲溶液(pH值为7.0)配制质量分数为1%的改性前和改性后小麦蛋白溶液100 mL,加入精制大豆油35 mL,室温下在高剪切分散乳化机中10 000 r/min均质1 min,重复均质1次。迅速从容器底部取0.05 mL乳状液到标号为1的试管中,0号试管为空白对照,加入0.05 mL蒸馏水,用5 mL 0.1%SDS溶液稀释,500 nm处测定光吸收值A1。静置20 min后重复上述操作得吸光值A2,其中A1代表乳化性,A2与A1的比值表示其乳化稳定性。
1.3.4 起泡性及起泡稳定性测定
参照文献[14]并略加修改。配制质量分数1%的改性前和改性后小麦蛋白溶液,取200 mL在高速组织捣碎机中搅打2min,迅速倒入500mL量筒中,记录泡沫体积V1,静置10 min后再次测量泡沫体积V2,起泡性和起泡稳定性测定见公式:
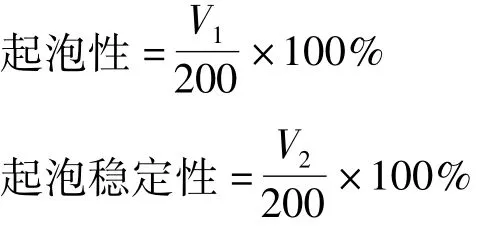
式中:V1为第1次泡沫体积/mL;V2为10 min后泡沫体积/mL。
1.3.5 保水性的测定
采用离心法[15]。
1.3.6 凝胶持水性的测定
酶促反应结束后,置于95℃恒温水浴锅中45 min热凝胶处理,取出后迅速冷却到室温,放入4℃冰箱冷冻过夜,即得改性小麦蛋白凝胶。参照文献[16]检测凝胶持水性。
1.3.7 凝胶性及黏度的测定
采用质构仪穿刺试验法[7,15]。
按照1.3.6中方法得到改性小麦蛋白凝胶。25℃下采用质构仪测定改性小麦蛋白的凝胶强度及黏度,穿刺试验操作条件:P 0.5探头,测试前速度:5.0 mm/s,测试速度:2.0 mm/s,测试后速度:10.0 mm/s,出发力10 g,下压凝胶5 mm所需力为凝胶强度,单位 g/cm2,负峰面积表示黏度,单位 g·s,重复试验3次,以平均值作为测定结果。
1.3.8 数据分析
所有试验进行3次重复,试验结果以平均值表示,采用Excel 2007对试验数据进行处理;响应面分析软件为Design-Expert8.0.5b。
2 结果与分析
2.1 不同条件下TG酶对小麦蛋白凝胶特性的影响
2.1.1 小麦蛋白浓度对其凝胶性的影响
TG酶改性小麦蛋白反应体系中,控制酶浓度10 U/g小麦蛋白,温度 30℃,反应时间 2 h,反应pH 7.0,检测其凝胶强度、持水性和黏度,结果如图1所示。
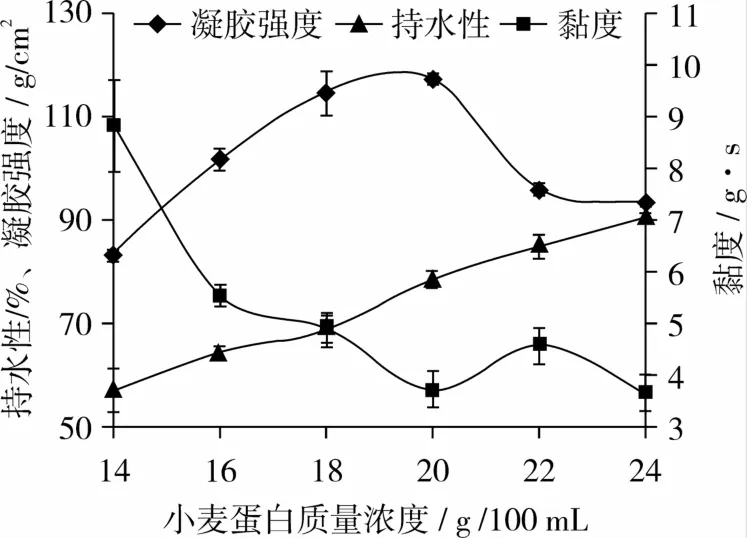
图1 小麦蛋白浓度对其凝胶性的影响
由图1可知,随着小麦蛋白浓度的增加,其凝胶性先增大后减小,黏度随着小麦蛋白浓度的增加呈逐渐下降的趋势,凝胶持水性随着小麦蛋白浓度的增加而升高。当小麦蛋白质量浓度为20 g/100 mL时,凝胶强度达到最大值117.460 g/cm2,随后,凝胶强度开始下降。已有研究表明,要达到一定的浓度,蛋白质才能成胶,浓度不足时则维持溶胶状,不能形成凝胶[17]。当小麦蛋白质量浓度低于20 g/100 mL时,TG酶与小麦蛋白只有少量交联,凝胶形成后均有水分析出,凝胶持水性低,相应的凝胶强度小,黏度相对较大。当小麦蛋白质量浓度为20 g/100 mL时,小麦蛋白能够最大程度的与TG酶交联,使得凝胶强度达到最大值,凝胶表面变得光滑,无水分析出,凝胶持水性增大,黏度降低。但是当浓度过大时,小麦蛋白不能均匀分散,易形成气泡,不利于与TG酶发生交联反应,相应的凝胶强度降低。根据结果得到小麦蛋白质量浓度在19~21 g/100 mL时,可以得到凝胶强度较好的小麦蛋白凝胶。
2.1.2 TG酶浓度对小麦蛋白凝胶性的影响
适量的酶不仅可以提高酶促反应的速度,缩短反应时间,而且可以避免因为加酶量过多而造成酶的浪费。在TG酶改性小麦蛋白反应体系中,控制小麦蛋白浓度20 g/100 mL,温度30℃,反应时间2 h,反应pH 7.0,研究TG酶的不同添加量对小麦蛋白凝胶强度的影响,如图2所示。
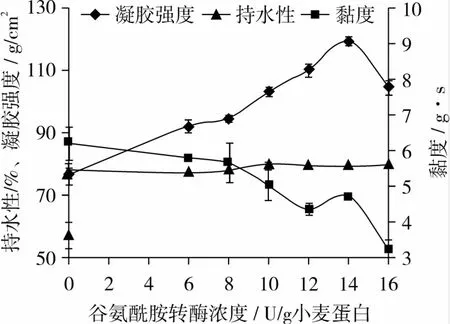
图2 TG酶浓度对小麦蛋白凝胶性的影响
由图2可知,随着TG酶浓度的增加,其凝胶性先增大后减小。当TG酶浓度为14 U/g小麦蛋白时,凝胶强度达到最大值 119.711 g/cm2,比对照76.984 g/cm2提高 55.5%,随后,凝胶强度开始下降。黏度随着TG酶浓度的增加呈逐渐下降的趋势,凝胶持水性无明显变化。试验表明,在确定的小麦蛋白浓度下,谷氨酰胺转氨酶能够提高小麦蛋白的凝胶强度,但对其持水性影响不大,并且随着小麦蛋白凝胶强度的增加,黏度降低。Yang等[8]研究表明:谷氨酰胺转氨酶催化小麦蛋白赖氨酸上的ε-氨基和谷氨酸上的γ-酰胺基结合形成ε-(γ-glutamy)Lys共价键,具有比氢键和二硫键更强的连接力,其强度是氢键和疏水键的20倍,同时小麦蛋白分子质量增大,更有利于凝胶的形成,从而使得小麦蛋白凝胶强度增大。所以TG酶的添加量为14 U/g小麦蛋白时,可得到凝胶性较好的小麦蛋白。
2.1.3 反应温度对小麦蛋白凝胶性的影响
在TG酶改性小麦蛋白反应体系中,控制小麦蛋白质量浓度20 g/100 mL,酶浓度14 U/g小麦蛋白,反应时间2 h,反应pH 7.0,研究反应温度对小麦蛋白凝胶强度的影响,如图3所示。
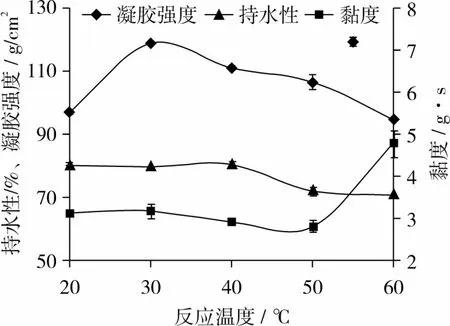
图3 反应温度对小麦蛋白凝胶性的影响
由图3可知,随着反应温度的增加,其凝胶性先增大后减小,当反应温度为30℃时,凝胶强度达到最大值为119.129 g/cm2,随后,凝胶强度开始下降。在20℃到50℃时,小麦蛋白黏度无明显变化,50℃到60℃时,黏度不断提高,表明反应温度的提高有利于小麦蛋白黏度的增大,但是不利于其凝胶强度的提高。在20℃到40℃时,凝胶持水性保持不变,大于40℃时,随着温度的升高,小麦蛋白凝胶持水性不断下降。有研究表明,温度对改性小麦蛋白凝胶性的影响主要还是对其酶促反应的影响,进而引起凝胶性的变化[17]。Ando等[18]曾报道,以氧肟酸为底物时,微生物TG酶在pH 7.0时,最佳酶促反应温度是40℃,但是试验中当反应温度为30℃时,小麦蛋白的凝胶性最强,而40~45℃时形成的凝胶强度较30℃低,原因是较高的温度下交联反应速度较快,使得蛋白质表面的作用位点很快被交联,降低了蛋白质分子间交联的几率,而TG酶催化小麦蛋白形成凝胶的主要作用是分子间形成的空间网状结构,导致TG酶作用不完全,凝胶强度降低[18]。所以TG酶改性小麦蛋白温度为30℃时,可得到凝胶性较好的小麦蛋白。
2.1.4 反应时间对小麦蛋白凝胶性的影响
在TG酶改性小麦蛋白反应体系中,控制小麦蛋白质量浓度20 g/100 mL,酶浓度14 U/g小麦蛋白,反应温度30℃,反应pH 7.0,研究反应时间对小麦蛋白凝胶强度的影响,如图4所示。
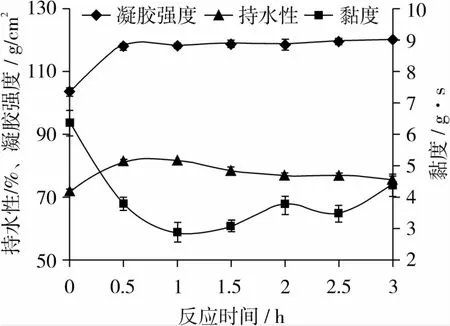
图4 反应时间对小麦蛋白凝胶性的影响
由图4可知,随着反应时间的增加,其小麦蛋白凝胶性先增大,反应0.5 h凝胶性达到最大值并保持基本不变。在反应的前1 h,黏度不断下降,1 h时黏度值最低。随着反应时间的延长,黏度值略有上升。在开始反应的0.5 h内凝胶持水性随着时间的增加而增加,在0.5 h到1.0 h保持在最大值,1 h后小麦蛋白凝胶持水性不断下降。可能的原因是,开始反应的0.5 h内,TG酶与小麦蛋白不断发生交联反应,0.5 h后TG酶催化蛋白分子表面的赖氨酸上的ε-氨基和谷氨酰胺上的γ-酰胺基反应完全,凝胶强度不再变化,并且有少量水分析出,持水性下降。所以固定TG酶改性小麦蛋白的时间为0.5 h,此时,凝胶强度及持水性达到最大,黏度相对较高。所以0.5 h后,时间因素影响不显著,固定反应时间为0.5 h。
2.1.5 反应pH对小麦蛋白凝胶性的影响
在TG酶改性小麦蛋白反应体系中,控制小麦蛋白质量浓度20 g/100 mL,酶浓度14 U/g小麦蛋白,反应温度30℃,反应时间2 h,研究反应pH对小麦蛋白凝胶强度的影响,如图5所示。

图5 反应pH对小麦蛋白凝胶性的影响
由图5可知,随着反应pH的增加,其凝胶性先增大后减小,当反应pH为7时,凝胶强度达到最大值为120.718 g/cm2,随后凝胶强度开始下降。随着反应pH的增加小麦蛋白黏度缓慢上升,凝胶持水性不断下降。这是因为改变反应体系的pH会影响蛋白质分子的离子化作用和静电荷值,影响蛋白质相互作用过程中的疏水作用和静电作用之间的平衡,进而影响凝胶的网状结构和凝胶性质[7,19]。当 pH为5时,小麦蛋白分散性较差,易结块,不能较好的形成有序的网状结构,同时不能与TG酶均匀接触,阻碍了其催化蛋白质分子间的交联反应,导致小麦蛋白的凝胶强度较低。当pH大于6时,凝胶强度增大,在pH 6~8时,凝胶性相对达到最大值,当pH大于8时,小麦蛋白凝胶强度下降,可能是因为TG酶不稳定发生空间构象改变而部分失活,交联反应减少[20]。
2.2 TG酶改性小麦蛋白的响应面优化结果与分析
由上述单因素试验结果可知,小麦蛋白浓度、加酶量、反应温度、反应pH值4个因素对小麦面筋蛋白的凝胶特性影响显著,因此,选取上述4个因素作响应面分析。响应面试验因素与水平设计见表2,响应面试验结果见表3。
利用Design-Expert 8.0.5b软件对表3中的凝胶强度进行二次回归拟合并剔除不显著项,得综合评分对小麦蛋白浓度(A)、加酶量(B)、反应温度(C)、反应pH值(D)的回归方程如下:
凝胶强度=120.10+1.91A+2.45B+1.56C+0.37D-4.33AB-0.021AC-0.35AD+1.09BC-1.45BD+6.17CD-2.94A2-4.42B2-3.47C2-6.68D2
P值常用来检验相关系数的显著性,主要反映自变量的交互作用。P值越小,对应因素的显著性越大。方差分析(表4)显示,模型P值小于0.000 1,失拟项(P>0.05)不显著,表明回归模型高度显著,说明该方法准确可靠,能模拟真实的四因素三水平可行性分析。

表2 响应面试验因素与水平
由表4可以看出,在所选各因素水平范围内,小麦蛋白浓度、加酶量、反应温度对凝胶性影响极显著,反应pH值对凝胶性影响不显著,且4个因素对综合评分影响的大小顺序为加酶量>小麦蛋白浓度>反应温度>反应pH值。交互作用AB、CD影响极显著,AC、AD、BC、BD影响不显著。二次项 A2、B2、C2、D2影响高度显著。
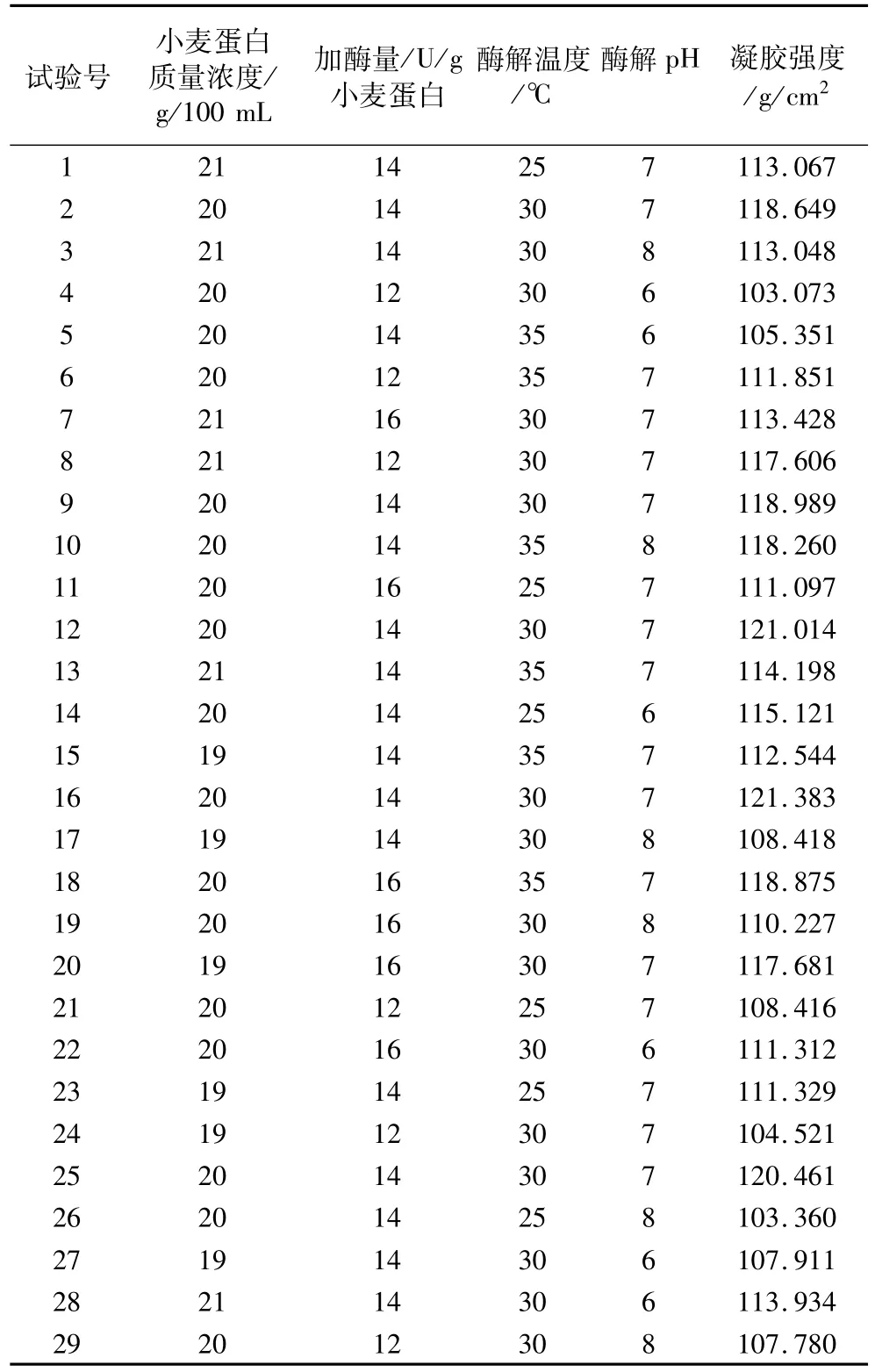
表3 响应面试验设计及结果
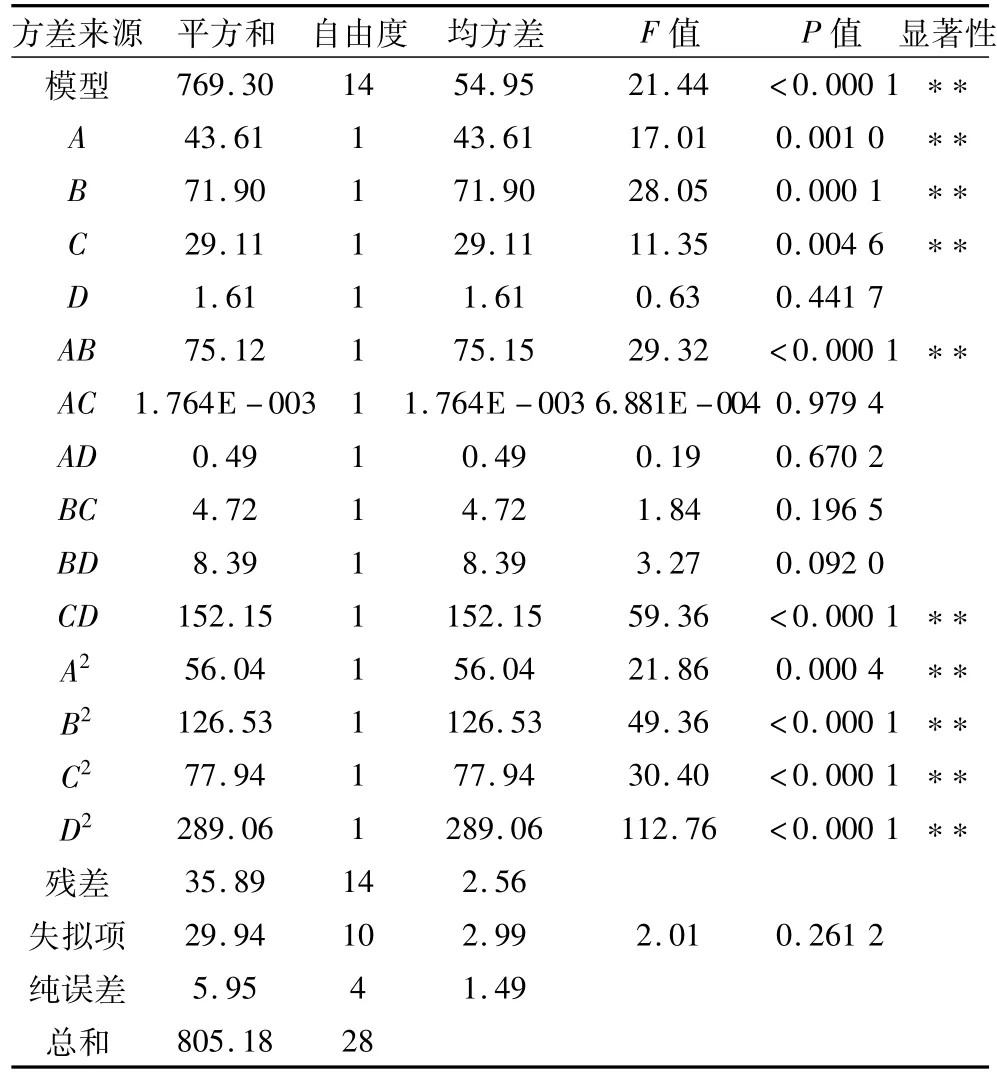
表4 响应面回归模型的方差分析
利用响应面试验设计,根据Box-Benhnken的中心组合试验设计原理,得到的最佳改性工艺条件为:小麦蛋白质量浓度20.14 g/100 mL,加酶量14.45 U/g小麦蛋白,反应温度32.20℃,反应pH值7.2,该条件下凝胶强度的理论值为120.894 g/cm2。根据试验的可操作性结果修订为:小麦蛋白质量浓度20 g/100 mL,加酶量14 U/g小麦蛋白,反应温度30℃,反应pH值7.0。
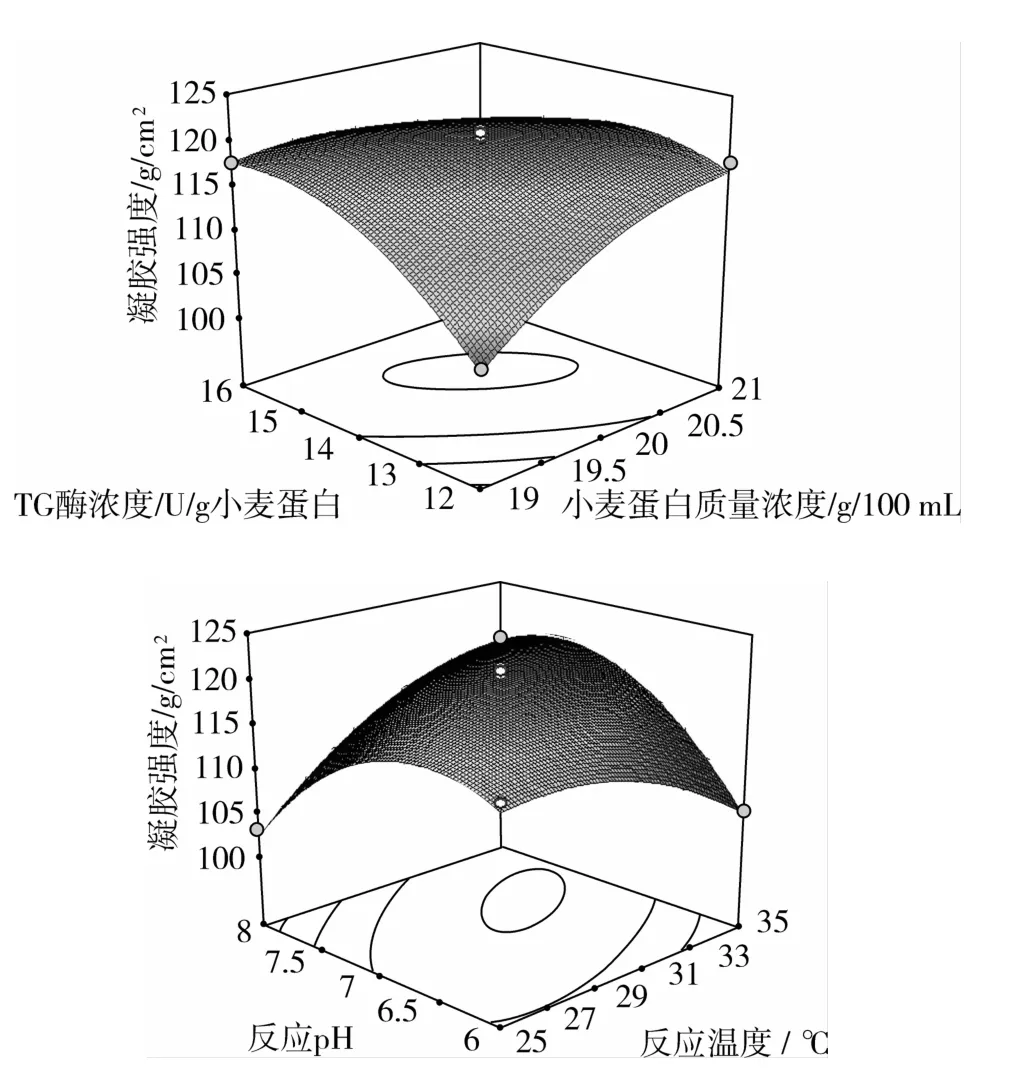
图6 各因素间交互作用对综合评分影响的响应面图
由图6可知:在温度30℃、作用时间0.5 h和pH 7.0时,研究小麦蛋白浓度和TG酶浓度的交互作用对凝胶强度的影响。固定小麦蛋白浓度和TG酶浓度条件之一,小麦蛋白凝胶性的变化趋势与单因素试验一致,这说明小麦蛋白浓度和TG酶浓度对凝胶强度的变化起到了较大作用。在小麦蛋白质量浓度20 g/100 mL、TG酶浓度为14 U/g小麦蛋白时,凝胶强度最大。在小麦蛋白质量浓度20 g/100 mL、TG酶浓度为14 U/g小麦蛋白、作用时间0.5 h时,研究反应温度和反应pH的交互作用对凝胶强度的影响。固定温度和pH条件之一,小麦蛋白凝胶性的变化趋势与单因素试验一致,这说明反应温度和pH对小麦蛋白凝胶强度的变化起到了较大作用。在反应温度30℃、pH 7.0时,凝胶强度最大。
2.3 TG酶改性前后小麦蛋白功能性质的比较分析
由表5可知,小麦蛋白经TG酶改性后,凝胶性、乳化性、起泡性显著增加,分别比未改性小麦蛋白提高55.5%、83%和56.25%;起泡稳定性和保水性稍有增加,分别比未改性小麦蛋白提高5%和8.5%;但是溶解度和乳化稳定性分别比未改性小麦蛋白降低9.91%和12.41%。其原因是TG通过催化蛋白质的Gln残基和Lys残基间的交联反应,促进面筋蛋白分子内和分子间的交联,可以增加面筋蛋白中的大分子数量,优化面筋的网络结构,这些对改善小麦蛋白的口感,提高其弹性、黏性、乳化性、起泡性和持水性等具有重要意义[11];但是由于TG酶对小麦蛋白的交联作用,小麦蛋白的分子质量增加,凝胶结构增强使得其溶解性有所降低。表明谷氨酰胺转氨酶可以改善小麦蛋白的乳化性、起泡性及保水性,拓宽其应用范围。
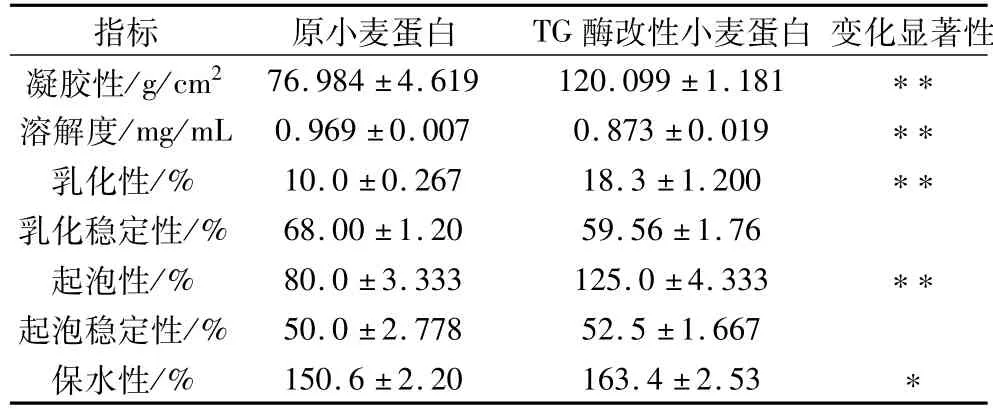
表5 改性前后小麦蛋白功能性质对比分析
3 结论
试验通过谷氨酰胺转氨酶改性小麦蛋白可明显提高其凝胶特性。通过小麦蛋白浓度、加酶量、反应温度、反应时间、反应pH值5个单因素对其凝胶性的影响研究及响应面优化试验可知:当小麦蛋白质量浓度为20 g/100 mL,TG酶用量14 U/g小麦蛋白,pH 7.0,30℃反应30 min时,谷氨酰胺转氨酶对小麦蛋白的凝胶性改善效果最强,凝胶强度达到最大值为120.099 g/cm2,比未改性小麦蛋白提高55.5%。同时乳化性、起泡性显著增加,分别比未改性提高83%和56.25%;乳化稳定性、起泡稳定性变化不显著;吸水性稍有增加,比未改性小麦蛋白提高8.5%。TG酶改性对于拓宽小麦蛋白的应用范围具有重要意义。
[1]付博菲,刘晓,徐绍建,等.谷阮粉的功能特性及改性研究[J].中国食品与营养,2012,18(9):35-37
[2]赵晓燕,孙秀平,陈军,等.不同电解质溶液对反胶束萃取花生蛋白的影响研究[J].中国粮油学报,2012,27(9):76-79
[3]马宁,朱科学,郭晓娜,等.挤压组织化对小麦面筋蛋白结构影响的研究[J].中国粮油学报,2013,28(1):60-64
[4]吴爽,朱科学,周慧明.酶解谷朊粉的研究进展[J].粮食与食品工业,2012,19(2):39-44
[5]胡小中,李里特.转谷氨酰胺酶的特性及其聚合大豆蛋白的研究[J].中国粮油学报,2011,26(9):119-122
[6]Jian Guo,Yu Congjin,Xiao Quanyang etal.Computed microtomography and mechanical property analysis of soy protein porous hydrogel prepared by homogenizing and microbial transglutaminase cross-linking[J].Food Hydrocolloids,2013,31:220-226
[7]于国萍,安静,初云斌,等.转谷氨酰胺酶催化对大豆分离蛋白凝胶性的影响[J].东北农业大学学报,2010,41(10):100-107
[8]Yang Mao,Liu Fu,Tang Chuanhe.Properties and microstructure of transglutaminase-set soy protein-stabilized emulsion gels[J].Food Research International,2013,52:409-418
[9]Maria S T,Evangelia G E,Petros S T.Transglutaminase treatment of thermally and high pressure processed mills:effects on the properties and storage stability of set yoghurt[J].Innovative Food Science and Emerging Technologies,2013,17:144-152
[10]张崟,曾庆孝,张佳敏,等.微生物转谷氨酰胺酶和大豆分离蛋白对罗非鱼鱼糜凝胶性能的影响[J].陕西科技大学学报,2010,28(1):5-10
[11]Gan CY,Cheng LH,Easa A M.Physicochemical properties and microstructures of soy protein isolate gels produced using combined cross-linking treatments ofmicrobial transgiutaminase andmaillard cross-linking[J].Food Research International,2008,41:600-605
[12]费国源,孙培龙.蛋白酶改性处理对小麦面筋蛋白溶解度和起泡性的影响[J].农产品加工·学刊,2009,160(1):32-34
[13]赵新淮,侯瑶.大豆蛋白限制性酶解对乳化性质和吸油性的影响[J].农业机械学报,2009,40(12):159-163
[14]Kingsley K,Agyare,Kwaku Addo,et al.Emulsifying and foaming properties of transglutaminase-treated wheatgIuten hydrolysate as influenced by pH,temperature and salt[J].Food Hydrocolloids,2009,23(1):72-81
[15]Gu X,Campbell L J,Euston SR.Influence of sugars on the characteristics of glucono-δ-lactone-induced soy protein isolate gels[J].Food Hydrocolloids,2009,23:314-326
[16]何冬兰,彭宝玉,张莹,等.微生物谷氨酰胺转胺酶对大豆分离蛋白凝胶性的影响[J].中南民族大学学报:自然科学版,2010,29(1):41-44
[17]叶云花,沙小梅,涂宗财,等.动态高压微射流和谷氨酰胺转氨酶交联技术对大豆分离蛋白凝胶性能的影响[J].食品科学,2011,32(23):40-42
[18]Ando H,Adachi M,Umeda K,et al.Purification and characteristics of a novel transglulaminase derived from microorganisms[J].Agricultural and Biological Chemistry,1989,53(10):2613-2617
[19]Puppo M C,Lupano C E,Anon M C.Gelation of soybean protein isolates in acidic conditions:effectof pH and protein concentration[J].Journal of Agricultural Food and Chemistry,1995,43(9):2356-2361
[20]Zhong Qixin,Wang Wan,Shinya Ikeda,et al.Sequential preheating and transglutaminase pretreatments improve stability ofwhey protein isolate at pH 7.0 during thermal sterilization[J].Food Hydrocolloids,2013,31:306-316.

