海洋寄生性甲藻
——阿米巴藻Amoebophrya spp.的研究进展
李才文
(1.中国科学院海洋研究所海洋生态与环境科学重点实验室,山东青岛 266071)
海洋寄生性甲藻
——阿米巴藻Amoebophrya spp.的研究进展
李才文1
(1.中国科学院海洋研究所海洋生态与环境科学重点实验室,山东青岛 266071)
寄生性甲藻阿米巴藻Amoebophrya是一类广泛寄生于纤毛虫类、放射虫类、甲藻类等海水浮游生物的原生生物,在北大西洋、北太平洋和地中海等营养盐丰富、宿主密度较高的河口和近海水环境中普遍存在,是海洋浮游食物网的重要组成部分。这类寄生性甲藻能够特异性感染海洋浮游甲藻,在有害藻华(harmful algal bloom,HAB)的发生过程中起下行控制作用,将逃脱了浮游动物摄食的浮游植物补充到微食物环(microbial loop)中去。Amoebophrya在近海海洋生态系统中的独特作用日益受到国际上越来越多研究者的关注和重视,并逐渐成为国际上海洋微型生物研究的新热点之一。近年来,已有初步调查研究表明这类寄生性甲藻在我国近海海域广泛存在;然而,目前我国尚缺乏该类寄生性甲藻的相关研究。本文系统综述了国际上该类寄生性甲藻的研究进展,针对目前研究中存在的问题并结合我国有害藻华发生机制相关研究的现状做出了分析和展望,以期推动我国该类寄生性甲藻的相关研究,为进一步阐释寄生性甲藻等海洋微型生物在有害藻华消长过程和海洋微食物环中的作用奠定基础。
寄生性甲藻;有害藻华;微食物环;生活史;多样性
1 引言
寄生性甲藻(parasitic dinoflagellates)的研究最早可以追溯到1885年,Pouchet第一次发现并报道了寄生在尾虫(appendicularia)体表的寄生性甲藻Gymno-dinium pulvisculus(现名为Oodinium pouchetii Chatton)[1]。迄今,文献中有报道的寄生性甲藻已超过140多种,占甲藻类总数量的7%左右[2]。寄生性甲藻的相关研究在早期并没有引起足够的重视。近年来随着几种寄生性甲藻的研究工作的深入开展,例如在海水蟹虾类中造成病害的寄生性甲藻Hematodinium[3]和在浮游甲藻类广泛寄生的Amoebophrya[4],寄生性甲藻在海洋生态系统中的作用得到了重新认识。
寄生性甲藻Amoebophrya是一类广泛寄生于纤毛虫类、放射虫类、甲藻类等海洋浮游生物的真核生物[5—6]。Amoebophrya在北大西洋、北太平洋和地中海等营养盐丰富、宿主密度较高的河口和近海水环境中普遍存在,是海洋浮游食物网的重要组成部分[4,7]。这类寄生性甲藻能够特异性感染、寄生于一些有害藻华(harmful algal bloom,HAB)甲藻宿主,最终通过在宿主细胞内大量增殖而裂解、破碎宿主细胞,从而将一些逃脱了浮游动物滤食的浮游植物补充到微食物环(microbial loop)中去[4—5,8]。Amoebophrya的这种特异性感染能够阻滞有害甲藻类藻华的形成,对有害藻华的发生起下行控制作用(top-down control)[9—13]。因此,Amoebophrya的相关研究受到国际上越来越多研究者的关注和重视,并逐渐成为国际上海洋微型生物研究的新热点之一[7,10—11,14—16]。
2 Amoebophrya的发现与分布
法国人NicolasKoeppen在1894年首次发现Amoebophrya spp.并命名了Amoebophryaceae科[5]。这类寄生性甲藻象阿米巴虫(amoeba)一样有形态的变化,而且有的生活史阶段虫体会被纤毛(cilia)覆盖;同时其孢子阶段有明显的甲藻孢子特征[17—19]。目前国内一般将dinoflagellate统一译为甲藻[20],钱树本等在编纂《海藻学》时在寄生藻目(Syndiniales)中收录了该寄生性甲藻科,并将Amoebophryaceae科音译为阿米巴藻科[21]。因此结合其形态特征,建议将寄生性甲藻Amoebophrya的中文名称定为阿米巴藻。
目前已经在20个属内40多种浮游甲藻中报道发现了阿米巴藻Amoebophrya spp.感染(表1)。
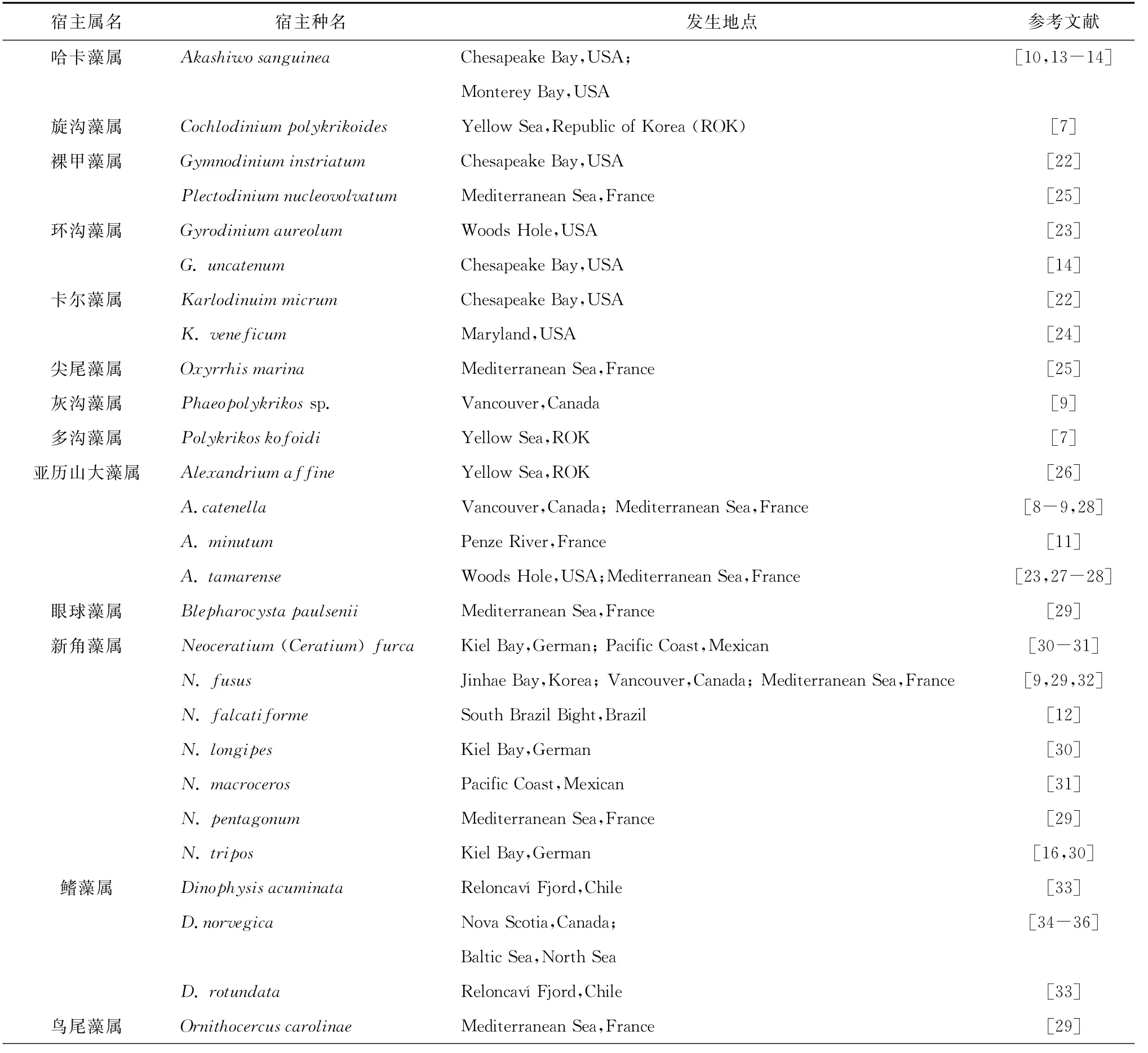
表1 已报道的感染寄生性甲藻Amoebophrya的浮游甲藻种类

续表1
3 Amoebophrya的系统分类
在基于形态学的分类体系中,阿米巴藻属Amoebophrya被收录在甲藻纲Dinophyceae、寄生藻目Syndiniales、阿米巴藻科Amoebophryaceae下[4]。在基于r RNA序列的最新分类体系中,Amoebophrya被归类于GroupⅡMarine Alveolates,位于甲藻分子系统进化分枝的基部,与其他浮游甲藻类成为姊妹群[37—38](见图1)。文献中已正式命名的Amoebophrya有6种,分别为Amoebophrya acanthometrae,A.ceratii,A.grassei,A.leptodisci,A.rosei,A.stycholonchae 和A.tintinni(algaeBASE Data Base;WoRMS Data Base)。其中3种主要感染甲藻类:Amoebophrya leptodisci特异性感染异养型甲藻Pratijetella medusoides,A.grassi主要寄生于Oodinium pouchetti和O.acanthometrae,而A.ceratii则能寄生感染多种自养型、异养型和混合营养型浮游甲藻[5—6]。因为有些Amoebophrya种(如A.ceratii)的宿主范围广泛,Amoebophrya以前一直被认为是“宿主泛化种”(host generalist)[6,34]。然而,近来的实验研究和分子生物学研究结果表明,A.ceratii是由多种形态相近的不同株或亚种组成的混合体(complex)[16,28,39—40]。因此,目前对于Amoebophrya属内不同种以及同一种内不同株系的最终分类地位尚未有一致的结论。
4 Amoebophrya的形态与生活史
Amoebophrya的生活史主要包括甲藻孢子(dinospore)、蠕虫体(vermiform)和滋养体(trophont)这3个阶段。滋养体在感染末期会在宿主细胞内形成特征性的“蜂窠”(beehives)状多核体(syncytium)[5,10,11,42](见图2)。甲藻孢子体直径大约5μm,下锥部(hyposome)呈球状,上锥部(episome)呈尖锥状。同其他寄生性甲藻一样,Amoebophrya的传播、感染也是通过孢子来完成[6]。孢子能够吸附在宿主细胞上,穿透细胞壁,并侵入细胞内部。随后,孢子在宿主细胞质内,发展成为滋养体,并进行一系列细胞核分裂和鞭毛复制;同时下锥部持续扩张,包围上锥部进而形成凹槽状结构(mastigocoel),鞭毛集束在凹槽内;最终在宿主细胞内发展成为蜂巢状的多核体。多核体发育成熟后,其凹槽外翻、鞭毛束外向,延伸成蠕虫体;蠕虫体通过鞭毛运动破碎宿主表皮后,进入水体。蠕虫体在水体中存在时间很短,迅速发展成很多具感染性的甲藻孢子[5]。实验室培养结果显示,Amoebophrya的世代时间大约2~4 d(从侵入宿主细胞到宿主细胞死亡)[10,22]。
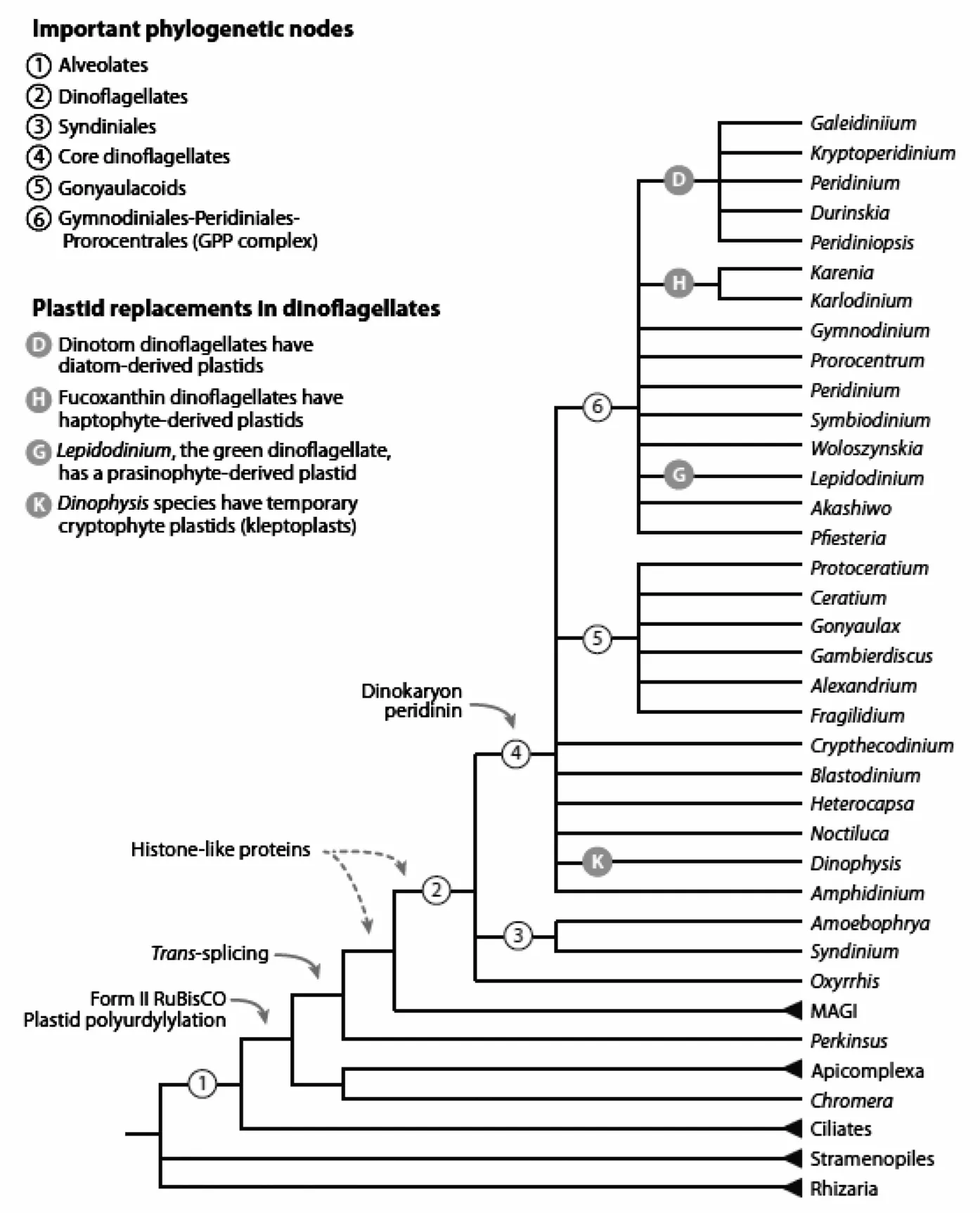
图1 基于分子遗传学分析的甲藻系统进化树(引自文献[38])
早期的研究表明,Amoebophrya在感染具甲类甲藻(Prorocentrum micans除外)时主要在细胞核内增殖,而在感染无甲类甲藻时则主要在细胞质内增殖[5]。然而后来研究发现,Amoebophrya在感染有些无甲类甲藻如血红哈卡藻A犽ashiwo sanguinea,微小卡尔藻Karlodinuim micrum时也可以在细胞核内增殖[22];而在感染有些具甲板甲藻类如Alexandrium affine,叉新角藻Neoceratium furca,弯顶新角藻N.longipes,斯克里普藻Scrippsiella spp.等时也可以在细胞质内增殖[10,14,16]。而且根据文献中报道,Amoebophrya spp.在感染微小卡尔藻K.micrum和弯顶新角藻N.longipes(具甲板)既可以在细胞核内增殖,又可以在细胞质内增殖,有时这两种增殖方式甚至同时发生在同一宿主细胞内[10,14,43—44]。这些感染、增殖方式描述的差异也有可能是因为感染宿主的Amoebophrya株系的不同导致的,因为有研究表明不同株系的Amoebophrya能同时感染一种甲藻宿主(例如Dinophysis norvegica)[36]。尽管如此,大多数Amoebophrya都有类似的生活史,只是由于在宿主细胞内增殖方式的不同,有些种的细胞核或鞭毛的发育顺序可能有差异[5]。
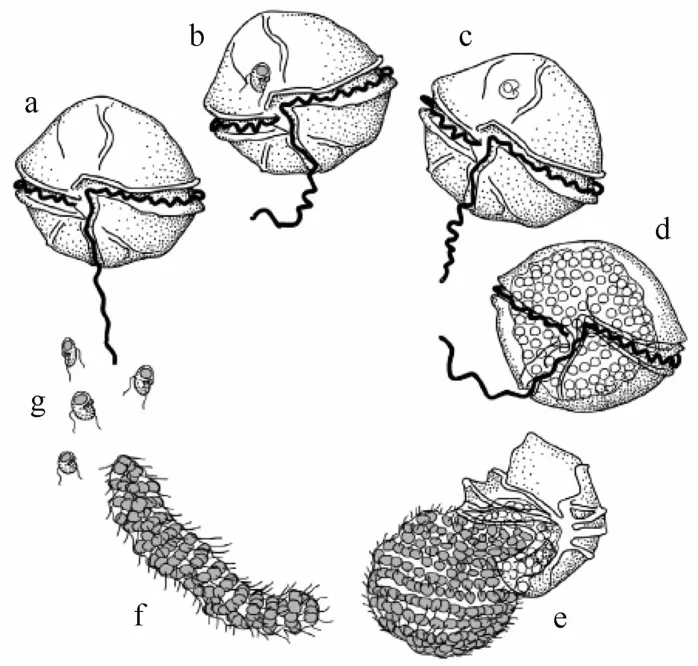
图2 寄生性甲藻(parasitic dinoflagellate)Amoebophrya的典型生活史[42]
5 Amoebophrya在有害藻华消长过程中的作用
Cachon最早在地中海的多种甲藻藻华研究中发现,Amoebophrya ceratii的感染率变化往往与宿主甲藻藻华的消退趋势一致[5]。在美国西海岸地区,A.ceratii在链状亚历山大藻Alexandrium catenella中的感染率为30%~40%,在纺锤新角藻N.fusus中的感染率高达80%[9]。因此,A.ceratii被认为与这些甲藻类宿主种群数量的迅速减少密切相关,是阻滞藻华发生的重要因素[8]。也有学者发现A.ceratii在Dinophysis norvegica中感染率较低(≤2%),认为Amoebophrya可能不会对宿主种群数量产生明显影响[34—35]。后来,Coats和Bockstahler发现在海水密度跃层附近的A犽ashiwo sanguinea中A.ceratii的感染率可达20%~40%,远高于表层正在发生藻华的宿主感染率[10]。由此作者推断可能海水分层限制了A.ceratii的传播扩散,在水深较浅、混合均匀的水体中则不会有此限制,A.ceratii对宿主甲藻类的下行控制作用会比较明显,这一假说随后也得到了现场验证。
Coats等对美国Chesapeake Bay支流的Gyro-dinium uncatenum藻华消长进行了研究,发现A.ceratii的感染率最高可达80%,每天有54%的宿主由于Amoebophrya的侵染而消亡[14]。近年来越来越多的研究表明,Amoebophrya与甲藻的动态消长过程有直接的关系。Chambouvet等连续3年监测研究了法国Penze River河口的主要甲藻类,发现锥状斯克立普藻Scrippsiella trochoidea,微小亚历山大藻A.minutum,Heterocapsa rotundata和三角异冒藻H.triquetra等分别被不同种类的Amoebophrya持续感染;并认为Amoebophrya在这些甲藻藻华的发生过程中起重要的调控作用[11]。Mazzillo等也发现Amoebophrya在美国加州Monterey Bay血红哈卡藻A.sanguinea藻华期间感染率超过20%,是导致藻华消退的直接因素之一[13]。另外,Montagnes等通过数值模型研究、评估了浮游动物和Amoebophrya寄生作用对法国近岸甲藻藻华消长的贡献,发现在甲藻藻华发生过程中,Amoebophrya的作用和影响明显高于微型浮游动物的捕食作用[42]。Salomon和Stolte运用Lotka-Volterra捕食模型和文献中已发表数据模拟了A.sanguinea,Gymnodinium instriatum和微小卡尔藻Karlodinium micrum在Amoebophrya感染下的种群增长模式,发现Amoebophrya具有与捕食类似的作用,在相对封闭的系统对宿主甲藻有明显的控制作用[45]。
早在1968年,Taylor曾建议采用诸如Amoebophrya之类的病原微型生物来控制有害藻华的暴发[46],但是由于当时普遍认为Amoebophrya是“宿主泛化种”(host generalist),可能会影响普通浮游植物生产过程,这种假说并没有引起足够的重视[40]。近年来随着基因测序技术的发展及其在海洋生物多样性调查研究的大规模应用,Amoebophrya的遗传多样性被重新发掘出来,从环境水体中扩增出的类似于Amoebophrya的18S核糖体小亚基DNA(18S ribosomal DNA)序列高达44组(cluster),与已知的宿主种类数相当[28,47]。并且,研究者发现感染甲藻类的Amoebophrya具一定的特异性;尽管有时同一种甲藻宿主可能被多株Amoebophrya感染[36],例如多数Amoebophrya ceratii株只能感染特定的一种甲藻或与该种甲藻亲缘关系接近的物种[22,26,44]。总之,众多的研究表明,寄生性甲藻Amoebophrya能够有效地阻滞宿主甲藻藻华的形成,并导致藻华的消退;然而,Amoebophrya特异性感染在甲藻有害藻华消长过程中的量化贡献目前尚无清晰的结论,能否利用Amoebophrya来有效的控制甲藻有害藻华的暴发还有待进一步的研究。
6 Amoebophrya在海洋浮游食物网中的作用
寄生性甲藻Amoebophrya通过直接作用于甲藻类群,在生物量丰富的河口、海岸浮游食物网中发挥重要的作用。能够产生毒素的浮游甲藻类可能会由于浮游动物摄食受到毒素限制而易于产生藻华,为Amoebophrya孢子感染新的宿主细胞创造了机会[48—49]。在不受外部条件限制时,Amoebophrya孢子可以在短时间内流行扩散,引起藻华迅速消退[50],而其在宿主甲藻中大规模的传播扩散可以大量裂解藻细胞,从而将未被捕食的藻细胞转化为能够在浮游生物群落中再循环利用的资源,如宿主细胞残留躯壳、从宿主细胞中漏出的溶解有机质(dissolved organic matter)等[4,7]。Amoebophrya孢子自身也可以是食物链的重要一环。Amoebophrya孢子离开宿主细胞后,如果没有及时感染新的宿主细胞,在水体中能存活几小时到2~5 d[22],会被浮游动物直接摄食,从而形成一条维持时间较短的营养链(trophic link)。例如Salomon等研究了巴西南部海岸Ceratium falcatiforme(Neoceratium falcatiforme)发生过程中Amoebophrya的作用,发现该寄生性甲藻感染可致11%宿主死亡,约6.5%的碳通过形成Amoebophrya孢子进入到海洋食物链中[12]。然而如果大量孢子被滤食性浮游动物摄食,Amoebophrya感染的进一步扩散就会受到影响[15,51]。Amoebophrya感染裂解宿主细胞产生的溶解有机质对微食物环的影响、贡献等亟待进一步的研究和评估。
感染Amoebophrya宿主细胞的个体一般大于正常的细胞,表明该寄生虫既可以利用宿主现有的生源要素,也可以利用宿主感染后固定的碳进行生长增殖[7];而有些感染Amoebophrya的甲藻类细胞个体大小则没有明显的变化,可能是因为Amoebophrya能中止宿主细胞(如A.sanguinea)的光合作用,或者不能利用宿主细胞(如G.instriatum)感染Amoebophrya后固定的有机质进行增殖[52]。通常Amoebophrya从宿主甲藻细胞破碎出来后,宿主残留躯壳随后被细菌降解,这一途径是水体中溶解有机质(DOM)的重要来源,如红色赤潮藻A.sanguinea感染Amoebophrya死亡后,有50%~70%的生物量以细胞残留释放到水体中[53]。寄生性甲藻Amoebophrya是链接传统海洋食物链和微生物食物环的重要中间环节;然而,其在浮游食物链中发挥的独特作用并没有像其他营养链过程(如细菌降解、病毒感染、浮游动物摄食等)一样引起足够的重视。
7 我国研究现状及展望
甲藻类有害藻华在我国沿海频繁发生,不仅造成了严重的生态、环境问题,也给海洋渔业带来了重大经济损失[54-58]。常见的有害藻华甲藻类,如亚历山大藻Alexandrium,原甲藻Prorocentrum,裸甲藻Gymnodinium,斯克里普藻Scrippsiella,新角藻Neoceratium等,在我国近海海域有广泛分布[20],都是阿米巴甲藻Amoebophrya spp.的潜在宿主。近年来已经开始有阿米巴甲藻在我国近海存在的相关报道,如李绿砚在南海北部浅海、岛屿、大陆架海域等采集了海洋微型真核浮游生物样品,并构建了相应的18S rDNA的文库,发现在南海海域扩增得到的聚类于Novel Alveolates groupⅡ的分子序列中,类似Amoebophrya的克隆占获得的的克隆总量的68%;这也是国内首次对中国海域的Amoebophrya类群的报道[59]。最近我们在对从东海、黄海采集的部分海水样品进行18S r DNA基因测序时,也发现了Amoebophrya类的分子序列;而且在实验室中进行浮游甲藻鉴定、培养时,也首次发现了几种感染Amoebophrya的甲藻细胞。这些信息表明Amoebophrya类寄生性甲藻在我国近海海域广泛存在。微型、超微型病原微生物(如寄生虫、细菌、病毒等)在近海海洋生态环境中发挥不可或缺的作用[60—61]。然而,目前我国很少有关于这些病原微生物在有害藻华消长过程中作用的相关研究,尤其缺乏寄生性甲藻Amoebophrya等在我国近海常见甲藻种藻华发生过程中的作用及其对海洋微生物食物环贡献的相关研究,应该引起足够的重视和支持。
致谢:作者感谢暨南大学齐雨藻先生、天津科技大学孙军教授对于甲藻命名的建议,国家海洋局第一海洋研究所朱明远研究员和中国科学院海洋研究所俞志明研究员在文稿形成过程中给予的建议和帮助!
[1] Pouchet G.Nouvelle contribution B l'histoire des Pdridiniens marins[J].Journal of Anatomy and Physiology(Paris),1885,21:28-88.
[2] Drebes G.Life cycle and host specificity of marine parasitic dinoflagellate[J].Helgolander Meeresunters,1984,37:603-622.
[3] Stentiford G D,Shields J D.A review of the parasitic dinoflagellates Hematodinium species and Hematodinium-likeinfections in marine crustaceans [J].Diseases of Aquatic Organisms,2005,66:47-70.
[4] Coats D W.Parasitic life styles of marine dinoflagellates[J].Journal of Eukaryotic Microbiology,1999,46:402-409.
[5] Cachon J.Contribution I'ttude des ptridiniens parasites.Cytologie,cycles Cvolutifs[J].Annales Des Sciences Naturelles comprenant la Zoologie,1964,6:1-158.
[6] Cachon J,Cachon M.Parasitic dinoflagellates[M]//Taylor FJR.The Biology of Dinoflagellates.Oxford:Blackwell Publishing,1987:571-610.
[7] Park M G,Yin W,Coats D W.Parasites and phytoplankton,with special emphasis on dinoflagellate infections[J].Journal of Eukaryotic Microbiology,2004,51:145-155.
[8] Taylor F J R.Parasitism of the toxin-producing dinoflagellate Gonyaulax catenella by the endoparasitic dinoflagellate Amoehophrya ceratii[J]. Journal of the Fisheries Research Board of Canada,1968,25:2241-2245.
[9] Nishitani L,Erickson G,ChewKK.Role of the parasitic dinoflagellate Amoebophrya ceratii in control of Gonyaulax catenella populations[M]//Anderson D M,White A W,Baden D G.Toxic Dinoflagellates.New York:Elsevier Science Publishers,1985:225-230.
[10] Coats D W,BockstahlerKR.Occurrence of the parasitic dinoflagellate Amoebophrya ceratii in Chesapeake Bay populations of Gymnodinium sanguineum[J].Journal of Eukaryotic Microbiology,1994,41:586-593.
[11] Chambouvet A,Morin P,Mari D,et al.Control of toxic marine dinoflagellate blooms by serial parasitic killers[J].Science,2008,322:1254-1257.
[12] Salomon P S,Granéli1 E,Neves M H C B,et al.Infection by Amoebophrya spp.parasitoids of dinoflagellates in a tropical marine coastal area[J]. Aquatic Microbial Ecology,2009,55:143-153.
[13] Mazzillo F F M,Ryan J P,Silver M W.Parasitism as a biological control agent of dinoflagellate blooms in the California Current System[J]. Harmful algae,2011,10:763-773.
[14] Coats D W,Adam E J,Gallegos C L,et al.Parasitism of photosynthetic dinoflagellates in a shallow subestuary of Chesapeake Bay,USA[J].A-quatic Microbial Ecology,1996,11:1-9.
[15] Maranda L.Infection of Prorocentrum minimum(Dinophyceae)by the parasite Amoebophrya sp.(Dinoflagellea)[J].Journal of Phycology,2001,37:245-248.
[16] Kim S,Park M G,KimKY,et al.Genetic diversity of parasitic dinoflagellates in the genus Amoebophrya and its relationship to parasite biology and biogeography[J].Journal of Eukaryotic Microbiology,2008,55:1-8.
[17] Cachon J,Cachon M.Ultracture des Amoebophryidae(Peridiniens:Duboscquodinida):Ⅰ.Manifestations des rapports entre I'hote et le parasite [J].Protistologica,1969,5:535-547.
[18] Cachon J,Cachon M.Ultracture des Amoebophryidae(Peridiniens:Duboscquodinida):Ⅱ.Systemes atractophoriens et microtubulaires,leur intervention dans la mitose[J].Protistologica,1970,6:57-70.
[19] Miller J J,Delmiche C F,Coats D W.Ultrastructure of Amoebophrya sp.and its changes during the course of infection[J].Protist,2012,163:720-745.
[20] 齐雨藻,等.中国沿海赤潮[M].北京:科学出版社,2003.
[21] 钱树本,等.海藻学[M].青岛:中国海洋大学出版社,2005.
[22] Coats D W,Park M G.Parasitism of photosynthetic dinoflagellates by three strains of Amoebophrya(Dinophyta):parasite survival,infectivity,generation time,and host specificity[J].Journal of Phycology,2002,38:520-528.
[23] Jacobson D M.The ecology and feeding biology of thecate heterotrophic dinoflagellates[D].Woods Hole Oceanographic Institution-Massachusetts Institute of Technology Joint Program,1987.
[24] Bai X,Adolf J E,Bachvaroff T,et al.The interplay between host toxins and parasitism by Amoebophrya[J].Harmful Algae,2007,6:670-678.
[25] Chatton E,Biecheler B.Les Amoebophrya et ale Hyalosaccus:Leur cycle evolutif.L'ordre nouveau des Coelomastigina dans les Flagelles[J]. Comptes Rendus de l'Académie des Sciences,1935,200:505-507.
[26] Kim S,Park M G,Yih W H,et al.Infection of the bloom-forming,thecate dinoflagellates Alexandrium affine and Gonyaulax spinifera by two strains of Amoebophrya(Dinophyta)[J].Journal of Phycology,2004,40:815-822.
[27] Leblond J D,Sengco M R,Sickman J O,et al.Sterols in the Syndinian dinoflagellate parasite,Amoebophrya sp.,a parasite of the dinoflagellate Alexandrium tamarense(Dinophyceae)[J].Journal of Eukaryotic Microbiology,2006,53(3):1-6.
[28] Chambouvet A,Laabir M,Sengco M,et al.Genetic diversity of Amoebophryidae(Syndiniales)during Alexandrium catenella/tamarense(Dinophyceae)blooms in the Thau lagoon(Mediterranean Sea,France)[J].Research in Microbiology,2011,162:959-968.
[29] Siano R,Alves-de-Souza C,Foulon E,et al.Distribution and host diversity of Amoebophryidae parasites across oligotrophic waters of the Mediterranean Sea[J].Biogeosciences,2011,8:267-278.
[30] Elbrachter M.Population dynamics of Ceratium in coastal waters of theKiel Bay[J].Oikos,1973,15(Suppl.):43-48.
[31] Lizarraga I G,Beltrones D A S.Infections of Ceratium furca by the parasitic dinoflagellate Amoebophryaceratii(Amoebophryidae)in the Mexican Pacific[J].Acta Botanica Mexicana,2003,65:1-9.
[32] Kim Y G,Park M G,Yih W H.Host-parasite system in a red tide dinoflagellate Prorocenfrum minimum:(1)Life cycle stages of the parasitic dinoflagellate Amoebophrya sp.[J].Journal of theKorean Society of Oceanography,2002,7:221-225.
[33] Alves-de-Sourza C,Vareka D,Iriarte J,et al.Infection dynamics of Amoebophryidae parasitoids on harmful dinoflagellates in a southern Chilean fjord dominated by diatoms[J].Aquatic Microbial Ecology,2012,66:183-197.
[34] Fritz L,Nass M.Development of the endoparasitic dinoflagellate Amoebophryaceratii within host dinoflagellate species[J].Journal of Phycology,1992,28:12-320.
[35] Gisselson L A,Carlsson P,Grantli E,et al.Dinophysis blooms in the deep euphotic zone of the Baltic Sea:do they grow in the dark?[J].Harmful Algae,2002,1:401-418.
[36] Salomon PS,Janson S,Grantli E.Parasitism of Dinophysisnowegica by Amoebophrya sp.in the Baltic Sea[J].Aquatic Microbial Ecology,2003,33:163-172.
[37] Groisillier A,Massana R,ValentinK,et al.Genetic diversity and habitats of two enigmatic marine alveolate lineages[J].Aquatic Microbial Ecology,2006,42:277-291.
[38] Wisecaver J H,Hackett J D.Dinoflagelalte genome evolution[J].Annual Review of Microbiology,2011,65:369-387.
[39] Gunderson J H,Goss S H,Coats D W.The phylogenetic position of Amoebophrya sp.infecting Gymnodiniumsanguineum[J].Journal of Eukaryotic Microbiology,1999,46:194-197.
[40] Gunderson J H,John S A,Boman W C,et al.Multiple strains of the parasitic dinoflagellate Amoebophrya exist in Chesapeake Bay[J].Journal of Eukaryotic Microbiology,2002,49:469-474.
[41] Janson S,Gisselson L A,Salomon P S,et al.Evidence for multiple species within the endoparasitic dinoflagellate Amoebophrya ceratii as based on 18S rRNA gene-sequence analysis[J].Parasitology Research,2000,86:929-933.
[42] Montagnes D J S,Chambouvet A,Guillou L,et al.Responsibility of microzooplankton and parasite pressure for the demise of toxic dinoflagellate blooms[J].Aquatic Microbial Ecology,2008,53:211-225.
[43] Elbrachter M,Schnepf E.Parasite of harmful algae[M]//Anderson D M,Cembella A D,Hallegraeff G M.Physiological Ecology of Harmful Algal Blooms.Berlin Heidelberg:Springer-Verlag,1998:351-369.
[44] Kim S.Patterns in host range for two strains of Amoebophrya(Dinophyta)infecting thecate dinoflagellates:Amoebophrya spp.ex Alexandrium affine and ex Gonyaulax polygramma[J].Journal of Phycology,2006,42:1170-1173.
[45] Salomon P S,Stolte W.Predicting the population dynamics in Amoebophrya parasitoids and their dinoflagellate hosts using a mathematical model [J].Marine Ecology Progress Series,2010,419:1-10.
[46] Taylor F J R.Parasitism of the toxic-producing dinoflagellate Gonyaulax catenella by the endoparasitic dinoflagellate Amoebophrya ceratii[J]. Journal of the Fisheries Research Board of Canada,1968,25:2241-2245.
[47] Guillou L,Viprey M,Chambouvet A,et al.Widespread occurrence and genetic diversity of marine parasitoids belonging to Syndiniales(Alveolata)[J].Environmental Microbiology,2008,10:3349-3365.
[48] Teegarden GJ,Campbell R G,Durbin E G.Zooplankton feeding behavior and particle selection in natural plankton assemblage containing toxic Alexandrium spp.[J].Marine Ecology Progress Series,2001,218:213-226.
[49] Tillmann U,Uwe J.Toxic effects of Alexandrium spp.on heterotrophic dinoflagellates:an allelochemical defense mechanism independent of PSP-toxin content[J].Marine Ecology Progress Series,2002,230:47-58.
[50] Coats D W,Adam E J,Gallegos C L,et al.Parasitism of photosynthetic dinoflagellates in a shallow subestuary of Chesapeake Bay,USA[J].A-quatic Microbial Ecology,1996,11:1-9.
[51] Johansson M,Coats D W.Ciliate grazing on the parasite Amoebophrya sp.decreases infection of the red-tide dinoflagellate A犽ashiwo sanguinea [J].Aquatic Microbial Ecology,2002,28:69-78.
[52] Park M G,Cooney SK,Kim J S,et al.Effects of parasitism on diel vertical migration,phototaxis/geotaxis,and swimming speed of the bloomforming dinoflagellate A犽ashiwo sanguinea[J].Aquatic Microbial Ecology,2002,29:11-18.
[53] Yih W,Coats D W.Infection of Gymnodinium sanguineum by the dinoflagellate Amoebophrya sp.:Effect of nutrient environment on parasite generation time,reproduction,and infectivity[J].Journal of Eukaryotic Microbiology,2000,47:504-510.
[54] 邹景忠.赤潮生物与赤潮灾害[M]//曾呈奎.中国海洋科学研究及开发.青岛:青岛出版社,1992:284-287.
[55] 苏纪兰.中国的赤潮研究[J].中国科学院院刊,2001,5:339-342.
[56] 周名江,朱明远,张经.中国赤潮的发生趋势和研究进展[J].生命科学,2001,13:54-59.
[57] 陆斗定,等.浙江沿海赤潮发生特点分析[M].北京:海洋出版社,2005:46-53.
[58] 周名江,朱明远.我国近海有害赤潮发生的生态学、海洋学机制及预测防治研究进展[J].地球科学进展,2006,21:673-679.
[59] 李绿砚.中国南海微型与超微型真核浮游生物的分子生态学研究[D].广州:中山大学,2008.
[60] Salomon PS,Imai I.Pathogens of harmful microalgae[M]//Graneli E,Turner J T.Ecology of Harmful Algae.Berlin Heidelberg:Springer-Verlag,2006.
[61] Gachon C M M,Sime-Ngando T,Strittmatter M,et al.Algal diseases:spotlight on a black box[J].Trends in Plant Science,2010,15:633-640.
The ecological role of parasitic dinoflagaellate Amoebophrya spp. in coastal marine environments:A review
Li Caiwen1
(1.Key Lab of Marine Ecology andEnvironmental Sciences,Instituteof Oceanology,Chinese Academy of Sciences,Qingdao 266071,China)
Parasitic dinoflagellate Amoebophrya infects broad range hosts of ciliates,radiolarians and planktonic dinoflagellates in eutrophicated coastal water worldwidely.Particularly,Amoebophrya can infect specific types of bloom-forming marine dinoflagellates,and effectively recycle undergrazed planktonic dinoflagellates back to the microbial loop by disrupting host cells.The parasites play a top-down control role in their host populations and represent an important aspect of marine food webs in enriched coastal environment.The ecological significance of Amoebophrya has been recognized in recent years by researchers around the world.Lately,scattered evidences indicated that this type of parasitic dinoflagelaltes is widely distributed along the coastal areas of China;however,few studies had been conducted on Amoebophrya in China despite that fruitful research on harmful algal booms.To promote further researchs on fundemental aspects and ecological significance of the parasitic dinoflagellates in costal environments of China,we reviewed the biology and ecology of Amoebophrya spp.infecting major marine dinoflagellates,with emphasis on host range,diversity,life cycle,and key aspects of the ecological roles.
parasitic dinoflagellate;harmful algal bloom;microbial food loop;life cycle;diversity
P735
A
0253-4193(2014)06-0001-09
2013-05-21;
2013-11-02。
国家基金委青年科学基金项目(41206145);国家基金委创新研究群体科学基金项目(41121064);海洋公益性行业科研专项经费项目(201005015-1);中国科学院海洋研究所创新工程青年人才前沿项目(Y12333101Q)。
李才文(1977—),山东省安丘市人,博士,研究员,博士生导师,主要从事寄生性甲藻生物和生态学相关研究。E-mail:cwli@qdio.ac.cn
李才文.海洋寄生性甲藻——阿米巴藻Amoebophrya spp.的研究进展[J].海洋学报,2014,36(6):1—9,
10.3969/j.issn.0253-4193.2014.06.001
Li Caiwen.The ecological role of parasitic dinoflagaellate Amoebophrya spp.in coastal marine environments:A review[J].Acta Oceanologica Sinica(in Chinese),2014,36(6):1—9,doi:10.3969/j.issn.0253-4193.2014.06.001

