微孔玻璃的制备及其吸附分离N2/CO2研究
苏 伟,胡 鹏,付兴亮,孙 艳
微孔玻璃的制备及其吸附分离N2/CO2研究
苏 伟1,2,胡 鹏1,付兴亮1,孙 艳3
(1. 天津大学化工学院,天津 300072;2. 天津市膜科学与海水淡化重点实验室,天津 300072;3. 天津大学理学院,天津 300072)
吸附法脱除二氧化碳的关键在于开发高效的吸附剂.采用溶胶-凝胶法制备微孔玻璃,首先通过控制pH值、乙醇用量、温度等参数来得到适宜的干凝胶,干凝胶在高温下熔融形成玻璃体后,依次进行分相和酸浸析处理后得到微孔玻璃.结果表明:在pH值1~2、凝胶温度50 ℃、熔融温度1 175 ℃条件下,可以得到孔径集中在0.7~2.0 nm的微孔玻璃;随着盐酸浓度的升高,微孔玻璃的平均孔径逐渐增大,而孔体积和比表面积则逐渐减小;微孔玻璃对N2/CO2具有较高的吸附选择性,分离因子可达8.4以上.
溶胶-凝胶;微孔玻璃;吸附分离;CO2
为了减轻弱酸性气体CO2对设备和管路的腐蚀,天然气在储运之前需要进行脱碳处理.对于温室气体CO2的分离与捕集是减少碳排放的主要途径.此外,在燃料电池、化肥工业、空气分离、密闭环境等领域也都有分离CO2的要求.吸附分离技术具有流程简单、能耗低、操作弹性大、易自动化、无腐蚀等优点,在分离CO2方面具有显著的优势,吸附剂是吸附分离CO2的核心.已经得到工业化应用的硅胶因对水分比较敏感,因此需要对原料气进行干燥脱水处理[1];以13X为代表的沸石分子筛对CO2具有较高的吸附选择性,但对水分更为敏感[2-3];具有非极性表面的活性炭具有较好的耐水性,但其吸附选择通常比较低[4-5];近年来新兴的有机胺修饰吸附剂有很高的吸附选择性和耐水性,其再生性能和循环稳定性有待于进一步研究和提高[6-8].
多孔玻璃具有耐水性好、易再生、耐酸、耐高温和强度高等优点,非常适合分离CO2.基于物理吸附的吸附剂,微孔尺度的孔结构具有更高的吸附选择性[5].研究报道的多孔玻璃,其孔径一般都是中孔或大孔.以多孔玻璃作为纳米颗粒Pd的载体时,孔径在3.75,nm左右可有效提高对Pd的负载量,并使Pd具有很好的催化活性[9];孔径在2.4~4.2,nm的多孔玻璃膜对CO2/C3H8体系具有很好的选择透过性[10];Liu 等[11]通过多孔玻璃膜产生微气泡来促进废水处理,多孔玻璃膜的孔径在100,nm左右;Liu等[12]制备的多孔玻璃材料孔径达到100,µm,它具有很好的机械强度,是一种理想的异体骨移植材料.基于有关微孔玻璃的研究鲜有报道,笔者采用溶胶-凝胶法来制备具有微孔结构的多孔玻璃,并对其吸附分离N2/CO2的性能进行了初步探索.
1 实 验
1.1 微孔玻璃制备
溶胶-凝胶法制备微孔玻璃的步骤如下.
(1) 干凝胶制备.首先,将正硅酸乙酯按一定比例溶于乙醇,并添加少量三乙醇胺,搅拌均匀形成溶液A;将一定量氢氧化钠溶于13.5%的硼酸溶液中,加入硝酸调节pH值至6左右,形成溶液B.室温下,将溶液B滴加到溶液A中,形成胶体溶液,然后添加硝酸调节pH值,继续搅拌2,h;将溶胶液放置在恒温水浴槽中凝胶,以0.1,℃/min从室温升至120,℃,在120,℃保温12,h,接着以2,℃/min升温至480,℃,在480,℃保温12,h.干燥后得到干凝胶.
(2) 玻璃体制备.将干凝胶在氦气气氛下,以5,℃/min的速度升温至给定温度下熔融3,h,随后在氦气气氛下降至室温,得到玻璃体.
(3) 分相处理.在氦气气氛下以5,℃/min的速度将玻璃体升温至一定的温度进行分相处理,在分相温度下保温24,h,保温结束后,将玻璃体直接放入水中进行快速冷却.
(4) 酸浸析.将分相后的玻璃体研磨至140~200目,在100,℃下用盐酸溶液浸析12,h,经洗涤干燥后即可得到微孔玻璃.
1.2 表 征
测定微孔玻璃77,K时对氮气的吸附等温线,分别用BET法和DFT法计算比表面积SBET和孔径分布.对于具有Ⅰ型或Ⅳ型等温线的多孔材料来说,在当吸附压力接近氮气的饱和蒸汽压时,可认为被吸附的氮气填满了其孔隙,吸附相密度等于液氮的密度,因此微孔玻璃的孔体积V计算式为

式中:Lρ为液氮的密度,Lρ=0.808,g/mL;n0.98为相对压力等于0.98时的吸附量.
采用2950-热重分析仪对样品进行热重分析.1.3 吸附分离实验
吸附分离实验装置如图1所示.将吸附床置于水槽内,控制温度在25,℃,以氦气(纯度>99.99%)为载气,混合气He/CO2/N2(体积分数分别为56.2%、23.5%、20.3%)为原料气,采用质量流量计控制流量为65,mL/min,质谱仪检测分析尾气组成,测定各组成的吸附穿透曲线.通过对进出吸附床层气体进行物料衡算,可分别计算出CO2和N2的吸附量,进而计算出其分离因子,有关计算过程见文献[5].
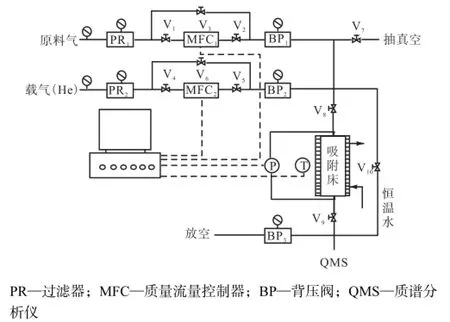
图1 穿透曲线测定装置简图Fig.1Schematic diagram of the setup to collect breakthrough curves
2 结果及讨论
2.1 干凝胶制备
干凝胶的制备是合成微孔玻璃的关键步骤,通过控制pH值、乙醇用量、温度等参数才能得到质地均匀的干凝胶.以下将对这些因素进行分析和探讨.2.1.1 pH值的影响
理想的溶胶和凝胶质地均匀、透明,pH值的大小直接影响了溶胶和凝胶的质量.从表1可以看出,随着酸性的增强,溶胶由浑浊逐渐变透明,pH值在1~2时可得到质地均匀的透明溶胶,其凝胶也透明、均匀.进一步增强酸性,则开始变浑浊,并出现沉淀.这是由于正硅酸乙酯水解需要氢离子作为催化剂,在酸性较弱时,正硅酸乙酯不能充分水解而使溶液浑浊;当pH值小于1时,强酸环境使得硼酸析出导致溶胶变浑浊,并出现沉淀.因此,在溶胶和凝胶过程中控制pH值在1~2.

表1 pH值对溶胶-凝胶的影响Tab.1 Influence of pH on the quality of sol-gel
2.1.2 乙醇用量的影响
乙醇对溶胶-凝胶过程有两方面的影响.一方面,乙醇对正硅酸乙酯的水解过程有明显的抑制作用,如图2所示,保持水的用量不变,随着乙醇用量的增加,不仅使凝胶时间显著增加,并且在凝胶过程中会有一部分乙醇被包裹在凝胶中,在干燥时乙醇的挥发会导致结构破坏,使凝胶质量下降;另一方面,乙醇能够溶解硼酸,足量的乙醇能使溶胶-凝胶过程中溶液保持清澈透明,当乙醇用量不足时,因硼酸不能被充分溶解而使溶液出现混浊,溶胶凝胶质量下降.综合考虑凝胶质量和凝胶时间,乙醇的适宜用量为20,g.

图2 凝胶时间随乙醇用量的变化曲线Fig.2 Relationship between the time of gel process and the amount of alcohol
2.1.3 凝胶温度的影响
凝胶是分子缓慢排列重组的过程,凝胶温度直接影响凝胶速率和效果,随着凝胶温度的升高,分子的动能增大,凝胶过程加速,因此随凝胶温度的升高,凝胶时间快速缩短,如图3所示.然而,过高的凝胶温度会使溶剂挥发加剧,当凝胶温度为80,℃时,尽管其凝胶时间缩短至5,h,但其凝胶液开始出现混浊,凝胶效果不佳.
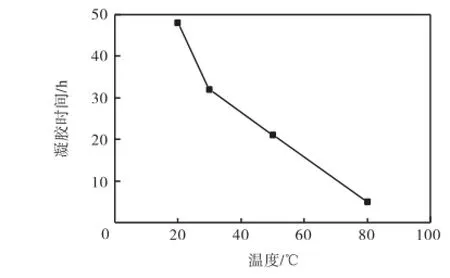
图3 凝胶温度对凝胶时间的影响Fig.3Relationship between time and temperature duringthe gel process
2.1.4 干燥过程的影响
对凝胶进行脱水干燥过程中,干燥温度会直接影响干凝胶的质量.从图4中可以看出,从常温升至120,℃左右,凝胶有一个急剧的失重过程,这是由凝胶表面自由态的水和乙醇急速挥发造成的;随着温度的进一步升高,表面的溶剂挥发完毕,溶胶内部的溶剂开始逐步挥发出来,因此凝胶质量呈现出一个缓慢减少的趋势;当温度上升至480,℃左右,凝胶质量不再变化,表明凝胶中的水分和有机成分全部被去除,形成干凝胶.由此可见,在干燥过程中,从室温升至120,℃需要缓慢升温,并需要在该温度下保温一段时间,随后可以相对较快的速度升温至480,℃,并在480,℃下保温一定的时间.

图4 凝胶的热重分析曲线Fig.4 TGA curve of gel
2.2 熔融温度的影响
干凝胶在高温下经过充分熔融后才能得到玻璃体,熔融温度会直接影响玻璃体的均匀性.从表2可以看出,当熔融温度达到1,175,℃时,干凝胶才能完全熔融,低于这个温度只能部分熔融,甚至根本就不能熔融;当温度升达1,200,℃时,玻璃内部出现了气泡,这是因为在该温度下液态玻璃开始沸腾,在降温过程中有气泡保留在玻璃体内.可见,适宜的熔融温度为1,175,℃,比传统方法制备玻璃体的熔融温度(1,400,℃)低了225,℃.

表2 不同熔融温度下玻璃体的形态Tab.2 Properties of glass molten at various temperatures
2.3 分相温度的影响
分相处理的玻璃体经酸浸析后可以形成多孔玻璃,分别在550,℃、595,℃和630,℃下进行分相处理,用1,mol/L的盐酸进行酸浸析.从图5(a)中可以看出样品的吸附等温线均为Ⅰ型等温线,表明多孔玻璃具有微孔结构.孔径分布计算结果如图5(b)所示,3个样品的孔径主要集中在0.7~2.0,nm之间,适合于吸附分离CO2.从表3可以看出,适宜的分相温度为630,℃,在该温度下分相得到的多孔玻璃具有较高的比表面积和孔体积.
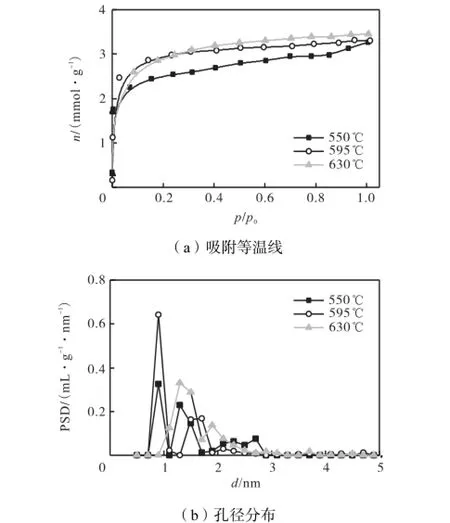
图5 不同分相温度下多孔玻璃在77,K对氮气的吸附等温线及孔径分布Fig.5 N2adsorption isotherms at 77 K and pore size distribution of the porous glass samples treated under various phase separation temperatures

表3 分相温度对微孔玻璃的影响Tab.3 Effect of phase separation temperature on microporous glass
2.4 酸浓度的影响
酸浸析过程是形成多孔玻璃的关键所在.玻璃体在630,℃下分相后分别在不同的酸浓度下浸析,如图6所示,当酸浓度较低时,多孔玻璃具有Ⅰ型等温线,随着酸浓度的升高,吸附等温线从Ⅰ型逐渐转化为Ⅳ型等温线,产生明显的脱附回线.这表明随着酸浓度的增大,玻璃体中的孔隙由微孔尺度增大到中孔尺度.
酸浸析过程中,盐酸浓度的变化会带来两方面的影响.一方面,随着酸浓度增加,非SiO2相溶解得更彻底,使微孔玻璃的平均孔径变大,孔体积增大;另一方面,部分二氧化硅在酸性条件下会转化为原硅酸,酸浓度越高,原硅酸的溶解度却越小,沉积在孔道内的原硅酸就越多,使多孔玻璃的孔体积降低.两方面的影响使得多孔玻璃的平均孔径随酸浓度增大而增大,孔体积和比表面积则随着酸浓度的增加而减小.适宜的盐酸浓度为0.2,mol/L,在该浓度下酸浸析得到的多孔玻璃比表面积最高,达270,m2/g左右.

图6 不同酸浓度下多孔玻璃在77 K对氮气的吸附等温线及孔径分布Fig.6N2adsorption isotherms at 77 K and pore size distribution of the porous glass samples leached by various concentrations of hydrochloric acid
2.5 吸附分离性能
吸附分离CO2要求吸附剂具有较高的比表面积和较小的孔径尺寸,因此选择分相温度为630,℃、盐酸浓度为0.2,mol/L时制备的微孔玻璃样来测定其吸附穿透曲线,如图7所示.随着吸附压力增大,氮气和二氧化碳的吸附量就会增大,因此吸附穿透时间变长.从图8可以看出,微孔玻璃的分离因子在8.4以上,明显高于硅胶和活性炭的活性因子,具有较好的开发前景,有待于进一步研究开发.

图7 微孔玻璃的穿透曲线Fig.7 Breakthrough curves of microporous glass
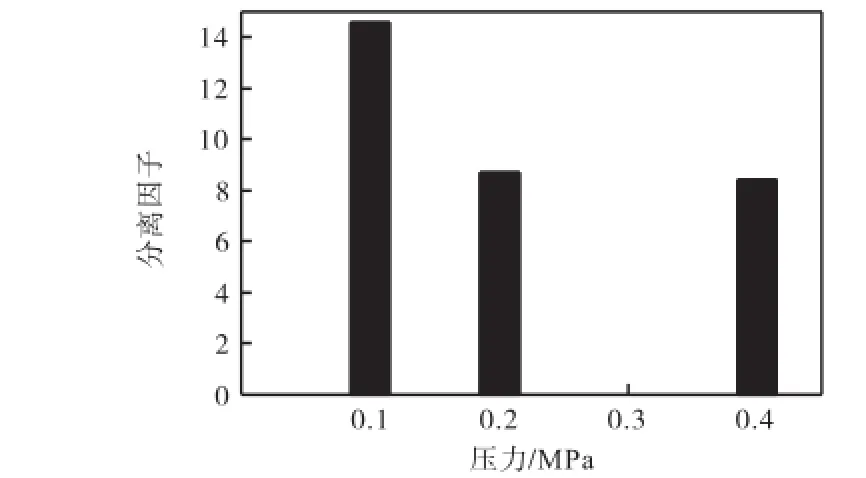
图8 吸附压力对分离因子的影响Fig.8 Effect of adsorption pressure on the separation factor
3 结 论
本文采用溶胶-凝胶法制备微孔玻璃,不仅考察了制备过程中多个因素的影响,还测定了其对N2/ CO2混合气的吸附分离性能.得到结论如下.
(1) 制备凝胶的适宜操作条件为:pH值在1~2,乙醇用量为20,g,凝胶温度为50,℃.
(2) 玻璃体的最佳熔融温度为1,175,℃,最佳分相温度为630,℃.
(3) 酸浸析过程中,随着盐酸浓度的升高,微孔玻璃的平均孔径逐渐增大,而孔体积则逐渐减小.
(4) 微孔玻璃对N2/CO2具有较高的吸附选择性,分离因子达8.4以上.
[1] 梅 华,陈道远,姚虎卿,等. 硅胶的二氧化碳吸附性能及其与微孔结构的关系[J]. 天然气化工,2004,29(5):21-25.
Mei Hua,Chen Daoyuan,Yao Huqing,et al. CO2adsorption performance of silica gel and its relationship with microporous structure [J]. Natural Gas Chemical Industry,2004,29(5):21-25(in Chinese).
[2] Dantas T L P,Luna F M T,Silva I J Jr,et al. Carbon dioxide-nitrogen separation through pressure swing adsorption [J]. Chemical Engineering Journal,2011,172(2):698-704.
[3] Su Fengsheng,Lu Chungsying. CO2capture from gas stream by zeolite 13,X using a dual-column temperature/vacuum swing adsorption [J].Energy Environ Sci,2012,5(10):9021-9027.
[4] Johanna S,Nathalie C,Ronny P,et al. Pure and binary adsorption of CO2,H2,and N2on activated carbon [J]. Adsorption,2012,18(1):49-65.
[5] Zhang Zhongzheng,Ruan Hongzheng,Su Wei,et al. A research note on the adsorption of CO2and N2[J]. Chinese Journal of Chemical Engineering:the English Version,2011,19(5):733-737.
[6] Harlick P J E,Abdelhamid S. Applications of poreexpanded mesoporous silicas(3):Triamine silane grafting for enhanced CO2adsorption [J]. Industrial and Engineering Chemistry Research,2006,45(9):3248-3255.
[7] Yang S T,Kim J Y,Kim J,et al. CO2capture over amine-functionalized MCM-22,MCM-36 and ITQ-2 [J]. Fuel,2012,97:435-442.
[8] Khatri R A,Chuang S S C,Soong Y,et al. Thermal and chemical stability of regenerable solid amine sorbent for CO2capture [J]. Energy and Fuels,2006,20(4):1514-1520.
[9] Shen C,Wang Y J,Xu J H,et al. Size control and catalytic activity of highly dispersed Pd nanoparticles supported on porous glass beads [J]. Langmuir,2012,28(19):7519-7527.
[10] Markovic A,Stoltenberg D,Enke D,et al. Gas permeation through porous glass membranes [J]. Journal of Membrane Science,2009,336(1/2):17-31.
[11] Liu Chun,Tanaka H,Zhang Lei,et al. Fouling and structural changes of Shirasu porous glass(SPG)membrane used in aerobic wastewater treatment process for microbubble aeration [J]. Journal of Membrane Science,2012,421/422:225-231.
[12] Liu Xin,Rahaman M N,Fu Qiang,et al. Porous and strong bioactive glass(13-93)scaffolds prepared by unidirectional freezing of camphene-based suspensions [J]. Acta Biomater,2012,8(1):415-423.
(责任编辑:田 军)
Preparation of Microporous Glass and Its Application to N2/CO2Separation
Su Wei1,2,Hu Peng1,Fu Xingliang1,Sun Yan3
(1. School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China;2. Tianjin Key Laboratory of Membrane and Desalination Technology,Tianjin 300072,China;3. School of Sciences,Tianjin University,Tianjin 300072,China)
Adsorption separation processes are suitable for the separation of CO2, and the development of an efficient adsorbent to separate CO2at ambient temperatureis still a challenge to be faced. Microporous glass was synthesized by a sol-gel method. The dry gel was prepared by controlling the pH, ethanol amount, temperature and so on. Then, it was melted at a high temperature to get glass precursors and the micropores were developed by phase separation and acid treatment. Results show that the pore size of microporous glass was mainly distributed from 0.7 nm to 2.0nm when the pH was 1—2, the gel temperature was 50 ℃ and themelting temperature was 1 175 ℃. Wider pores could be obtained with a higher concentration of hydrochloric acid. However,the pore volume and specific surface area were decreased. The microprous glass had a high adsorption selectivity for N2/CO2and the separation factor was higherthan 8.4.
sol-gel;microporous glass;adsorption separation;CO2
TQ171
A
0493-2137(2014)10-0923-05
10.11784/tdxbz201310031
2013-10-12;
2013-12-09.
国家自然科学基金青年基金资助项目(21206108);天津市应用基础与前沿技术研究计划资助项目(14JCYBJC21200).作者简介:苏 伟(1974— ),男,博士,副研究员,suweihb@tju.edu.cn.
孙 艳,sytju@163.com.
时间:2014-03-28.
http://www.cnki.net/kcms/doi/10.11784/tdxbz201310031.html.

