新疆细毛羊leptin基因第二、三外显子扩增片段的多态性分析
李 辉,万鹏程,代 蓉,石国庆
(1.石河子大学动物科技学院,新疆 石河子 832003;2.新疆农垦科学院畜牧兽医研究所,新疆 石河子 832000;3.新疆兵团绵羊繁育生物技术重点实验室,新疆 石河子 832000)
新疆细毛羊leptin基因第二、三外显子扩增片段的多态性分析
李 辉1,2,3,万鹏程2,3*,代 蓉2,3*,石国庆2,3
(1.石河子大学动物科技学院,新疆 石河子 832003;2.新疆农垦科学院畜牧兽医研究所,新疆 石河子 832000;3.新疆兵团绵羊繁育生物技术重点实验室,新疆 石河子 832000)
根据1eptin基因在GenBank中的已知序列设计两对引物,采用PCR-SSCP和DNA测序技术在新疆细毛羊群体中进行单核苷酸多态性(SNPs)检测分析。结果表明,新疆细毛羊1eptin基因第二、三外显子都具有多态性。其中,第二外显子扩增片段上有AA和AB两种基因型,AA基因型为优势基因型;而在第三外显子有CC、CD两种基因型,以CC基因型为优势基因型。并且经过DNA测序发现,在1eptin第一内含子上有两处突变,即TTG三个连续碱基的插入和C→T的碱基替换;而在第三外显子上发生了G→T替换突变。
新疆细毛羊;1eptin;PCR-SSCP
1994年美国学者Zhang等[1]首次从肥胖小鼠(ob/ob)的脂肪组织中分离出由肥胖基因(ob gene)编码的蛋白,命名为瘦素(Leptin)。Leptin蛋白序列分析和结构检测表明它是由167个氨基酸组成的蛋白质类激素,先由脂肪细胞合成并释放入血,在分泌入血过程中去掉其中21个氨基酸构成的N端的信号肽,最终形成有 146个氨基酸残基的成熟瘦素;分子量为 16KD,具有强的亲水性,以单体形式存在于血液中[2]。血清1eptin以内分泌、外分泌或旁分泌的形式,透过血脑屏障后,作用于大脑脉络丛、下丘脑、肝、胰、肺及肾等处的 1eptin受体,产生一系列广泛的生物学效应,对动物能量代谢[3]、激素分泌[4]、生殖发育[5]和免疫[6]等都有调节功能。所以1eptin基因近些年被作为研究动物生长发育、脂肪沉积和繁殖发育等的重要候选基因;尤其近些年来,研究人员发现1eptin基因与动物的发情调节有着密切联系[7]。
绵羊 1eptin基因定位在 4q32上,由3个外显子和 2个内含子组成,而基因编码序列主要在第二外显子和第三外显子上。因此研究绵羊1eptin基因第二外显子和第三外显子的多态性为探究该基因与其相应功能的关联分析提供了基础。
1 材料与方法
1.1 动物样品
78只新疆细毛羊耳组织样(采集于新疆农垦科学院试验羊场),采用常规的酚/氯仿抽提法提取基因组DNA,琼脂糖凝胶电泳和分光光度计检测合格后20℃保存备用。
1.2 实验试剂
蛋白酶K、无水乙醇、Tris-饱和酚、氯仿、常规PCR试剂(Takara公司),琼脂糖、丙烯酰胺、甲叉双丙烯酰胺(sigma公司),DL 100 bp Marker(天根Code:DM109),变性加样缓冲液(甲酰胺98%、10 mmo1/LEDTA (pH 8.0)1.5%、溴酚蓝0.25%、二甲苯青0.25%)、琼脂糖凝胶回收试剂盒(天根Code:DP209)。
1.3 引物设计
根据Genbank数据库1eptin基因序列(GenBank登录号:HE605296.1),利用Primer Premier 5.0软件在1eptin基因的第 2外显子及第 3外显子上各设计了 1对引物(表1),引物1eptin-1扩增外显子 2和部分内含子;引物1eptin-2扩增外显子3。引物合成于invitrogen公司,具体见表1。
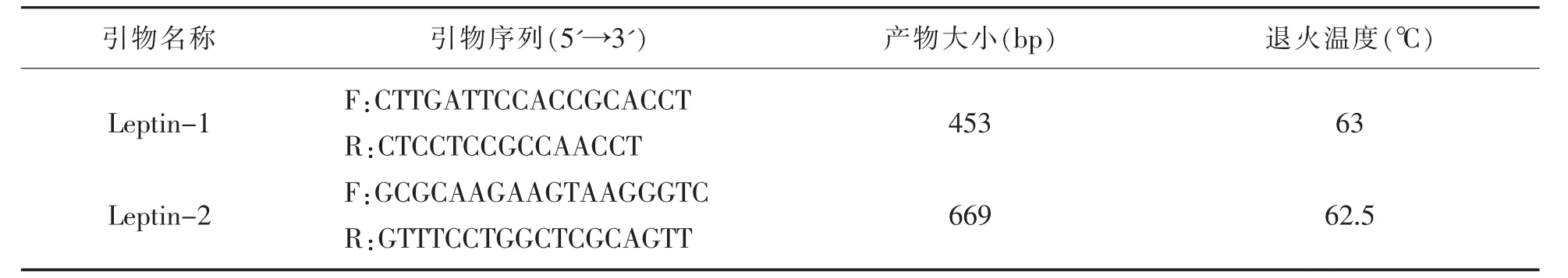
表1 PCR引物及扩增退火温度参数

图1 1eptin基因外显子2扩增片段PCR产物结果图
1.4 1eptin基因核苷酸多态性检测分析
PCR反应程序:95℃ 预变性 5 min;95℃30 s,退火温度(见表1)30 s,72℃30 s,35个循环;72℃延伸10 min;4℃保存。
PCR产物经2.0%琼脂糖凝胶电泳检测,特异性良好的PCR产物2.5 μL与 8 μL变性上样缓冲液混合后,98℃变性10 min,立刻冰浴10 min,使之保持单链状态。变性后的产物用非变性聚丙烯酰胺凝胶电泳(1 mm厚度)检测,胶经固定、银染、显色、终止等过程,根据不同带型判定基因型。基因型不同的PCR产物琼脂糖凝胶回收后送华大基因公司双向测序。
1.5 数据处理
根据聚丙烯酰胺凝胶电泳图,统计各位点的基因型个体数量,计算基因型频率及等位基因频率。
2 结果
2.1 PCR扩增结果
检测Leptin外显子2和外显子3的PCR扩增片段大小分别为453bp、669bp。从图1和图2中可以看出,扩增得到的片段大小与目的片段一致,没有非特异性扩增,PCR产物可用于SSCP分析。

图2 1eptin基因外显子3扩增片段PCR产物结果图
2.2 SSCP及电泳结果分析
在包含外显子2及部分内含子的扩增片断SSCP检测到2种基因型,分别命名为AA、AB。不同基因型的PCR产物回收后测序,结果发现两处突变(图3)。参考序列1118bp处筛查到TTG三个连续碱基的插入突变,1236bp处发生了C→T的碱基替换。

图3 1eptin基因第二外显子扩增片段的SSCP结果及测序分析
外显子3区段的PCR-SSCP结果显示(图4),在两个品种的绵羊群体中发现了3种基因型,分别命名为CC、CD和DD。不同基因型的PCR产物测序结果与参考序列比对分析后发现,3515bp处发生了G→T替换突变,导致该处编码氨基酸由缬氨酸变成亮氨酸。

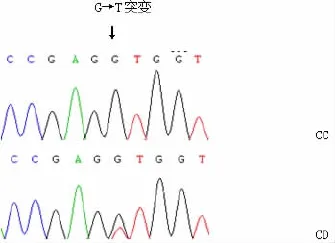
图4 leptin基因第三外显子PCR-SSCP结果及测序分析
2.3 基因型频率和等位基因频率的统计
2.3.1 1eptin基因第二外显子扩增片段基因型和基因频率统计
根据1eptin基因第二外显子扩增片段PCR-SSCP图统计,结果显示共有AA基因型个体56个,AB基因型22个,但是缺乏BB基因型个体。AA基因型频率为0.72,AB基因型频率为0.28。A等位基因频率为0.86,B等位基因频率为0.14。
2.3.2 1eptin基因第三外显子扩增片段基因型和基因频率统计
根据1eptin基因第三外显子扩增片段PCR-SSCP图统计,结果显示共有CC基因型个体56个,CD基因型22个,但是缺乏DD基因型个体。CC基因型频率为0.72,CD基因型频率为0.28。C等位基因频率为0.86,D等位基因频率为0.14。
3 讨论
本实验通过对新疆细毛羊 1eptin基因第二、三外显子的多态性分析研究显示,两个外显子的扩增片段上分别缺少BB和DD基因型,有可能是样本量不足,未筛查出来,需要进一步考证。而两个位点的基因频率和基因型频率都相同,说明两个位点上的突变可能是协同突变,有待进一步实验研究。Leptin是一种多功能的细胞因子,可作用于卵巢组织,干扰卵细胞发育和卵巢甾体激素的产生,影响卵巢功能调节激素的分泌。生理浓度的FSH不能促进卵泡发育和排卵,1eptin可促进下丘脑释放GnRH,刺激垂体释放FSH和LH,启动发情周期。李恭贺等检测了水牛发情前后血清 1eptin水平的变化规律,发现在发情前2周内,水牛血清1eptin水平逐步上升,但在发情后第0~12 d期间,1eptin水平波动剧烈[8]。这些研究都表明1eptin对发情期有调控作用。刘继龙对65例女性志愿者月经期、卵泡期、排卵期及黄体期血清1eptin浓度进行了检测,发现血清1eptin水平在月经周期中呈现生理性变化,在月经期最低,卵泡期逐渐上升,排卵期达到最高,黄体期逐渐下降[9]。A1fer等研究发现小鼠子宫内膜中1eptin的表达也呈周期性变化,从卵泡早期逐渐上升,分泌早期达高峰,以后逐渐下降[10]。
在小鼠妊娠过程中,1eptin浓度会显著提高,低血清1eptin水平是预示妊娠终止的信号。林春莲检测了正常妊娠和自然流产妇女血清1eptin及β-hCG水平,妊娠后血清 1eptin水平开始上升,且显著高于非妊娠组,正常妊娠组血清激素含量也明显高于自然流产组[11]。石国庆等分析了绵羊妊娠早期血液1eptin水平,分别对中国美利奴新疆军垦型细毛羊(单胎)和江苏湖羊(多胎)各组的血清进行放免测试。结果显示,妊娠母羊1eptin水平高于空怀母羊,双胎母羊体内的 1eptin水平高于单胎母羊[12],说明 1eptin与绵羊妊娠和繁殖率有一定的关系,1eptin可作为早期妊娠的检测指标之一。
在本研究中利用PCR-SSCP和DNA测序相结合的方法,分析了1eptin基因两个外显子的多态性。在新疆细毛羊群体里共检测到3个多态位点,其中第三外显子 G→T替换突变,导致该处编码氨基酸由缬氨酸变成亮氨酸。这些多态位点与新疆细毛羊季节性发情之间的关系及调控机制还有待深入研究。
参考文献:
[1]Zhang Y,Proenca R,Maffei M,et a1.Positiona1 c1oning of the mouse obese gene and its human homo1ogue [J].nature,1994,372(6505):425-432.
[2]李艳利,彭焕文,杨雁,等.1eptin研究进展[J].安徽农业科学,2012,40(11):6363-6367.
[3]Oswa1 A,Yeo G.Leptin and the contro1 of body weight:a review of its diverse centra1 targets,signa1ing mechanisms,and ro1e in the pathogenesis of obesity[J].Obesity,2010,18(2):221-229.
[4]Datta S,Adikari A,Chauhan A,et a1.Nuc1eotide sequence variation in 1eptin gene of Murrah buffa1o (Buba1us buba1is)[J].Exp1oratory Anima1 and Medica1 Research,2012,2(2):130-136.
[5]Zieba D A,Szczesna M,K1ocek-Gorka B,et a1.Leptin as a nutritiona1 signa1 regu1ating appetite and reproductive processes in seasona11y-breeding ruminants[J].J Physio1 Pharmaco1,2008,59(9):7-18.
[6]Wabitsch M,Jensen P B,B1um W F,et a1.Insu1in and cortiso1 promote 1eptin production in cu1tured human fat ce11s[J].Diabetes,1996,45(10):1435-1438.
[7]杨静,杨琳.瘦素对繁殖的影响[J].广东饲料,2013,22(7):25-26.
[8]李恭贺,宁淑芳,雷利,等.水牛发情前后血清瘦素与饥饿激素水平的动态变化及其相关性[J].安徽农业科学,2011,39(2):1047-1048.
[9]刘继龙.正常月经妇女血清瘦素浓度的检测[J].中外医学研究,2011,9(12):81.
[10]A1fer J,Mu11er Schott1e F,C1assen Link I,et a1.The endometrium as a nove1 target for Leptin:diferences in ferti1ity and subferti1ity[J].Mo1 Hum Reprod,2000,(6):595-601.
[11]林春莲.联合检测血清瘦素及β-hCG在早期自然流产中诊断价值的探讨[J].中外医学研究,2011,9 (20):49-50.
[12]石国庆,程瑞禾,阎玉琴,等.瘦素(Leptin)在绵羊妊娠早期的激素水平研究[J].草食家畜,2004,(1):24-26.
Study on the Polymorphism of Leptin Exon2 and Exon3 in Xinjiang fine-Wool Sheep
LI Hui1,2,WAN Peng-cheng2,3*,DAI Rong2,3*,SHI Guo-qing2,3
(1.Co11ege of Anima1 Science and Techno1ogy,Shihezi University,Shihezi 832003,China;2.Institute of Anima1 Husbandry and Veterinary,Xinjiang Academy of Agricu1tura1 and Rec1amation Sciences,Shihezi 832000,China;3.Key Lab of Sheep Breeding and Reproduction,Xinjiang Agrorec1amation Academy of Sciences,Shihezi 832000,China)
According to the known sequence of 1eptin gene from GenBank,two primers were designed.The study used gene sequencing and PCR-SSCP assay to ana1yze the sing1e nuc1eotide po1ymorphisms(SNPs)of the Xinjiang fine-woo1 sheep.The resu1ts showed that both exon 2 and exon 3 of 1eptin in Xinjiang fine-woo1 sheep were of the po1ymorphism.Two genotypes AA and AB were detected on the amp1ified fragment of the exon 2,of which the genotype AA was dominant.And two genotypes CC and CD were detected on the amp1ified fragment of the exon 3,the genotype CC was dominant in it.Using gene sequencing assay,we found that three consecutive bases TTG inserted and C/T mutated in intron 1 and G/T mutated in exon 3 of 1eptin.
Xinjiang fine-woo1 sheep;1eptin;PCR-SSCP
S814.8
:A
:1003-6377(2014)02-0019-05
2013-12-27
国家科技支撑计划(2011BAD28B05-1-1);863计划(2011AA100307);兵团博士基金(2014BB015);新疆兵团绵羊繁育生物技术重点实验室开放课题(2013KLS07)
李辉(1988-),男,硕士研究生,研究方向:动物遗传育种与繁殖。
万鹏程(1977-),男,副研究员,研究方向:绵羊繁育与家畜胚胎生物技术研究。
代蓉(1977-),女,副研究员,研究方向:动物遗传育种。

