不可逆电穿孔消融兔胆囊侧肝脏病理学观察
梁冰,牛立志,曾健滢,周亮,周序珑,方刚,姚飞,邓春娟,汪媛,张波,李书英,邓春梅,杨惠霏,李家亮,刘建国,徐克成
·实验研究Experimental research·
不可逆电穿孔消融兔胆囊侧肝脏病理学观察
梁冰,牛立志,曾健滢,周亮,周序珑,方刚,姚飞,邓春娟,汪媛,张波,李书英,邓春梅,杨惠霏,李家亮,刘建国,徐克成
目的研究靠近胆囊0.5 cm处不可逆电穿孔肝脏消融的安全性和有效性。方法采用新西兰白兔3只作为实验动物,在靠近胆囊0.5 cm处肝脏进行不可逆电穿孔消融,并于7 d后观察消融区域的肝脏病理反应和胆囊损伤情况。结果3只动物均成功完成消融。消融7 d后,肝脏面原消融区平均直径3.00 cm黄色坏死灶,肝膈面形成1个平均直径1.67 cm类圆形黄色坏死灶。2只实验兔消融部位和腹壁、1只肝叶和膈肌发生小片段浅度粘连。2只肠系膜则与胆囊消融灶区发生严重粘连。光镜下可见肝大片坏死且消失,仅有部分凝固性坏死肝组织残留,外围有少量斑点状钙化,炎性肉芽组织和小胆管显著增生。肝门静脉血管平滑肌损伤不明显,肌层小范围纤维素样变性、胆囊黏膜上皮大部分坏死,胆囊外结缔组织水肿、胆总管部分黏膜上皮坏死,部分上皮仍存在,肌层完好。结论消融部位肝脏组织完全坏死,消融灶和周围组织分界明显,胆囊出现损伤,但无胆囊漏发生。因此,对于靠近胆囊的肝脏肿瘤而言,不可逆电穿孔可能是一种相对安全有效的选择。
肝脏;不可逆电穿孔消融;胆囊;兔
我国是原发性肝癌的高发国家,病死率占恶性肿瘤的第2位[1]。肿瘤手术切除是目前肝癌患者获得长期生存乃至根治的主要方法之一,但能获得手术切除的患者低于20%。对于不可切除的肝癌,化疗已成为最主要的治疗手段,但由于可能的不良反应,化疗的疗效仍然有限。近年来,微创外科和肿瘤局部治疗的兴起为肝癌的治疗开辟了新的方向。目前,射频消融[2]、微波消融[3]、冷冻消融[4]和不可逆电穿孔[5]都已成功用于治疗肝癌。其中,不可逆电穿孔是最近刚开始在临床应用的肿瘤消融新技术,该技术利用高压直流电发出的强大电场的作用,在细胞膜上产生多个细孔从而不可逆转地破坏细胞,导致即时肿瘤细胞死亡[6-7]。由于消融产生在细胞膜上的细孔为纳米级别的空洞,该技术又被称为纳米刀。对于肝脏肿瘤消融,对靠近隔膜穹顶第一肝门和邻近胆囊部位的肿瘤进行消融,由于可能会引发严重的并发症,一直是经皮穿刺消融肝脏肿瘤的难点甚至是禁忌[8]。由于不可逆电穿孔具有消融范围明确、消融时间短、对神经和血管具有保护作用的优点,在肝脏肝门和胆囊等关键部位的消融可能具有一定优势。因此,本研究在白兔肝脏靠近胆囊0.5 cm处进行不可逆电穿孔消融,观察消融7 d后肝脏情况和胆囊的病理损伤,以探讨不可逆电穿孔对于靠近胆囊的肝脏消融的有效性和安全性。
1 材料与方法
1.1 材料
1.1.1 实验动物雌性普通级新西兰兔3只,体重2.5~30 kg,由南方医科大学实验动物中心提供,动物生产许可证号[SCXK(粤)2011-0015],动物合格证号[粤监证字44002100000654]。
1.1.2 主要实验器械和药品试剂AngioDynamics纳米刀系统(美国AngioDynamics公司),包括主机、长15 cm和有效距离0~4 cm的纳米刀电探针(美国AngioDynamics公司,批号20400104);监护仪(荷兰Philips公司,型号M8001A),ID3.0气管导管购自泰科医疗器材国际贸易(上海)有限公司(批号为11004113042)、ENT-1001婴儿型呼吸囊购自台湾-彦大有限公司(批号为20100426)、阿托品购自天津药业集团新郑股份有限公司(批号为715765U),盐酸氯胺酮注射液购至福建古田药业有限公司(批号为H35020148)。盐酸戊己奎醚(长托宁)注射液购至城都力思特制药(批号为120607)公司,维库溴铵粉针剂购自浙江仙琚药业(批号为130303),硫酸阿托品注射液购自徐州莱恩药业(批号为1211112),新斯的明注射液购自上海信谊金朱药业(批号120802)。
1.2 方法
1.2.1 术前准备及麻醉动物禁食24 h,禁水12 h。术前在实验兔腿部肌内注射阿托品(0.02mg/kg)及盐酸氯胺酮注射液(44 mg/kg)诱导麻醉后,家兔仰卧位固定,在剑骨突后缘至耻骨前缘备皮,行气管切开后置入ID 3.0号气管导管,肌内注射维库溴铵0.12mg/kg。选用婴儿型呼吸囊控制呼吸,控制潮气量为50 ml,呼吸频率为30~50次/min,呼吸比为1∶1和氧分压为100%。开腹前按体重44mg/kg后腿肌肉注射氯胺酮注射液以维持麻醉。手术结束,自肌内注射维库溴铵30min后给予阿托品、新斯的明各0.1 mg拮抗肌肉松弛,30 min重复1次。
1.2.2 纳米刀消融步骤动物麻醉后开腹,暴露肝左上叶,直视下将纳米刀电探针1(P+)和探针2(P-)垂直插入肝脏面0.5 cm,2针距离1.5 cm,使与胆囊壁距离为0.5 cm,设置探针有效距离为0.5 cm,起始电压为2 250 V、脉冲长度70 ms和数字脉冲90 Hz后启动系统,消融术程约1 min,电击结束后拔出探针即完成纳米刀消融术。于消融区两端各置一缝线作为标记后结束手术,将脏器回纳腹腔,常规闭腹,待实验动物苏醒后自由饮食,护理期间不给予药物。
1.2.3 术中与术后观察术中观察电消融时肝脏及胆囊表面形态变化,用游标卡尺测量并记录组织表面消融区域最大半径。术后第7天对实验兔实行安乐死,观察肝脏与胆囊消融区域及周边脏器形态变化。
1.2.4 病理检查取组织标本置甲醛中固定24 h以上,石蜡包埋,梯度乙醇脱水,二甲苯透明,连续切片,厚度5μm,常规苏木精-伊红(HE)染色,封片后镜下观察。
1.3 统计学处理
采用Graphpad Prism 5(GraphPad,USA)软件进行统计学分析。计量数据用平均值±标准偏差(x± s)表示。P<0.05为差异有统计学意义。
2 结果
2.1 术中与术后消融区形态观察
2.1.1 术中肝脏及胆囊形态变化消融过程中未见肝脏和胆囊表面有显著外观改变(图1a),消融结束后肝消融区颜色略深,边缘不清晰,穿刺部位有少量出血,周围组织形态及颜色无异常(图1b)。
2.1.2 术后消融区域及周边脏器形态变化消融7 d后肝膈面原消融区可见一8字型黄色坏死灶,表面最大径平均为3.00 cm,外周有一圈淡粉红色的分隔带,与周围组织分界明显(图1c);肝脏面形成一类圆形黄色坏死灶(图1d),表面最大径平均为1.67 cm。将坏死灶以术中消融区两端缝线作连线,垂直肝叶剖开后,可见坏死灶全层贯穿左肝叶,其他区域肝脏组织未见异常。靠近肝消融区一侧胆囊壁颜色变浅,发白。

图1 不可逆电穿孔肝脏消融过程
2.1.3 粘连情况2只实验兔腹壁、1只肝叶和膈肌与肝膈面消融区发生小片段浅度粘连。2只肠系膜则与胆囊消融灶区发生严重粘连。
2.2 病理组织学观察
2.2.2 肝消融区7 d后组织学观察光镜下可见肝组织大片坏死消失,仅有部分凝固性坏死肝组织轮廓残留,外围有少量斑点状钙化,炎性肉芽组织和残留小胆管显著增生(图2)。
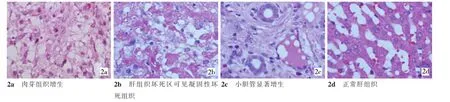
图2 兔肝脏消融7 d后组织学所见(HE,×400)
2.2.3 肝门静脉、胆囊和胆总管消融7 d后组织学观察①肝门静脉血管平滑肌损伤不明显,肌层损伤不理想,小范围纤维素样变性(图3a)。②胆囊黏膜层上皮大部分坏死脱落,小部分仍存在,肌层损伤不明显,胆囊浆膜层充血水肿,少量炎细胞浸润(图3b)。③胆总管部分黏膜上皮坏死,部分上皮仍存在,浆膜层充血水肿,少量炎性细胞浸润(图3c)。
3 讨论
不可逆电穿孔是2012年4月美国FDA批准应用于临床的肿瘤消融新技术。该技术具有以下特点:①不可逆电穿孔可通过诱导细胞凋亡,引发肿瘤组织坏死[9-11]。②与已有的热消融技术如射频消融、微波消融和冷冻消融不同,不可逆电穿孔无需热能,通过改变细胞膜通透性即可导致组织死亡。因此,该法不受热沉效应影响。③不可逆电穿孔可在消融区和非消融区产生明显的边界,这将最大可能的减少对肿瘤组织的损伤,减少并发症的发生。④消融时间短。与传统消融技术(30min~数小时)相比,不可逆电穿孔可在微秒到毫秒治疗时间内有效导致组织死亡。非热细胞死亡及治疗时间显著减少。⑤对神经和大血管的保护作用[12-15]。这使不可逆电穿孔可以在富含大血管或神经的部位消融肿瘤,而不用担心并发症的发生。因此,由于不可逆电穿孔的上述优势,该方法已在肝癌消融方面进行了初步的临床应用,并显示出非常广阔的应用前景[16-17]。

图3 胆囊、肝门静脉、胆囊消融7 d后病理学观察(HE,×40)
由于肝脏组织血供较为丰富,局部微环境差异较大,不同的消融程序对于消融效果影响较大。由于不可逆电穿孔没有“热沉”效应,该技术在治疗接近血管的肿瘤上独具优势[18]。但是,由于不可逆电穿孔的研究尚处于初级阶段,其消融肝脏肿瘤的适应证和禁忌证尚未深入研究。对于不可逆电穿孔来说,靠近膈膜穹顶,第一肝门和邻近胆囊部位的肿瘤消融,也可能会引发膈肌穿孔或胆囊漏发生,需要对其进行深入系统研究。本研究利用新西兰白兔模型,在白兔肝脏靠近胆囊处0.5 cm处进行不可逆电穿孔消融,观察7 d后肝脏的消融情况和胆囊的病理损伤,以探讨不可逆电穿孔对于靠近胆囊的肝脏消融的有效性和安全性。本次研究发现,消融7 d后肝脏面原消融区3.00 cm黄色坏死灶,肝膈面形成1个1.67 cm类圆形黄色坏死灶。外周有一圈淡粉红色的分隔带,与周围组织分界明显。2只实验兔消融部位和腹壁、1只肝叶和膈肌发生小片段浅度粘连。光镜下可见肝大片坏死且消失,仅有部分凝固性坏死肝组织残留,外围有少量斑点状钙化,炎性肉芽组织和小胆管显著增生。肝门静脉血管平滑肌损伤不明显,肌层小范围纤维素样变性、胆囊黏膜上皮大部分坏死,胆囊外结缔组织水肿、胆总管部分黏膜上皮坏死,部分上皮仍存在,肌层完好。2只兔肠系膜则与胆囊消融灶区发生严重粘连。因此,从目前的结果来看,不可逆电穿孔靠近胆囊0.5 cm消融肝脏,肝脏组织坏死明确,胆囊出现明确损伤,但没有胆囊漏发生。
总之,本研究对肝脏靠近胆囊0.5 cm处进行不可逆电穿孔消融,以观察该方法在临床上靠近胆囊的肝脏肿瘤消融的安全性和有效性。结果显示,消融部位肝脏组织完全坏死,消融灶和周围组织分界明显,胆囊出现损伤,但没有胆囊漏发生。因此,对于靠近胆囊的肝脏肿瘤来说,不可逆电穿孔可能是一种相对安全有效的选择。还需要对该技术作进一步研究,以在治疗时正确选择患者,减少潜在并发症的发生,从而明确不可逆电穿孔的适应范围和临床应用价值。
[1]Jemal A,Murray T,Ward E,etal.Cancer statistics,2005[J]. CA Cancer JClin,2005,55:10-30.
[2]Cucchetti A,Piscaglia F,Cescon M,et al.Systematic review of surgical resection vs radiofrequency ablation for hepatocellular carcinoma[J].World JGastroenterol,2013,19:4106-4118.
[3]Itoh S,Ikeda Y,Kawanaka H,et al.Efficacy of surgical microwave therapy in patients with unresectable hepatocellular carcinoma[J].Ann Surg Oncol,2011,18:3650-3656.
[4]Mu F,Niu L,Li H,et al.Percutaneous comprehensive cryoablation formetastatic hepatocellular cancer[J].Cryobiology,2013,66:76-80.
[5]Cheung W,Kavnoudias H,Roberts S,et al.Irreversible electroporation for unresectable hepatocellular carcinoma:initial experience and review of safety and outcomes[J].Technol Cancer Res Treat,2013,12:233-241.
[6]Long G,Bakos G,Shires PK,et al.Histological and finite element analysis of cell death due to irreversible electroporation[J].Technol Cancer Res Treat,2013:[Epub ahead of print].
[7]Lee EW,Loh CT,Kee ST.Imaging guided percutaneous irreversible electroporation:ultrasound and immunohistological correlation[J].Technol Cancer Res Treat,2007,6:287-294.
[8]Wu B,Xiao YY,Zhang X,et al.Magnetic resonance imagingguided percutaneous cryoablation of hepatocellular carcinoma in special regions[J].Hepatobiliary Pancreat Dis Int,2010,9:384-392.
[9]Xiao D,Yao C,Liu H,et al.Irreversible electroporation andapoptosis in human liver Cancer cells induced by nanosecond electric pulses[J].Bioelectromagnetics,2013,34:512-520.
[10]Lee YJ,Lu DS,Osuagwu F,et al.Irreversible electroporation in porcine liver:acute computed tomography appearance of ablation zone with histopathologic correlation[J].J Comput Assist Tomogr,2013,37:154-158.
[11]Schmidt CR,Shires P,Mootoo M.Real-time ultrasound imaging of irreversible electroporation in a porcine livermodel adequately characterizes the zone of cellular necrosis[J].HPB(Oxford),2012,14:98-102.
[12]Li W,Fan Q,Ji Z,et al.The effects of irreversible electroporation(IRE)on nerves[J].PLoS One,2011,6:e18831.
[13]Maor E,Ivorra A,Leor J,et al.The effect of irreversible electroporation on blood vessels[J].Technol Cancer Res Treat,2007,6:307-312.
[14]Lee YJ,Lu DS,Osuagwu F,et al.Irreversible electroporation in porcine liver:short-and long-term effect on the hepatic veins and adjacent tissue by CT with pathological correlation[J].Invest Radiol,2012,47:671-675.
[15]Kingham TP,Karkar AM,D’angelica MI,et al.Ablation of perivascular hepatic malignant tumors with irreversible electroporation[J].JAm Coll Surg,2012,215:379-387.
[16]Charpentier KP.Irreversible electroporation for the ablation of liver tumors:are we there yet?[J].Arch Surg,2012,147:1053-1061.
[17]Narayanan G.Irreversible electroporation for treatment of liver Cancer[J].Gastroenterol Hepatol(N Y),2011,7:313-316.
[18]Cannon R,Ellis S,Hayes D,et al.Safety and early efficacy of irreversible electroporation for hepatic tumors in proximity to vital structures[J].JSurg Oncol,2013,107:544-549.
Irreversible electroporation ab lation of the hepatic region close to the gallbladder:pathological
observation in experimental rabbits
LIANG Bing,NIU Li-zhi,ZENG Jian-ying,ZHOU Liang,ZHOU
Xu-long,FANG Gang,YAO Fei,DENG Chun-juan,WANG Yuan,ZHANG Bo,LI Shu-ying,DENG Chun-mei,YANG Hui-fei,LI Jia-liang,LIU Jian-guo,XU Ke-cheng.Affiliated Fuda Cancer Hospital,School of Medicine,Ji’nan University,Guangzhou,Guangdong Province 510665,China
XU Ke-cheng,E-mail:fudalab@gmail.com
ObjectiveTo investigate the safety and efficacy of irreversible electroporation(IRE)ablation of hepatic region close(0.5 cm)to the gallbladder.MethodsThree New Zealand white rabbitswere used for this study.The IRE probes,which were p laced in the hepatic tissue,were 0.5 cm apart from the gallbladder,and IRE ablation was performed.Seven days after the treatment the pathological changes of the hepatic ablated zones and gallbladderswere exam ined.ResultsSuccessful IRE ablation was accomp lished in all 3 rabbits.Seven days after the treatment the experimental rabbits were sacrificed,and their livers and gallbladders were collected and sent for pathological examination.Macroscopically,the hepatic surface of the ablated area showed a yellow necrotic lesion,which was(3.00±0.50)cm in size.At the diaphragmatic surface of the liver a round yellow lesion was seen with a size about(1.67±1.15)cm.Slight superficial adhesion could be seen at the ablated areas and abdom inal wall(n=2),hepatic lobe(n=1)and diaphragm(n=1).Serious adhesion ofmesentery with the ablated gallbladderwas seen in two rabbits.Microscopically,massive necrosis or disappearance of the hepatic tissue together with a little residual hepatic coagulation necrosis and speckled calcifications at the peripheral region could be detected.Inflammatory granulation and prom inent proliferation of the tiny biliary ductswere also observed.The damage of the vascular smoothmuscle in the portal vein was not obvious.Small area of fibrinoid degeneration was seen in the muscular layer.Mucosal epithelial necrosis of the gallbladder and connective tissue edema outside the gallbladder could also be observed. Conclusion Complete necrosis of the hepatictissue at the ablated area can be achieved by IRE ablation.The ablated zone has a clear demarcation with the surrounding tissue.No gallbladder leakage occurs although the gallbladder is damaged.Therefore,for the hepatic tumors,which are located close to the gallbladder,irreversible electroporation ablation may be regarded as a relatively safe and effective treatment.(JIntervent Radiol,2014,23:320-324)
liver;irreversible electroporation ablation;gallbladder;rabbit
R735.7
B
1008-794X(2014)-04-0320-05
2013-12-20)
(本文编辑:侯虹鲁)
广州天河区科技计划项目(2013KW 051)
10.3969/j.issn.1008-794X.2014.04.012
510665广州暨南大学医学院附属复大肿瘤医院
徐克成E-mail:fudalab@gmail.com

