硫酸卡那霉素联合呋塞米快速致聋大鼠模型的研究△
闫辉 邢蔚 宋勇莉 王人凤 陈俊 邱建华
在内耳毛细胞保护性研究中,建立理想的动物模型非常关键。目前应用耳毒性药物损伤耳蜗毛细胞建立耳聋动物模型的方法很多,包括经圆窗膜渗透卡铂、顺铂[1,2],肌肉注射硫酸卡那霉素(kanamycin sulfates,KM)、庆大霉素(gentamicin,GM))[3],袢利尿剂联合氨基糖苷类抗生素注射[4,5]等,国内外使用耳毒性药物建立耳聋动物模型的研究主要集中在豚鼠和小鼠[6~8],利用该方法建立大鼠耳聋模型的报道甚少。为此,本研究拟通过观察并分析KM与呋塞米(furosemide,Fur)联合使用建立快速致聋大鼠模型的效果,为药物性聋相关研究建立快速有效的动物模型提供参考。
1 材料与方法
1.1实验动物及分组 选用6周龄的雌性健康SD大鼠32只,由第四军医大学实验动物中心提供,体重120~150 g,耳廓反射灵敏,外耳道通畅,鼓膜完整且形态正常,实验前检测ABR反应阈均正常。动物随机分为A组(注射KM+Fur后1天组)、B组(注射KM+Fur后7天组)、C组(注射KM+Fur后14天组)、D组(对照组),每组8只动物。
1.2实验试剂 水合氯醛来源于成都市科龙化工试剂厂;硫酸卡那霉素25万U/ml,来源于天津药业焦作有限公司;呋塞米注射液2毫升/支,来源于上海和丰制药有限公司;鬼笔环肽来源于美国Cytoskeleton公司;半胱氨酸天冬氨酸蛋白酶-3(cleaved caspase-3)抗体来源于美国cell signaling technology公司;DAPI(4',6-Diamidino-2-phenylindole,4',6-二脒基-2-苯基吲哚;Santa公司)。
1.3实验步骤及方法
1.3.1快速致聋大鼠模型的建立 A、B、C三组分别经腹腔一次性注射KM 500 mg/kg,30分钟后再经腹腔注射Fur 0.2 ml/kg,对照组按体重给予相同剂量生理盐水腹腔注射。
1.3.2ABR测试 A、B、C三组于注射后的相应时间点、对照组于注射后1天分别进行ABR测试,测试在隔声屏蔽室内用美国TDT公司的听觉诱发电位工作站完成。方法:动物以15%水合氯醛溶液腹腔注射(0.025 ml/kg)麻醉后置于恒温板上,记录电极置于颅顶正中,参考电极和接地电极分别放置在给声侧耳及鼠尾根部皮下,外置扬声器置于大鼠头部前方45°,距离2 cm,正对外耳道;刺激声为短纯音(tone burst),由MF1-S立体磁场扬声器输出,刺激频率20次/秒,扫描时间为10 ms,上升、下降时间为0.5 ms,间隔时间为45.517 ms,滤波范围100~3 000 Hz,叠加1 024次,从90 dB SPL开始,按照5 dB降序依次检测,以能引出Ⅲ波的最小刺激强度为ABR反应阈,阈值小于20 dB SPL记为20 dB SPL,大于90 dB SPL记为90 dB SPL。依次检测每只动物的左右耳4、8、16、24、32 kHz反应阈。
1.3.3基底膜铺片免疫荧光染色及毛细胞计数 完成ABR测试后当天每组随机抽取2只大鼠行耳蜗基底膜铺片及扫描电镜观察。动物经心脏灌注后,取出耳蜗组织,用3%戊二醛固定,10%EDTA脱钙,耳蜗标本置于显微镜下行基底膜全层剥离后,将标本置于载玻片上,0.01M PBS(PH=7.2)清洗3次,滴加鬼笔环肽(1:200),避光染色20分钟;PBS(PH=7.2)清洗3次,吸干水分后,80%甘油封片。荧光显微镜下观察,在毛细胞损伤最显著的部位,600倍放大,连续抽取3个视野,计算毛细胞缺失率,取其平均值。如遇到视野周边出现不完整的细胞,只记一边,即记左不计右,记上不记下。
1.3.4扫描电镜观察 按上述方法固定耳蜗标本后,挑去骨性蜗壳,去除螺旋韧带,血管纹,前庭膜及盖膜,置于3%戊二醛内送第四军医大学电镜中心,2%单宁酸导电染色,梯度乙腈脱水,醋酸异戊酯过渡,干燥、镀膜后,扫描电子显微镜观察。
1.3.5免疫荧光观察cleaved caspase-3的表达 ABR测试后,各组取2只动物,按上述方法,取出耳蜗组织,将固定好的经EDTA脱钙一周的耳蜗标本置于30%蔗糖溶液中脱水,过夜后,置于OCT胶中包埋固定,沿蜗轴水平切片,切片厚度为10 μm。切片制备完善后,0.01M PBS(PH=7.2)清洗3次,0.1% TritonX- 100打孔,室温,15分钟,再置于5%小牛血清封闭液中,37℃,1 h后,吸去封闭液勿洗,加一抗兔来源cleaved caspase-3抗体1:50,于4℃孵育过夜,0.01M PBS(PH=7.2)清洗3次,加入二抗(1:200荧光染料594标记的羊抗兔IgG抗体)(Invitrogen公司),室温孵育1 h,DAPI染色,80%甘油封片。荧光显微镜拍照观察,通过专业图像分析软件Image Pro Plus(IPP)行荧光半定量检测,测得各组光密度值。阳性染色为胞浆染色为红色。
1.4统计学分析 用SPSS 19.0统计软件对测试结果进行单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠ABR检测结果 A、B、C组各频率ABR均较正常对照组明显升高,尤以高频升高明显,差异有统计学意义(P<0.05);而A、B、C组之间各频率ABR反应阈差异无统计学意义(P>0.05)(表1)。
表1 各组大鼠各频率ABR反应阈
注:#与D组比较,P<0.05

图1 各组基底膜底回铺片鬼笔环肽染色(×600) a~d分别为A~D组
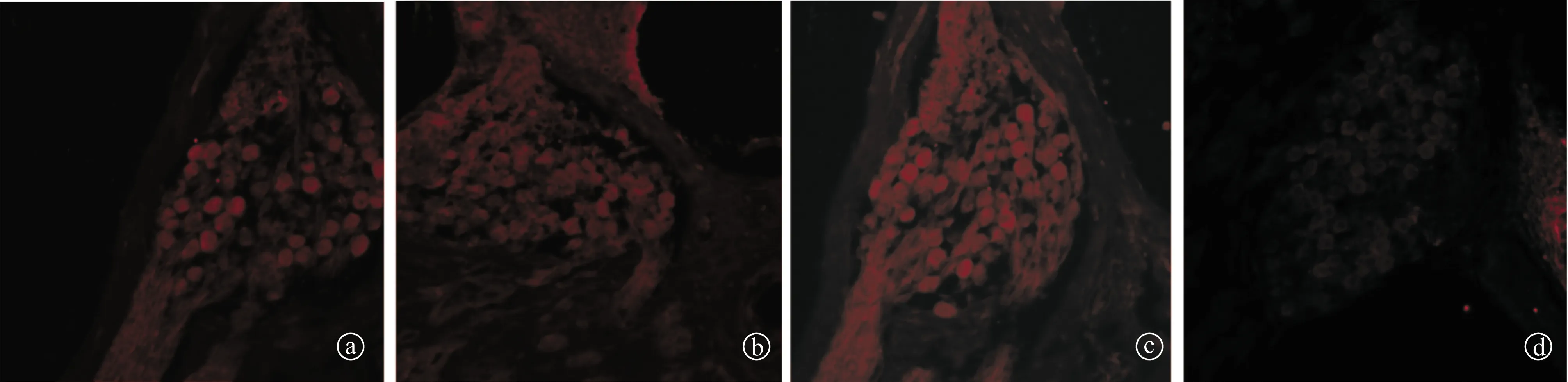
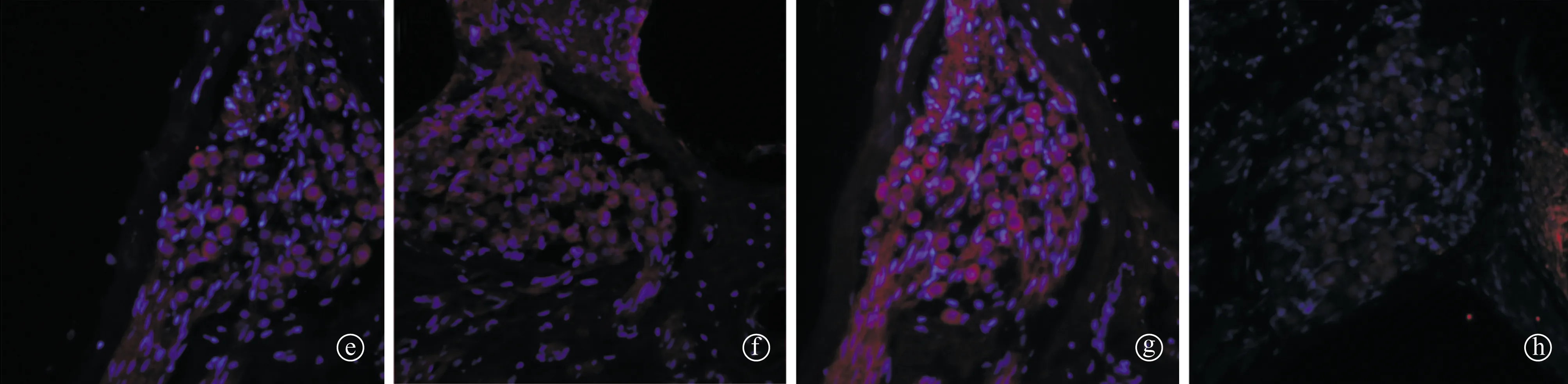
图3 各组螺旋神经节cleaved caspase-3免疫荧光染色图像(×600)a、e为A组,b、f为B组,c、g为C组,d、h为D组,红色为cleaved caspase-3染色,蓝色为DAPI衬核
2.2各组基底膜铺片的比较 A、B、C组耳蜗底回外毛细胞与正常对照组相比可见明显缺失,正常对照组毛细胞排列整齐,无缺失(图1);A、B、C组毛细胞总缺失率分别为39.53%、41.08%和39.42%,三组间毛细胞缺失率差异无统计学意义(P>0.05),A、B、C组毛细胞缺失率高于正常对照组,差异有统计学意义(P<0.05)。
2.3各组耳蜗基底膜扫描电镜观察 A、B、C组大鼠基底膜底回各排外毛细胞纤毛均有缺失,排列紊乱,倒伏,与基底膜铺片结果一致,而正常对照组毛细胞排列整齐,无纤毛缺失、倒伏等现象(图2)。
2.4各组螺旋神经节cleaved caspase-3的免疫荧光表达 荧光显微镜下cleaved caspase-3在正常对照组细胞浆染色为阴性,A、B、C组荧光显色均为阳性(图3)。A、B、C组螺旋神经节的免疫荧光染色平均光密度值分别为77.83±6.12、76.56.±2.74及85.68±4.72,正常对照组为21.36±5.17,A、B、C三组的光密度值高于正常对照组,差异均有统计学意义(均为P<0.05)。
3 讨论
氨基糖苷类抗生素的耳毒性机制至今仍不完全清楚,Yamane等[9,10]发现袢利尿剂可以促进KM进入内耳淋巴液,并推测其可能与袢利尿剂增强KM耳毒性的效应有关。速尿或利尿酸等药物与KM联合应用时,可导致肾功能衰竭,在短时间内可极大提高血浆和外淋巴液中KM的浓度,同时抑制KM从肾排泄,从而导致耳蜗功能发生不可逆的改变。既往研究[11~13]表明,卡那霉素和速尿联合应用可严重损伤成年豚鼠耳蜗毛细胞,且外毛细胞受损重于内毛细胞,耳蜗底回毛细胞受损重于顶回。从文中结果看,KM和Fur联合用药后第1天大鼠的ABR反应阈明显升高,给药后第1天组、第7天组及第14天组ABR反应阈均明显高于正常对照组(P<0.05),其中以高频反应阈升高更明显,与文献结果一致。
Caspase家族是一类半胱氨酸蛋白质酶,在介导细胞凋亡的过程中起着非常重要的作用,具有特异性水解底物分子天冬氨酸(Asp)残基C端肽键功能,是近年发现的重要凋亡分子[14]。凋亡蛋白质-3(caspase-3)被认为是多种组织、细胞类型中最常涉及的凋亡效应分子,它在凋亡信号传导的许多途径中发挥功能。近年来的研究[15]显示,caspase-3正常情况下以酶原(32 KD)的形式存在于胞浆中,在凋亡的早期阶段,它被激活,裂解相应的胞浆胞核底物,最终导致细胞凋亡;耳蜗外毛细胞是氨基糖苷类抗生素的主要靶点,曾有研究[16~18]也观察到,连续应用小剂量卡那霉素2周后,耳蜗毛细胞中的凋亡细胞数量明显高于正常对照组,内毛细胞的丢失导致了永久性的听觉丧失,并可引起螺旋神经节细胞的退化。本研究结果可见A、B、C三组的cleaved caspase-3的表达量明显高于正常对照组(P<0.05),说明这三组动物在听力下降时有螺旋神经节细胞的凋亡,药物性聋与内耳毛细胞及螺旋神经节细胞的凋亡有密切关系,进一步验证了cleaved caspase-3参与了药物性聋大鼠的螺旋神经节细胞的凋亡过程。
综上所述,KM和Fur一次性腹腔注射给药在用药后24小时大鼠即出现ABR反应阈明显高于正常对照组,且给药后14天内无显著变化,提示该快速致聋方法导致的听力下降有一定的稳定性,且操作简单有效,可明显缩短造模时间,为药物性聋实验研究提供了一种简单、快速而有效的动物模型造模方法。由于本研究采用的KM+Fur致聋剂量比较单一,致聋后观察时间仅限于14天内,有一定的局限性,因此,对于药物致聋的浓度与效应之间的关系,以及药物性聋发病机制等,还有待于今后更进一步的研究。
4 参考文献
1 Zhou Y,Ding D,Kraus KS,et al.Functional and structural changes in the chinchilla cochlea and vestibular system following round window application of carboplatin[J].Audiol Med,2009,7:189.
2 He J,Yin S,Wang J,et al.Effectiveness of different approaches for establishing cisplatin-induced cochlear lesions in mice[J].Acta Otolaryngol,2009,129:1 359.
3 丁大连, 蒋涛,丌卫东,等.内耳科学[M].北京:中国科学技术出版社,2010.222~223.
4 West BA,Brummett RE,Himes DL.Interaction of kanamycin and ethacrynic acid.Severe cochlear damage in guinea pigs[J].Arch Otolaryngo1,1973,98:32.
5 Nourski KV,Miller CA,Hu N,et al.Co-administration of kanamycin and ethacrynie acid as a deafening method for acute animal experiments[J].Hear Res,2004,187:131.
6 Astbury PJ. Read NG. Kanamycin induced ototoxicity in the laboratory rat: a comparative morphological and audiometric study[J]. Arch Toxicol,1982, 50:267.
7 Murillo-Cuesta S,Garcia-Alcfintara F,Vacas E,et al.Direct drug application to the round window:a comparative study of ototoxicity in rats[J].Otolaryngol Head Neck Surg,2009,141:584.
8 Wu WJ,Sha SH,McLaren JD,et al.Aminoglycoside ototoxicity in adult CBA,C57BL and BALB mice and the Sprague-Dawley rat[J].Hear Res,2001,158:165.
9 张贤芬,杨仕民,胡吟燕,等.联合应用卡那霉素和速尿的豚鼠耳蜗毒性实验观察[J].中华耳科学杂志,2008,6:166.
10 Gibbs RA, Weinstock GM, Metzker ML. Genome sequence of the brown Norway rat yields insights into mammalian evolution[J].Nature,2004,428:475.
11 Yang JH,Liu ZH.Apoptosis of cochlear cells and hearing threshold in guinea pigs with kanamucin-induced chronic intoxication[J].Chinese Journal of Clinical Rehabilitation,2005,9:30.
12 杨俊慧,刘兆华.卡那霉素耳慢性中毒后豚鼠耳蜗细胞凋亡的观察[J].中国耳鼻咽喉科杂志,2004,4:91.
13 He J,Yin S,Wang J,et al.Effectiveness of different approaches for establishing cisplatin-induced cochlear lesions in mice[J]. Acta Otolaryngol,2009,12:1 359.
14 Geal-Dor M,Freeman S,Li G,et al.Development of hearing in neonatal rats:air and bone conducted ABR thresholds[J].Hear Res, 1993,69:236.
15 邬莎,王爱梅.Caspase家族与内耳细胞凋亡[J].国际耳鼻咽喉头颈外科杂志,2007,6:317.
16 Jad W, Cristina P, Fiona LS,et al. A constitutively active and uninhibitable caspase-3 zymogen efficiently induces apoptosis[J]. Biochem J,2009,424:335.
17 Suparna M, Dragos P, Alexandru A, et al. Caspase-3 activation is a critical determinant of genotoxic stress-induced apoptosis[J]. Methods in Molecular Biology, 2008,414:13.
18 Shepherd JD, Bear MF. New views of Arc, a master regulator of synaptic plasticiticy[J]. Nat Neurosci, 2011,14:279.

