新型1,3,4-噻二唑衍生物的合成*
李文有,宋勇,陈宏博,杨文龙,徐晶
(1.大连理工大学精细化工国家重点实验室,辽宁 大连 116012;2.酒泉职业技术学院,甘肃 酒泉 735000)
新型1,3,4-噻二唑衍生物的合成*
李文有1,2,宋勇1,陈宏博1,杨文龙2,徐晶2
(1.大连理工大学精细化工国家重点实验室,辽宁 大连 116012;2.酒泉职业技术学院,甘肃 酒泉 735000)
以5-氨基-2-巯基-1,3,4-噻二唑为起始原料,对其2-位的巯基、5-位的氨基及杂环上3-位N原子进行结构修饰,合成了24个新型的1,3,4-噻二唑衍生物,其结构经1H NMR,13C NMR,IR和元素分析表征。
1,3,4-噻二唑;衍生物;合成
1,3 ,4 -噻二唑类化合物具有特殊的药物活性[1~3],在医药[4]、农业[5]和工业[6]等领域有广泛应用,已成为医药类研究的热点。Talath等[7]合成了一系列7-[4-(5-氨基-1,3,4-噻二唑-2-巯基)-哌嗪]氟类衍生物,其中部分具有抗结核活性的化合物不但能够作用于结核分支杆菌H37Rv,而且对革兰氏阳性病菌也具有一定的抑制活性; Alireza F等[8]合成的噻二唑类衍生物对革兰氏病菌也有很好的抑制效果;冯钟念等[9]研究发现,3,6-二取代-5,6-二氢-1,2,4-均三唑并[3,4-b]-1,3,4-噻二唑类衍生物能够较强的抑制大肠杆菌和金黄色葡萄球菌的活性;冯小明等[10]报道2-芳酞氨基-5-[1-苯基-2-羟基-2-(对甲氧基苯)乙基]-1,3,4-噻二唑类衍生物对大肠杆菌有较强的抑制作用。
为了寻找具有较好生物活性的化合物,本文以5-氨基-2-巯基-1,3,4-噻二唑(1)为起始原料,通过迈克尔反应、酰基化和闭环反应,对其2-位的巯基,5-位的氨基及杂环上3-位N原子进行化学结构修饰,合成了24个新型的1,3,4-噻二唑衍生物(2~9,Scheme 1),其结构经1H NMR,13C NMR,IR和元素分析表征。
该反应具有反应条件温和,后处理较为简单等优点,为工业、医药等领域中结构特殊的杂环中间体的合成提供了实验数据和理论依据。
2~9的合成,期望为药物合成及药物筛选提供依据,其相关的药理活性将另文报道。
1 实验部分
1.1 仪器与试剂
X-4型熔点仪(温度未校正);Bruker AvanceⅡ400 MHz型核磁共振仪(丙酮或氘代丙酮为溶剂,TMS为内标);Nicolet20DXB FT-IR型红外光谱仪(KBr压片);HP 1100型液相色谱仪;DF-101S型恒温加热磁力搅拌器。

所用试剂均为分析纯。
1.2 合成
(1)2a~2c和3a~3c的合成通法
在反应瓶中加入1 0.66 g(5 mmol),Ⅰa~Ⅰc 1.24 mol的甲醇(50 mL)溶液,催化剂三乙胺0.6 mL,氮气保护,搅拌下于室温~80℃反应4 h~12 h(TLC跟踪)。反应液经硅胶柱层析[洗脱剂: A=V(乙酸乙酯)∶V(石油醚)=1∶8]纯化得2a~2c和3a~3c。
2a{3-[5-氨基-2-硫代-1,3,4-噻二唑-3(2H-基]丙腈}:淡黄色固体,收率46.74%,纯度99.97%,m.p.103℃~105℃;1H NMRδ:3.04 (t,J=6.8 Hz,2H),4.41(t,J=6.8 Hz,2H),6.68(s,2H);13C NMR(100 MHz,CDCl3,下同) δ:13.3,50.1,119.2,149.0,182.4;IRν: 3 416,3 285,2 174,1 620,1 554,1183,1 067 cm-1;Anal.calcd for C5H6N4S2:C 32.24,H 3.25,N 30.08,S 34.43;found C 32.22,H 3.26,N 30.07,S 34.45。
2b{3-[5-氨基-2-硫代-1,3,4-噻二唑-3(2H)-基]丙酸甲酯}:淡黄色固体,收率29.36%,纯度99.93%,m.p.119℃~121℃;1H NMRδ:2.82 (t,J=7.2 Hz,2H),3.64(s,3H),4.36(t,J= 4.8 Hz,2H),6.60(s,2H);13C NMRδ:29.9, 49.8,52.0,149.4,173.0,182.7;IRν:3 417,3 286,2 925,1 719,1 620,1 556,1 213,1 069 cm-1;Anal.calcd for C6H9N3O2S2:C 32.86,H 4.14,N 19.16,O 14.59,S 29.25;found C 32.88,H 4.13,N 19.18,O 14.57,S 29.23。
2c{3-[5-氨基-2-硫代-1,3,4-噻二唑-3(2H)-基]丙酸丁酯}:红棕色泡沫收率17.16%,纯度99.90%;1H NMRδ:0.92(t,J=8.0 Hz,3H),1.41(m,J=8.0 Hz,2H),1.61(m,J=8.0 Hz,2H),2.83(t,J=8.0 Hz,2H),4.07(t,J=4.0 Hz,2H),4.37(t,J=8.0 Hz,2H),6.55(s,2H);13C NMRδ:13.6,18.7,30.5,31.3,49.6,64.8,149.1,171.4,182.5;IRν:3 315,3 191,2 959,1 724,1 559,1 256,1 184,1 069 cm-1; Anal.calcd for C9H15N3O2S2:C 41.36,H 5.78,N 16.08,O 12.24,S 24.54;found C 41.37,H 5.76,N 16.06,O 12.23,S 24.56。
3a[3-(5-氨基-1,3,4-噻二唑-2-基硫基)丙腈]:黄色固体,收率49.37%,纯度99.83%,m.p.136℃~137℃;1H NMRδ:2.93(t,J=6.8 Hz,2H),3.33(t,J=6.8 Hz,2H),7.38(s,2H);13C NMRδ:19.0,29.9,119.2,163.9;IR ν:3 298,3 102,2 171,1 631,1 580,1 505,1 069 cm-1;Anal.calcd for C5H6N4S2:C 32.24,H 3.25,N 30.08,S 34.43;found C 32.25,H 3.27,N 30.09,S 34.44。
3b[3-(5-氨基-1,3,4-噻二唑-2-基硫基)丙酸甲酯]:黄色固体,收率57.76%,纯度99.89%,m.p.102℃~104℃;1H NMRδ:2.81(t,J= 6.8 Hz,2H),3.34(t,J=6.8 Hz,2H),3.65 (s,3H),6.64(s,2H);13C NMRδ:30.7,51.7,161.5,163.9,172.1;IRν:3 311,3 102,2 927,1 729,1 633,1 503,1 247,1 067 cm-1; Anal.calcd for C6H9N3O2S2:C 32.86,H 4.14,N 19.16,O 14.59,S 29.25;found C 32.85,H 4.16,N 19.17,O 14.60,S 29.26。
3c[3-(5-氨基-1,3,4-噻二唑-2-基硫基)丙酸丁酯]:棕色固体,收率42.58%,纯度99.85%,m.p.93℃~95℃;1H NMRδ:0.92(t,J=7.2 Hz,3H),1.38(m,J=4.4 Hz,2H),1.58(m,J=5.2 Hz,2H),2.80(t,J=3.6 Hz,2H),3.34 (t,J=3.2 Hz,2H),4.08(t,J=6.8 Hz,2H),6.60(s,2H);13C NMRδ:13.9,18.7,31.2,31.4,64.7,161.5,164.2,170.9;IRν:3 298,3 102,2 959,1 723,1 503,1 247,1 067 cm-1; Anal.calcd for C9H15N3O2S2:C 41.36,H 5.78,N 16.08,O 12.24,S 24.54;found C 41.35,H 5.79,N 16.07,O 12.27,S 24.51。
(2)4a~4c和5a~5c的合成通法
在配有尾气吸收装置的单口瓶中加入氯乙酸9.4 g(100 mmol)和氯化亚砜14.6mL(200mmol),搅拌下于室温反应6.5 h。自然挥发除去过量的氯化亚砜得氯乙酰氯,其IR谱与标准谱图吻合。
在单口烧瓶中加入2(或3)1 mmol和DMF 3 mL,冰水浴冷却下滴加氯乙酰氯0.9 mL(1.2 mmol),滴毕,于室温反应6 h~8 h(TLC跟踪)。减压浓缩后用乙醇重结晶得4(或5)。
4a{2-氯代-N-[4-(2-氰乙基)-5-硫代-4,5-二氢-1,3,4-噻二唑-2-基]乙酰氨}:黄色固体,收率60.84%,纯度99.75%,m.p.164℃~167℃;IR ν:3 440,2 926,2 221,1 713,1 570,1 556,1 079 cm-1;Anal.calcd for C7H7N4OS2Cl:C 32.00,H 2.69,N 21.32,O 6.09,S 24.41,Cl 13.49; found C 32.02,H 2.70,N 21.33,O 6.08,S 24.42,Cl 13.50。
4b{3-[5-(2-氯代乙酰氨基)2-硫代-1,3,4-噻二唑-3(2H)-基]丙酸甲酯}:黄色固体,收率87.84%,纯度99.63%,m.p.112℃~116℃;IR ν:3 441,2 917,1 711,1 692,1 583,1 212,1 184,1 076 cm-1;Anal.calcd for C8H10N3O3S2Cl: C 32.49,H 3.41,N 14.21,O 16.23,S 21.68,Cl 11.99;found C 32.50,H 3.43,N 14.20,O 16.25,S 21.69,Cl 11.97。
4c{3-[5-(2-氯代乙酰氨基)-2-硫代-1,3,4-噻二唑-3(2H)-基)丙酸丁酯}:棕色固体,收率87.23%,纯度99.51%,m.p.92℃~94℃;IR ν:3 432,2 930,1 730,1 710,1 579,1 214,1 184,1 081 cm-1;Anal.calcd for C11H16N3O3S2Cl: C 39.11,H 4.77,N 12.44,O 14.21,S 18.98,Cl 10.49;found C 39.13,H 4.75,N 12.42,O 14.23,S 19.00,Cl 10.50。
5a{2-氯代-N-[5-(2-氰乙硫基)-1,3,4-噻二唑-2-基]乙酰氨}:黄色固体,收率90.85%,纯度99.82%,m.p.174℃~178℃;IRν:3 440,2 926,2 231,1 707,1 582,1 066 cm-1;Anal.calcd for C7H7N4OS2Cl:C 32.00,H 2.69,N 21.32,O 6.09,S24.41,Cl13.49;found C 31.98,H 2.67,N 21.30,O 6.10,S 24.43,Cl 13.51。
5b{3-[5-(2-氯代乙酰氨基)-1,3,4-噻二唑-2-基硫基]丙酸甲酯}:黄色固体,收率92.57%,纯度99.79%,m.p.144℃~145℃;IRν:3 440,2 946,1 734,1 706,1 588,1 198,1 178,1 070 cm-1;Anal.calcd for C8H10N3O3S2Cl:C 32.49,H 3.41,N 14.21,O 16.23,S 21.68,Cl 11.99; found C 32.47,H 3.43,N 14.23,O 16.21,S 21.67,Cl 12.01。
5c{3-[5-(2-氯代乙酰氨基)-1,3,4-噻二唑-2-基硫基]丙酸丁酯}:棕色固体,收率82.82%,纯度99.90%,m.p.105℃~106℃;IRν:3 436,2 961,1 729,1 704,1 578,1 297,1 183,1 065 cm-1;Anal.calcd for C11H16N3O3S2Cl:C 39.11,H 4.77,N 12.44,O 14.21,S 18.98,Cl 10.49; found C 39.10,H 4.79,N 12.42,O 14.20,S 18.97,Cl 10.51。
(3)6a~6c和8a~8c的合成通法
在单口烧瓶中加入4(或5)1 mmol和乙腈3 mL,搅拌下加入四正丁基溴化铵(TBAB)0.1 g (0.3 eq)和KI 0.11 g(0.66 eq),于室温反应15 min。加入KSCN 0.1 g(1 eq),反应1 h;于80℃反应至终点(TLC跟踪)。反应液直接经硅胶柱层析(洗脱剂:A=1∶4)纯化得6(或8)。
6a{3-[5-(5-氧代-2-硫代咪唑烷-1-基)-2-硫代-1,3,4-噻二唑-3(2H)-基)丙腈}:黄色固体,收率56.14%,纯度99.71%,分解温度162℃;1H NMRδ:3.16(t,J=6.8 Hz,2H),4.18(s,2H),4.61(t,J=2.4 Hz,2H),11.05(s,1H); IRν:3 433,2 274,1 750,1 625,1 572,1 175,1 083 cm-1;Anal.calcd for C8H7N5OS3:C 33.67,H 2.47,N 24.54,O 5.61,S 33.71;found C 33.69,H 2.45,N 24.51,O 5.63,S 33.68。
6b{3-[5-(5-氧代-2-硫代咪唑烷-1-基)-2-硫代-1,3,4-噻二唑-3(2H)-基]丙酸甲酯}:黄色固体,收率50.31%,纯度99.62%,m.p.103℃~104℃;1H NMRδ:2.95(t,J=7.2 Hz,2H),3.67(s,3H),4.16(s,2H),4.52(t,J=2.4 Hz,2H),10.91(s,1H);IRν:3 420,2 922,1 738,1 582,1 252,1 185,1 079 cm-1;Anal.calcd for C9H10N4O3S3:C 33.95,H 3.17,N 17.60,O 15.08,S 30.21;found C 33.94,H 3.19,N 17.59,O 15.10,S 30.23。
6c{3-[5-(5-氧代-2-硫代咪唑烷-1-基)-2-硫代-1,3,4-噻二唑-3(2H)-基]丙酸丁酯}:棕色固体,收率42.77%,纯度99.49%,m.p.132℃~134℃;1H NMRδ:0.93(t,J=6.4 Hz,3H),1.40(m,J=7.2 Hz,2H),1.60(m,J=6.8 Hz,2H),2.95(t,J=6.8 Hz,2H),4.07(t,J=6.8 Hz,2H),4.10(s,2H),4.52(t,J=6.8 Hz,2H),11.00(s,1H);IRν:3 430,2 957,1 749,1 634,1 590,1 266,1 179,1 085 cm-1;Anal.calcd for C12H16N4O3S3:C 39.98,H 4.47,N 15.54,O 13.32,S 26.69;found C 39.95,H 4.49,N 15.55,O 13.30,S 26.70。
8a{3-[5-(5-氧代-2-硫代咪唑烷-1-基)-1,3,4-噻二唑-2-基硫基]丙腈}:淡黄色固体,收率67.38%,纯度99.43%,m.p.196℃~198℃;1H NMRδ:3.10(t,J=6.8 Hz,2H),3.63(t,J=6.8 Hz,2H),4.11(s,2H),10.90(s,1H); IRν:3 452,2 231,1 735,1 569,1 167,1 054 cm-1;Anal.calcd for C8H7N5OS3:C 33.67,H 2.47,N 24.54,O 5.61,S 33.71;found C 33.68,H 2.49,N 24.53,O 5.60,S 33.70。
8b{3-[5-(5-氧代-2-硫代咪唑烷-1-基)-1,3,4-噻二唑-2-基硫基]丙酸甲酯}:淡黄色固体,收率75.39%,纯度99.83%,m.p.165℃~167℃;1H NMRδ:2.89(t,J=6.0 Hz,2H),3.53(t,J=8.0Hz,2H),3.67(s,3H),4.10(s,2H),10.90(s,1H);IRν:3 449,2 924,1 735, 1 596,1 174,1 073 cm-1;Anal.calcd for C9H10N4O3S3:C 33.95,H 3.17,N 17.60,O 15.08,S 30.21;found C 33.96,H 3.18,N 17.61,O 15.07,S 30.22。
8c{3-[5-(5-氧代-2-硫代咪唑烷-1-基)-1,3,4-噻二唑-2-基硫基]丙酸丁酯}:黄色固体,收率41.68%,纯度99.87%,m.p.110℃~113℃;1H NMRδ:0.92(t,J=6.8 Hz,3H),1.40(m,J=6.8 Hz,2H),1.61(m,J=7.2 Hz,2H),2.89(t,J=6.8 Hz,2H),3.53(t,J=6.8 Hz,2H),4.10(t,J=6.8 Hz,2H),4.10(s,2H),10.89(s,1H);IRν:3 432,2 962,1 734,1 599,1 259,1 175,1 090 cm-1;Anal.calcd for C12H16N4O3S3:C 39.98,H 4.47,N 15.54,O 13.32,S 26.69;found C 39.97,H 4.46,N 15.57,O 13.33,S 26.67。
(4)7a~7c和9a~9c的合成通法
在单口烧瓶中加入4(或5)1 mmol和DMF 2 mL,搅拌使其溶解;加入KI 0.11 g(0.66 eq),于60℃反应15 min;加入KSCN 0.1 g(1 eq),于100℃反应至终点(TLC跟踪)。减压浓缩后经乙醇重结晶得7(或9)。
7a{3-[5-(4-氧代噻唑烷-2-基亚氨基)-2-硫代-1,3,4-噻二唑-3(2H)-基]丙腈}:淡黄色固体,收率71.68%,纯度99.47%,m.p.206℃~208℃;1H NMR(DMSO)δ:3.11(t,J=6.0 Hz,2H),4.17(s,2H),4.50(t,J=6.4 Hz,2H),12.48(s,1H);IRν:3 437,2 924,2 254,1 747,1 624,1 174,1 082 cm-1;Anal.calcd for C8H7N5OS3:C 33.67,H 2.47,N 24.54,O 5.61,S 33.71;found C 33.66,H 2.45,N 24.55,O 5.59,S 33.72。
7b{3-[5-(4-氧代噻唑烷-2-基亚氨基)-2-硫代-1,3,4-噻二唑-3(2H)-基]丙酸甲酯}:淡黄色固体,收率71.18%,纯度99.62%,m.p.161℃;1H NMR(DMSO)δ:2.91(t,J=6.8 Hz,2H),3.62(s,3H),4.15(s,2H),4.42(t,J=6.8 Hz,2H),12.43(s,1H);IRν:3 432,2 939,1 738,1 582,1 252,1 185,1 079 cm-1;Anal.calcd for C9H10N4O3S3:C 33.95,H 3.17,N 17.60,O 15.08,S 30.21;found C 33.94,H 3.16,N 17.64,O 15.05,S 30.23。
7c{3-[5-(4-氧代噻唑烷-2-基亚氨基)-2-硫代-1,3,4-噻二唑-3(2H)-基]丙酸丁酯}:棕色固体,收率60.84%,纯度99.33%,m.p.154℃~155℃;1H NMR(DMSO)δ:0.86(t,J=4.0 Hz,3H),1.28(m,J=8.0 Hz,2H),1.54(m,J= 8.0 Hz,2H),2.90(t,J=8.0 Hz,2H),4.02(t,J=8.0 Hz,2H),4.15(s,2H),4.42(t,J=8.0 Hz,2H),12.44(s,1H);IRν:3 433,2 960,1 726,1 634,1 576,1 245,1 181,1 083 cm-1; Anal.calcd for C12H16N4O3S3:C 39.98,H 4.47,N 15.54,O 13.32,S 26.69;found C 39.99,H 4.45,N 15.53,O 13.34,S 26.68。
9a{3-[5-(4-氧代噻唑烷-2-基亚氨基)-1,3,4-噻二唑-2-基硫基]丙腈}:黄色固体,收率63.52%,纯度99.49%,m.p.208℃~210℃;1H NMR(DMSO)δ:3.05(t,J=6.4 Hz,2H),3.55(t,J=6.4 Hz,2H),4.11(s,2H),12.35 (s,2H);IRν:3 432,2 933,2 245,1 736,1 652,1 562,1 168 cm-1;Anal.calcd for C8H7N5OS3:C 33.67,H 2.47,N 24.54,O 5.61,S33.71; found C 33.69,H 2.43,N 24.57,O 5.59,S 33.70。
9b{3-[5-(4-氧代噻唑烷-2-基亚氨基)-1,3,4-噻二唑-2-基硫基]丙酸甲酯}:黄色固体,收率65.32%,纯度99.88%,m.p.176℃~177℃;1H NMR(DMSO)δ:2.85(t,J=6.8 Hz,2H),3.45(t,J=6.8 Hz,2H),3.63(s,3H),4.11 (s,2H),12.33(s,1H);IRν:3 430,2 925,1 733,1 598,1 251,1 173,1 071 cm-1;Anal.calcd for C9H10N4O3S3:C 33.95,H 3.17,N 17.60,O 15.08,S 30.21;found C 33.97,H 3.19,N 17.62,O 15.07,S 30.20。
9c{3-[5-(4-氧代噻唑烷-2-基亚氨基)-1,3,4-噻二唑-2-基硫基]丙酸丁酯}:红棕色固体,收率71.60%,纯度99.87%,m.p.111℃~112℃;1H NMR(DMSO)δ:0.88(t,J=8.0 Hz,3H),1.33(m,J=8.0 Hz,2H),1.55(m,J=8.0 Hz,2H),2.84(t,J=4.0 Hz,2H),3.45(t,J=8.0 Hz,2H),4.05(t,J=8.0 Hz,2H),4.11(s,2H),12.33(s,1H);IRν:3 406,2 958,1 732,1 595,1 171,1 248,1 057 cm-1;Anal.calcd for C12H16N4O3S3:C 39.98,H 4.47,N 15.54,O 13.32,S 26.69;found C 40.00,H 4.46,N 15.57,O 13.30,S 26.70。
2 结果与讨论
2.1 溶剂及其用量对Michael加成反应的影响
不同的溶剂由于极性不同,对反应的转化率有一定的影响。以合成2a和3a为模板,考察溶剂及其用量对Michael加成反应的影响。1 5 mmol,r=n(1)∶n(丙烯腈)=1∶2,Et3N为催化剂,于40℃(浴温)反应至终点(TLC跟踪),其余反应条件同1.2(1),实验结果见表1(反应液采用HPLC进行检测,以吸收峰面积为考察指标)。
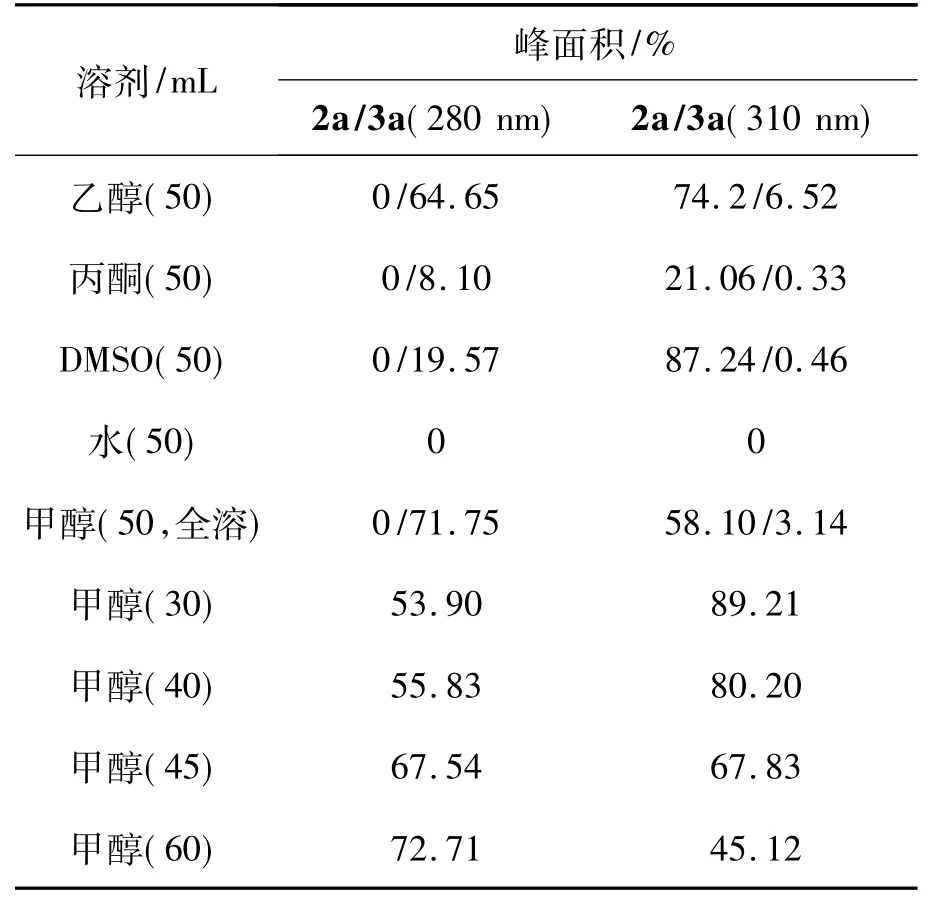
表1 溶剂及其用量对Michael加成反应的影响*Table 1 Effect of solvents and amount on Michael addition
从表1可见,在280 nm下,3a有较强的吸收峰;在310 nm下,2a有较强的吸收峰。纵向对比两组数据可以得出,甲醇和DMSO为较理想的反应溶剂。且甲醇较利于3a的生成,DMSO利于2a的生成。考虑到反应的后处理(DMSO沸点为189℃,不易除去),选用甲醇作为反应溶剂。
从表1还可见,溶剂用量少,有利于2a的生成,反之则有利于3a的生成。综合考虑该反应的反应时间和生产效率,甲醇用量以50 mL最佳。
2.2 反应温度和反应时间对Michael加成反应的影响
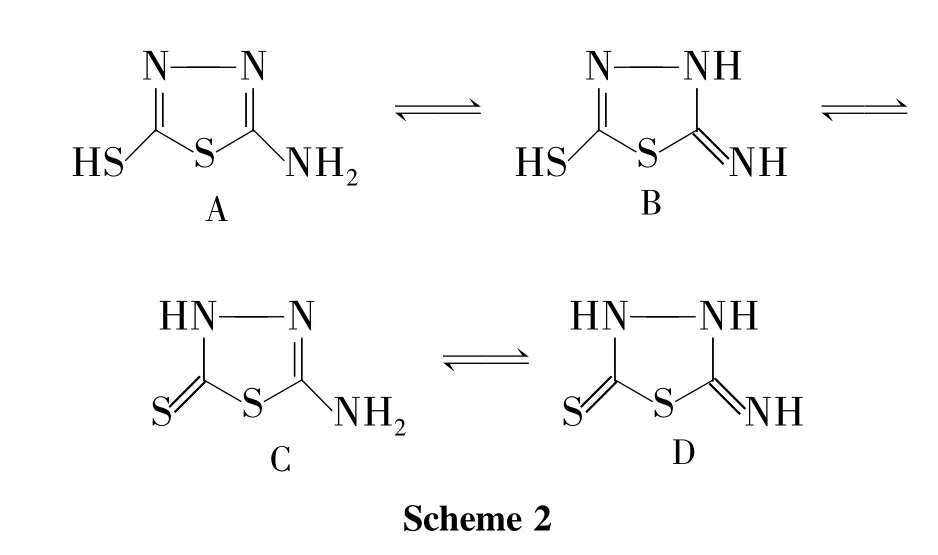
不同的反应温度对反应时间及转化率有着一定的影响。以甲醇(50 mL)为溶剂,其余反应条件同2.1,考察反应温度和时间对Michael加成反应的影响,结果见表2。从表2可见,随着反应温度的升高,反应速率加快,有利于2a的生成。但由于1存在4种互变异构体(Scheme 2),即氨基-巯基式(A)、亚氨基-巯基式(B)、氨基-硫酮式(C)和亚氨基-硫酮式(D),其中D是其优势结构,在温度较高的情况下,利于该结构的存在。当以D式结构大量存在时,丙烯腈便易于在噻唑环3-位氮原子上进行加成反应生成2a。
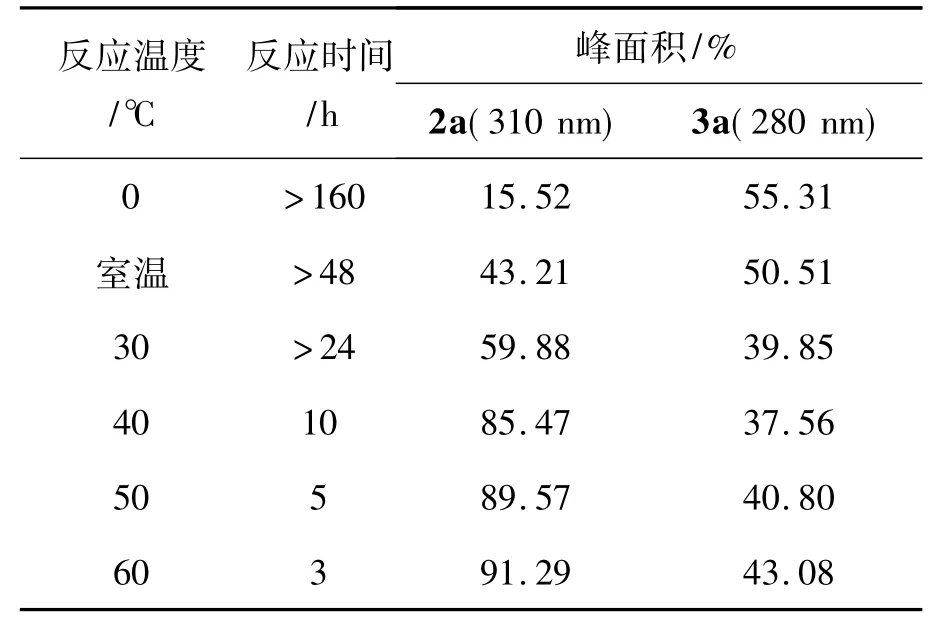
表2 反应温度和时间对Michael加成反应的影响*Tab le 2 Effect of temperature and time on Michael addition
[1]崔瑾,朱月林,李式军.苯基噻二唑基脲(TDZ)在不同基因型芋组织培养中的生理效应[J].南京农业大学学报,2002,25(2):31-34.
[2]张耀洲,肖颖,杨俊杰等.肟醚噻二唑硫醚化合物的合成及其抗肿瘤活性[J].应用化学,2013,30 (4):385-388.
[3]董漪,范九良,周双生,等.新型噻二唑含硫Schiff碱的合成及抗肿瘤活性[J].中国医药工业杂志,2003,44(4):337-340.
[4]薛思佳,柴安,蔡志娟,等.4-(对取代苯基)-2-[2-(取代苯基)呋喃-4-甲酰胺]-1',3',4'-均三唑[1,2-d]-1,3,4-噻二唑类衍生物的合成和生物活性[J].有机化学,2008,28(3):494-497.
[5]金桂玉,侯震,赵国锋.1-芳酰基-4-取代吡唑甲酰基氨基硫脲和环化产物的合成及生物活性[J].高等学校化学学报,1997,18(3):409-412.
[6]杨新岭,陈馥衡.新型含噻二唑环黄酰脲的合成及其生物活性的研究[J].高等学校化学学报,1995,16(2):234-236.
[7]Talath S,Gadad A K.Synthesis,antibacterial and antitubercular activities of some 7-[4-(5-amino-[1,3,4]thiadiazole-2-sulfonyl)-piperazin-1-yl]-fluoroquinolonic derivatives[J].Eur JMed Chem,2006,41:918-924.
[8]Alireza F,Fatemeh S,Hamideh M H,etal..Synthesis,in vitro-antimycobacterial activity and cytotoxicity of some alkylα-(5-aryl-1,3,4-thiadiazole-2-yl-thio) acetates[J].Arch Pharm Chem Life Sci,2005,338: 112-116.
[9]冯钟念,卢俊瑞,辛春伟,等.新型S(N)-β-D-葡萄糖苷-4-N-(取代邻羟苯基)亚胺基-5-(4-甲基-1,2,3-噻二唑)-1,2,4-三唑的合成及生物活性[J].高等学校化学学报,2013,34(5):1143-1150.
[10]冯小明,陈荣.2-芳酰氨基-5-[1-苯基-2-羟基-2-(对甲氧基苯)乙基]-1,3,4-噻二唑的合成[J].应用化学,1994,5:79-82.
Synthesis of Novel 1,3,4-Thiadiazole Derivatives
LIWen-you1,2,SONG Yong1,CHEN Hong-bo1,YANGWen-long2,XU Jing2
(1.State Key Laboratory of Fine Chemical,Dalian University of Technology,Dalian 116012,China; 2.Jiuquan Vacational and Technical College,Jiuquan 735000,China)
Twenty-four novel 1,3,4-thiodiazole derivatives were synthesized by chemical structure modifying on 2-metcapto,5-amino and 3-N of the heterocycle of 5-amino-1,3,4-thiadiazole-2-thio.The structureswere characterized by1H NMR,13C NMR,IR and elemental analysis.
1,3,4-thiodiazole;derivative;synthesis
O626.25
A
1005-1511(2014)02-0158-06
2013-10-14;
2013-12-26
李文有(1969-),男,汉族,甘肃天水人,副教授,主要从事药物中间体的合成研究。E-mail:jqzylwy@163.com

