氨氮与亚硝酸盐对含铁锰地下水生物净化影响
蔡言安,李 冬,曾辉平,张 杰,2
氨氮与亚硝酸盐对含铁锰地下水生物净化影响
蔡言安1,李 冬1,曾辉平1,张 杰1,2
(1.北京工业大学水质科学与水环境恢复工程北京市重点实验室,100124北京;2.哈尔滨工业大学城市水资源与水环境国家重点实验室,150090哈尔滨)
为明确氨氮与亚硝酸盐氮对生物除铁锰性能及锰氧化细菌(MnOB)的影响,采用具有成熟除铁锰能力的中试生物滤柱与SBR反应器进行实验.结果表明:氨氮与亚硝酸盐均不影响滤柱除铁效果;进水亚硝酸盐氮质量浓度为0.1,0.2,0.3和0.7 mg/L时,滤柱除锰效果不受影响,SBR实验结果进一步表明亚硝酸盐能促进MnOB氧化锰能力;氨氮的存在可抑制MnOB氧化锰能力,但对成熟滤柱,进水氨氮质量浓度为1.2,2.2 mg/L时,这种抑制作用不能恶化除锰效果,直至氨氮质量浓度提高至4.5 mg/L时,出水锰质量浓度开始超标.对于生物滤池的启动,可首先接种硝化细菌至硝化过程建立之后,再接种MnOB以减弱氨氮对其的不利影响.
除铁除锰;硝化作用;地下水净化;生物滤池;锰氧化细菌活性
生物除锰固锰技术已成功且广泛应用于含铁锰地下饮用水水质净化[1-3];同时,对于伴生氨氮的含铁锰地下水,由于硝化细菌协同参与作用,亦取得了显著的同步去除效果[4-7].由于铁锰氧化细菌及硝化细菌的活性发挥对水体氧化还原电位值(ORP)需求不同[8],且锰的生物氧化去除对ORP值需求较高,有研究认为[6,9],在铁锰氨氮同步生物去除滤池的启动过程中,锰的氧化去除滞后于氨氮的硝化,是由于必须通过硝化作用改变水体的ORP以营造适合锰氧化细菌(MnOB)代谢繁殖的水体环境,然而关于氨氮对MnOB活性是否具有抑制作用并没有明确.一方面,在实际生物除铁除锰模拟滤柱与生物同步去除铁锰及氨氮模拟滤柱运行过程中发现,硝化作用对ORP的提高并不明显,水体中亚铁离子质量浓度决定了滤柱进出水ORP的变化.另一方面,同步除氨氮铁锰生物反应器在启动过程中通常伴有一定量亚硝酸盐的出现,而亚硝酸盐氮对锰氧化细菌(MnOB)活性影响的研究亦鲜有报道.因此,本文开展氨氮、硝化中间产物亚硝酸盐氮对生物除铁锰性能影响的研究,明晰硝化作用在生物除铁锰工艺中的作用,为缩短去除铁锰氨氮同步生物滤池的启动提供调控策略.
1 实 验
1.1反应装置
中试实验滤柱:采用已培养成熟且稳定达标运行一年左右的生物除铁锰有机玻璃滤柱为反应器,如图1所示.装置高3.0 m、内径185 mm;石英砂滤层厚度130 cm、粒径0.6~1.2 mm;底部鹅卵石分级承托层30 cm.滤柱采用下向流过滤方式,滤速4 m/h;工作周期48 h;反冲强度18 L/(s·m2)、反冲历时2.5 min.经顶部喷淋头曝气后进水溶解氧质量浓度为7.8~8.2 mg/L.
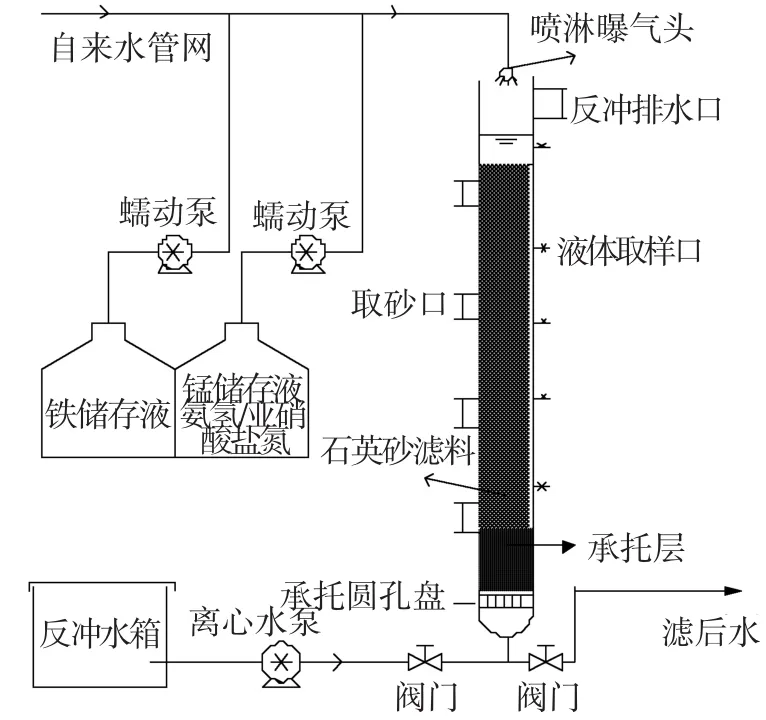
图1 生物除铁除锰滤柱反应装置
SBR反应装置:建立SBR小试反应器以进一步明确氨氮与硝化中间产物亚硝酸盐氮对MnOB活性的影响.反应器有效容积10 L,设搅拌装置(保证液体与空气中的氧气传质及反应底物与MnOB的传质),接种上述中试滤柱反应器反冲洗排水2 L(铁锰泥质量浓度约6.0 g/L,含锰氧化细菌)于反应器内.反应器运行与静沉时间各为24 h,换水比95%(每个周期内排水与新加入配水均为9.5 L,反应器内总液体体积10 L,其二者之比).
1.2实验用水
滤柱实验采用人工配水,水温18~22℃.在管网水中投加硫酸锰与硫酸亚铁模拟含铁锰水质,分别添加NaNO2、(NH4)2SO4以宏观角度考察亚硝酸盐氮与氨氮对生物除铁除锰性能的影响.考虑到硝化作用最终产物硝酸盐氮对MnOB没有不利影响[10],以及模拟配水所用管网水中含有一定量的硝酸盐氮,未进行硝酸盐氮影响实验.
SBR反应进水仍为人工配水,反应于室温下进行,水温22~28℃,反应阶段溶解氧质量浓度维持在7.5 mg/L以上.每个周期内,各取样时间点所取水样以0.45μm微滤膜过滤后,滤液于4℃保存以便检测.
1.3检测方法
按照生活饮用水标准检验方法(GB5750/2006)规定分别采用邻菲罗啉分光光度法、过硫酸铵分光光度法、纳氏试剂分光光度法、重氮偶合分光光度法检测铁、锰、氨氮、亚硝酸盐氮质量浓度.
2 结果与讨论
2.1亚硝酸盐氮对生物除铁除锰滤柱性能影响
由于氨氮的硝化过程中,亚硝酸盐氮作为中间产物与氨氮共同存在于水体中,要明确氨氮的影响就要先排除亚硝酸盐氮的干扰,即首先明确亚硝酸盐氮对滤柱除铁锰的影响.实验之前模拟配水中无人为添加硝化细菌所需基质(氨氮或亚硝酸盐氮),因而滤柱无成熟硝化能力.
图2(a)中,以亚硝酸盐氮质量浓度0.1 mg/L运行的数天内,滤柱进出水亚硝酸盐质量浓度基本保持一致.而以亚硝酸盐氮质量浓度0.2 mg/L运行至18 d左右时,亚硝酸盐氮在滤柱内开始得到去除,其出水质量浓度开始降低,并于20 d左右时出水质量浓度达0.1 mg/L以下.随后亚硝酸盐氮质量浓度为0.3和0.7 mg/L时,其出水质量浓度依然维持在0.1 mg/L以下.然而图3(a)中各亚硝酸盐质量浓度在滤层0~30 cm内仅发生微弱变化,并且在滤层90 cm处被氧化至0.1 mg/L以下水平.由图2(b)可以看出,亚硝酸盐氮质量浓度分别为0.1,0.2,0.3及0.7 mg/L时,滤柱出水铁质量浓度始终处于0.05 mg/L以下水平,并未对其除铁性能产生不利影响.图3(b)中铁在各质量浓度范围亚硝酸盐氮作用下,沿层去除带没有出现大幅度变化,均在0~60 cm滤层内得到理想去除,其沿层去除性能同样没有受到亚硝酸盐的影响.生物氧化作用与化学接触氧化作用共同参与了铁的氧化去除,但化学接触作用却在铁的去除过程中起主导作用[11].显然,亚铁离子与亚硝酸盐作为还原物质,在各自的氧化过程中二者之间并未存在相互影响的可能.

图2 亚硝酸盐各质量浓度梯度下生物滤柱除铁锰性能
由图3(c)可知,锰的去除带始终位于0~30 cm滤层内,即MnOB集中存在于该滤层内,并且在亚硝酸盐作用下其氧化活性并未受到抑制作用.Vandenabeele等[12]研究表明,高质量浓度亚硝酸盐(100 mg/L)对MnOB具有强烈的抑制作用、使锰去除率降低50%;还能将四价态锰还原为二价态锰,阻碍生物锰氧化进程.然而,在实际饮用水处理过程中不能产生如此高质量浓度亚硝酸盐,并且以上实验结果表明低质量浓度亚硝酸盐(0.1~0.7 mg/L)并未破坏滤柱除锰性能.另外,图3(c)中在亚硝酸盐质量浓度下其锰沿层去除变化亦未出现漏锰的现象,即没有亚硝酸盐还原锰氧化物,因此,在0.1~0.7 mg/L亚硝酸盐质量浓度下滤柱仍能保持高效除锰,存在3种可能:一是亚硝酸盐对MnOB活性产生抑制作用,但这种抑制不足以破坏其除锰能力;二是MnOB以亚硝酸盐为氮源进行繁殖代谢,提高了滤柱除锰性能;三是亚硝酸盐与锰氧化细菌之间没有任何相互作用.这些可能性在后续的SBR实验中将得以验证.
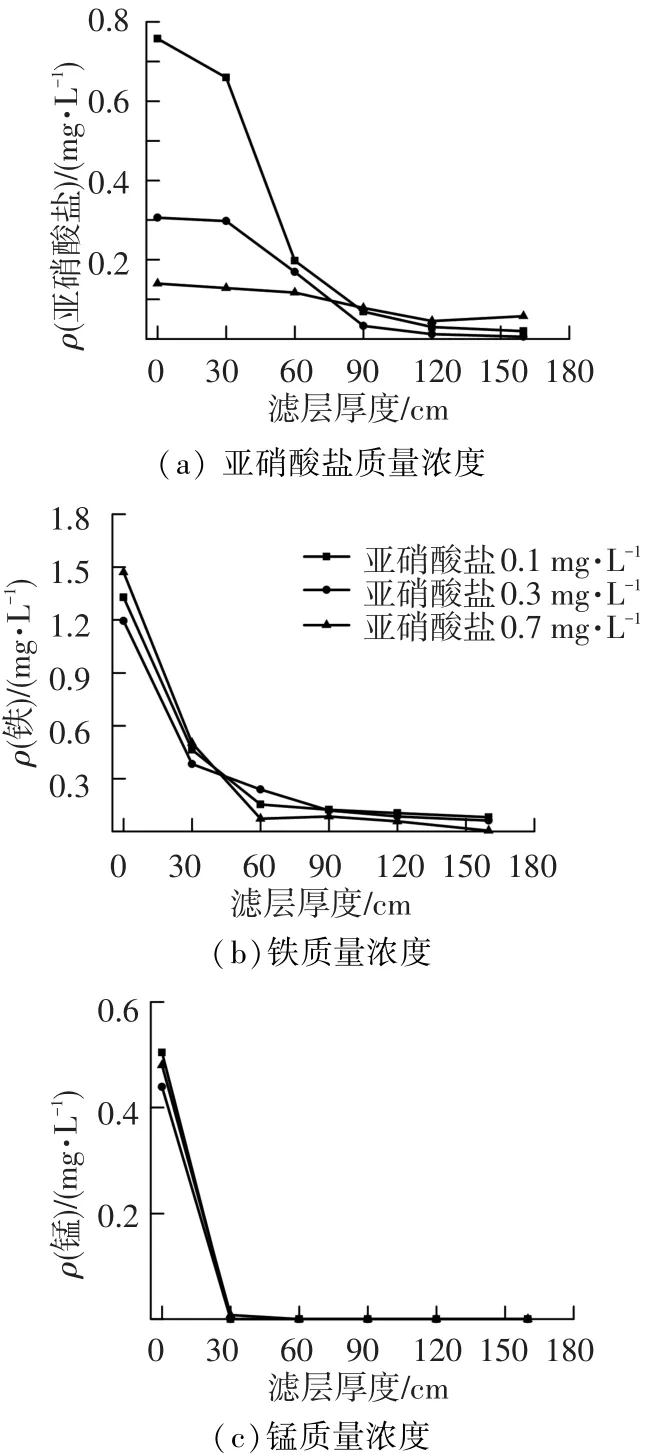
图3 亚硝酸盐氮、铁、锰质量浓度沿滤层深度方向变化
2.2氨氮对生物除铁除锰滤柱性能影响
由2.1实验结果可知,亚硝酸盐质量浓度为0~0.7 mg/L时不影响滤柱除铁锰性能,随后实验过程均在氨氮影响下进行.运行过程中滤柱进水氨氮质量浓度逐渐增加至1.2,2.2,4.5 mg/L,其滤柱进出水及沿层氨氮、亚硝酸盐、铁、锰质量浓度分别如图4、5所示.
图4(a)中,投加氨氮质量浓度为1.2 mg/L运行的5 d内,同样由于氨氧化细菌在较短时间内并未得以富集,氨氮未发生降解,图4(b)中亦无亚硝酸盐氮生成.而由图5(a)可以看出,此时氨氮沿滤层呈均匀分布,其铁锰质量浓度沿滤层变化依然呈现出与添加亚硝酸盐时相似的变化,即分别在滤层0~30 cm与0~60 cm内得到高效去除,此氨氮质量浓度范围并未影响铁锰的去除.随后氨氮质量浓度继续提高至2.2 mg/L左右,仅运行1 d后,图4(a)中氨氮便得到去除,同时图4(b)中伴随着亚硝酸盐的积累呈现上升趋势,在第10天时其质量浓度达到0.7 mg/L,而其出水中铁锰质量浓度依然维持在0.1 mg/L以下水平.一方面,由上述实验结果得知,亚硝酸盐并不会破坏滤柱除铁锰性能;另一方面,尽管图4(a)中氨氮质量浓度2.2 mg/L时得以降解,但图5(a)中其质量浓度在滤层0~60 cm内仍保持高于1.2 mg/L的质量浓度,图5(c)、5(d)表明滤柱沿滤层铁锰去除性能同样没有受到该质量浓度范围氨氮的影响.

图4 氨氮各质量浓度梯度下生物滤柱除铁锰性能
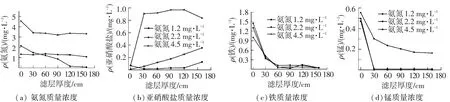
图5 氨氮、亚硝酸盐、铁、锰质量浓度沿滤层深度变化
直至氨氮质量浓度提高至4.5 mg/L左右时,图4(a)中氨氮降解量约为1.5~2.0 mg/L,图4(b)中亚硝酸盐出现最大程度的积累.此进水质量浓度下运行数日后滤柱出水锰质量浓度呈上升趋势,至15 d时出水锰质量浓度超标(ρ(锰)>0.1 mg/L),而出水铁质量浓度仍处于0.05 mg/L以下水平.由图5(a)可知,此时氨氮的降解主要发生在滤层0~30 cm内,并且在其他滤层深度内氨氮质量浓度没有明显变化.同时由图5(c)、5(d)中铁、锰质量浓度沿层变化可知,在氨氮质量浓度作用下,除锰层(0~30 cm)内MnOB活性受到明显抑制,除铁性能却没有任何影响.在氨氮降解的整个过程中,滤柱出水溶解氧质量浓度始终维持在2.4~2.8 mg/L,满足MnOB对溶解氧的需求(氧化1 mg/L Mn2+仅需匹配溶氧质量浓度0.29 mg/L)[13]以及亚硝酸盐并不会破坏滤柱除铁锰性能.因此,氨氮抑制MnOB活性是造成锰超标的主要原因.
另外,Pacini等[14]认为MnOB包含了绝大多数种类的铁氧化细菌,这类细菌可同时氧化铁锰.然而对比添加亚硝酸盐与氨氮铁的沿层去除发现,即使在氨氮严重抑制MnOB活性造成滤柱出水锰超标时,铁的沿层去除性能仍没有受到影响,表现出了稳定的除铁性能.进一步证明了化学接触氧化作用在铁的氧化去除过程中占有主导地位,与Tekerlekopoulou等[15]的研究成果一致.
2.3氨氮与亚硝酸盐氮对MnOB活性的影响
由以上实验结果得知,氨氮对MnOB氧化活性具有抑制作用,却不能明确氨氮硝化作用的中间产物亚硝酸盐对MnOB的影响.因此,根据2.1所提出的亚硝酸盐对MnOB作用存在的3种可能性,通过建立SBR反应器进一步明确氮素对锰氧化细菌的影响.MnOB主要通过分泌胞外酶对水中锰离子进行氧化,其分泌量的高低将直接导致氧化锰的多少.因此,可利用锰的去除效果间接考察MnOB活性大小.结果如图6所示.可以看出,SBR反应器运行的各个周期内,锰的氧化去除呈现良好的线性关系,以零级反应进行,因此,可以以零级反应常数k(dρ(Mn)/d t=-k)表征锰氧化细菌活性,其值大小从某种程度上代表了氧化活性的强弱.各个运行周期内,锰质量浓度随时间去除线性拟合参数关系见表1.

图6 氨氮、亚硝酸盐氮、硝酸盐氮对MnOB氧化活性影响
前已述及管网水中含有一定量硝酸盐氮(约为5~6 mg/L),考虑到在氨氮与亚硝酸盐氮氧化过程中有硝酸盐氮生成,图6(a)先考察了硝酸盐氮对MnOB活性影响.表1中,在添加硝酸盐氮运行的3个周期内,其反应常数k分别为0.065,0.062,0.066 mg·L-1·h-1,对应拟合R2值分别为0.97,0.97,0.97,k平均值维持在0.064 0± 0.002 1.可见硝酸盐氮对MnOB活性无明显抑制或促进作用,因此,将MnOB在硝酸盐质量浓度下的氧化活性作为参比,考察氨氮、亚硝酸盐氮的影响不会对本实验产生干扰.

表1 各氮素质量浓度水平下MnOB氧化活性拟合降解常数k及R2值
表1中,在添加亚硝酸盐质量浓度为0.5 mg/L的第4个周期内,锰的去除反应常数k为0.065 mg·L-1·h-1(R2=0.099),十分接近前3个周期平均k值,似乎MnOB活性未受到影响;第5个周期继续提高亚硝酸盐氮质量浓度至1.0 mg/L时,其k值较大幅度提高至0.089 mg·L-1·h-1(R2=0.096);而第6个周期亚硝酸盐质量浓度提高至1.5 mg/L时,其k值为0.091 mg·L-1·h-1(R2=0.097),相比第5个周期仅有微弱提高.表明亚硝酸盐质量浓度为0.5 mg/L左右并不会对MnOB带来任何影响,而约1.0 mg/L质量浓度水平亚硝酸盐则可以显著提高其活性;同时,应该看到对于相对较高质量浓度水平(约1.5 mg/L亚硝酸盐)并未进一步造成k的显著提高.原因可能是亚硝酸盐对不同数量MnOB氧化活性的促进作用存在不同的阈值.因此,对于某一数量MnOB,当亚硝酸盐质量浓度低于MnOB所对应的阈值时,其对MnOB氧化活性不产生促进作用;而当其质量浓度高于这一阈值时,MnOB活性亦不再显著提高.
第7与第8个周期分别在氨氮质量浓度1.0,1.5 mg/L条件下运行,尽管图6(c)中锰去除依然呈现良好的线性关系,但由表1中可见其k值分别降低至0.078 mg·L-1·h-1(R2=0.94),0.077 mg·L-1·h-1(R2=0.93),显然MnOB氧化活性受到氨氮抑制.特别是当氨氮质量浓度继续提高至2.0 mg/L时,MnOB活性受到更大程度的抑制,表1中其k值继续降至0.59 mg·L-1·h-1(R2=0.87),线性去除模式受到破坏.另外由图6(c)中锰质量浓度变化曲线可知,反应至17~24 h时间段内锰基本没有得到去除.为进一步明确氨氮对MnOB活性影响,将第9个反应周期延长至48 h,并在29 h检测氨氮为0时,继续取样检测锰质量浓度变化情况(记为周期9-1).在接下来所延长的反应时间内,表1中其k值为0.056 mg·L-1·h-1,尽管依然维持与前24 h内k值相当水平,但如图6(c)中拟合直线9-1所示,其锰去除首先恢复为零级反应模式,呈现良好的线性关系,表1中其R2值拟合为0.99.随之,在第10个周期内未添加氨氮时,图6中依然表现出良好的线性去除(R2=0.99),表1中其k值提高为0.104 mg·L-1·h-1.一方面表明MnOB活性在氨氮存在时受到抑制,影响锰的氧化去除,而当氨氮被氧化去除时MnOB的活性可得以恢复;另一方面,与第6个反应周期内k值水平相比,第10个周期内k值有所提高,原因是添加氨氮质量浓度的3个反应周期内尽管MnOB活性受到抑制,仍存在锰的去除,即MnOB一直处于代谢增殖状态,其数量相对第6个反应周期增多,因此,在无氨氮抑制的第10个周期内MnOB活性得以恢复,其k值较第6周期有所提高.由此进一步证明了氨氮对于MnOB活性存在抑制作用,而作为微生物繁殖代谢的必需氮源,亚硝酸盐似乎更容易被MnOB利用,从而验证了上述亚硝酸盐对MnOB作用的第二种可能性.
3 结 论
1)氨氮与亚硝酸盐均不影响生物滤柱除铁效果.
2)进水亚硝酸盐质量浓度为0.1,0.2,0.3,0.7 mg/L时,生物滤柱除锰效果不受影响;SBR实验结果进一步表明,亚硝酸盐能强化MnOB氧化锰能力.
2)SBR实验结果表明,氨氮对MnOB氧化锰能力具有抑制作用,但对于成熟生物滤柱,由于其内部包含生物量较多,当进水氨氮质量浓度为1.2,2.2 mg/L时,这种抑制作用不足以破坏除锰效果;直至氨氮质量浓度提高至4.5 mg/L时,除锰效果恶化导致出水锰质量浓度超标.
4)对于生物滤池的启动,可首先接种硝化细菌至完全硝化过程建立后,再接种MnOB以减弱氨氮对其的影响.
[1]李冬,杨宏,张杰.首座大型生物除铁除锰水厂的实践[J].中国工程科学,2003,5(7):53-57.
[2]李冬,张杰,王洪涛,等.生物除铁除锰滤池的快速启动研究[J].中国给水排水,2005,21(12):35-38.
[3]张杰,李冬,杨宏,等.生物固锰除锰机理与工程技术[M].北京:中国建筑工业出版社,2005:209-234.
[4]朱炎.生物净化含铁锰及氨氮地下水研究[D].哈尔滨:哈尔滨工业大学市政环境工程学院,2010.
[5]曾辉平.含高质量浓度铁锰及氨氮的地下水生物净化效能与工程应用研究[D].哈尔滨:哈尔滨工业大学市政环境工程学院,2010.
[6]TEKERLEKOPOULOU A G,VAYENAS D V.Simultaneous biological removal of ammonia,iron and manganese from potable water using a trickling filter[J].Biochemical Engineering Journal,2008,39(1):215-220.
[7]ŠTEMBAL T,MARKIC′M,RIBICIC′N,et al.Removal of ammonia,iron and manganese from groundwaters of northern Croatia—pilot plant studies[J].Process Biochemistry,2005,40(1):327-335.
[8]MOUCHET P.From conventionalto biological removalof iron and manganese in France[J].Journal American Water Works Association,1992,84(4):158-167.
[9]GOUZINIS A,KOSMIDIS N,VAYENAS D V,et al.Removal of Mn and simultaneous removal of NH3,Fe and Mn from potable water using a trickling filter[J].Water Research,1998,32(8):2442-2450.
[10]VANDENABEELE J,DE BEER D,GERMONPRE R,et al.Influence of nitrate on manganese removing microbial consortia from sand filters[J].Water Research,1995,29(2):579-587.
[11]MICHALAKOS G D,NIEVA J M,VAYENAS D V,et al.Removal of iron from potable water using a trickling filter[J].Water Research,1997,31(5):991-996.
[12]VANDENABEELE J,WOESTYNE M V,HOUWEN F,et al.Role of autotrophic nitrifiers in biological manganese removal from groundwater containing manganese and ammonium[J].Microbial Ecology,1995,29(1):83-98.
[13]杨宏,李冬,张杰,等.生物固锰除锰机理与生物除铁除锰技术[J].中国给水排水,2003,19(6):1-5.
[14]PACINI V A,MARÍA I A,SANGUINETTI G.Removal of iron and manganese using biological roughing up flow filtration technology[J].Water Research,2005,39(18):4463-4475.
[15]TEKERLEKOPOULOU A G,VAYENAS D V.Ammonia,iron and manganese removal from potable water using trickling filters[J].Desalination,2007,210(1/2/3):225-235.
(编辑刘 彤)
Influence of ammonia and nitrite on performance of Fe and Mn removal by biofilter
CAI Yanan1,LI Dong1,ZENG Huiping1,ZHANG Jie1,2
(1.Key Laboratory of Beijing Water Quality Science and Water Environment Recovery Engineering,Beijing University of Technology,100124 Beijing,China;2.State Key Laboratory of Urban Water Resource and Environment,Harbin Institute of Technology,150090 Harbin,China)
The pilot⁃and lab⁃scale reactor was constructed,respectively,to evaluate the influence of ammonia and nitrite on the performance of Fe and Mn removal.The results of pilot⁃scale filter indicated that the nitrite concentration of 0.1,0.2,0.3,0.7 mg/L,had no effects on Fe and Mn removal,as well the ammonia concentration of 1.2 and 2.2 mg/L.However,the ammonia concentration about 4.5 mg/L would inhibit the Mn removal,resulting in higher Mn in effluent than requirements;The lab⁃scale SBR experiments demonstrated that the activity of Mn oxidizing bacteria(MnOB)was enhanced by nitrite,but inhibited by ammonia,which showed the importance of nitrification in biological removal of Fe,Mn and ammonia process,especially in the period of start⁃up.
Fe and Mn removal;nitrification;purification of groundwater;biological filter;Mn oxidizing bacteria activity
TU991.26
A
0367-6234(2014)08-0096-06
2013-09-20.
国家自然科学基金优秀青年科学基金资助项目(51222807);教育部新世纪优秀人才支持计划资助项目(NCET⁃10⁃0008).
蔡言安(1986—),男,博士研究生;
李 冬(1976—),女,教授,博士生导师;
张 杰(1938—),男,博士生导师,中国工程院院士.
李 冬,lidong2006@bjut.edu.cn.

