雪硅钙石/HAp复合材料对Cd(Ⅱ)的吸附性研究
张超武, 缪金良, 徐 彬, 王 芬,袁西成, 时春辉, 宋大龙
(1.陕西科技大学 材料科学与工程学院, 陕西 西安 710021; 2.铜川耀州窑文物复制工厂, 陕西 铜川 727001)
0 引言
镉是重金属元素的一种,它不是人体生活所必须的元素,长期饮用含镉超标的水易造成镉在人体肝脏中富集,从而引发疾病,例如日本曾经发生的“骨痛病”.目前主要采用吸附法去除水体重金属离子,常用的吸附剂有活性炭,金属氧化物[1],沸石[2]等,但往往受到来源和成本的限制.
雪硅钙石(Tobermorite)是矿物材料的一种,其理想结构式为Ca5Si6O16(OH)2·4H2O,可作为廉价吸附剂使用,其结构与无定型C-S-H相非常接近[3].近年来的研究表明,其对重金属离子如Ag2+,Zn2+,Hg2+,Cd2+等有良好的吸附性能[4, 5].雪硅钙石对于重金属离子的去除主要是通过离子交换进行的,即目标重金属离子能够进入雪硅钙石晶格之中,同时晶格中游离态的Ca2+被置换出来进入到溶液之中[3].
自然生成和人工合成的未掺杂的雪硅钙石由于钙离子是以强的钙氧键形式插入在分离的片层中间,从而使其对重金属的吸附性能较低[6].羟基磷灰石(HAp)能够对多种重金属离子起到容纳和固定的作用[7-9].HAp除了能够通过离子交换去除重金属离子外,还能够通过静电吸附、溶解沉淀作用去除重金属离子[10].
近年来对于雪硅钙石的研究主要是通过取代掺杂例如Al掺杂来提高其吸附性能[11-13].但并不是所有物质的掺杂都能够提高雪硅钙石的吸附性能;Mostafa等[14]证明Fe,Mg掺杂的雪硅钙石的吸附容量就低于未掺杂的雪硅钙石;除掺杂外,复合也是常用的增强性能的方法;Maeda等[15, 16]先后制备出抗弯强度较高的雪硅钙石/沸石,雪硅钙石/羟基磷灰石复合材料;但对复合材料吸附重金属尤其是Cd2+的研究较少报道.
本文通过水热共生法将雪硅钙石和羟基磷灰石按一定的比例复合,通过单因素实验和正交试验相结合的方法验证pH,温度,时间和Cd2+初始浓度对雪硅钙石/羟基磷灰石(Tob/HAp)复合材料吸附Cd2+的性能的影响先后次序,并得到优化吸附条件.然后进行吸附热力学和动力学的分析.目前对于此种复合材料的优化制备工艺条件和对其它重金属离子和多离子系统的吸附研究正在逐步研究中.
1 实验部分
1.1 样品制备
以Ca(OH)2(分析纯),Na2SiO3·9H2O(分析纯),H3PO4(分析纯)为原料,按照n(Tob)/n(HAp)=9∶1(摩尔比),固体总质量为1 g标准,分别称取0.203 8 g Ca(OH)2和0.767 4 g Na2SiO3·9H2O充分研磨混合均匀,移入水热反应釜,加入1 mol·L-1H3PO4溶液0.3 mL.按照液/固=25∶1加入去离子水,充分搅拌均匀.然后在190 ℃条件下保温16 h,结束后自然冷却至室温.所得产物用去离子水反复抽滤洗涤多次.放入恒温干燥箱,80 ℃干燥至恒重即得样品.
1.2 样品表征与测试
采用日本理学D/max2200pc型X射线衍射分析仪(XRD)对其结构进行表征,工作条件为:Cu靶Kα线,工作电压40 Kv,工作电流40 mA,扫描步长0.02 °,扫描范围5 °~70 °;采用日本日立S-4800型扫描电镜(SEM)对其形貌进行表征分析,工作电压:3.0 Kv;采用日本HITACHI公司Z-2000型偏振塞曼原子吸收光谱仪对其吸附性能进行分析.
1.3 样品吸附性能测试
Cd2+标准溶液的配制:称取0.137 2 g Cd(NO3)·4H2O,溶于500 mL去离子水中,配制浓度为100 mg·L-1的Cd2+标准溶液,实验根据需要以此标准溶液配制不同浓度的Cd2+工作液.
量取25 mL一定浓度的Cd2+工作液加入100 mL锥形瓶中,称取0.05 g样品加入其中.调节不同pH、吸附温度、吸附时间、Cd2+初始浓度在匀速搅拌条件下进行吸附实验;实验结束后,离心过滤,用原子吸收光谱测定滤液中剩余Cd2+的浓度,绘制相关曲线进行分析;吸附能力的强弱采用吸附率Q或者吸附容量Qe表示[17].
吸附率计算公式:
(1)
式(1)中,Q为吸附率,C0为起始Cd2+浓度(mg·L-1),C为吸附结束滤液中剩余Cd2+浓度.
吸附容量计算公式:
(2)
式(2)中,Qe为吸附容量(mg·g-1),C0为起始Cd2+浓度(mg·L-1),C为吸附结束滤液中剩余Cd2+浓度;V为Cd2+溶液体积(L),m为所用Tob/HAp质量(g).
2 结果与讨论
2.1 XRD分析
图1是Tob/HAp复合材料样品的XRD图,由图可知,在2θ约7.8 °(001),29.0 °(221),31.9 °(400)时均出现了雪硅钙石(JCPDS:70-3655)的特征衍射峰,同时羟基磷灰石(JCPDS:74-0566)的特征衍射峰也在2θ约25.3 °(201),25.9 °(002),33.1 °(300),49.5 °(213)出现.

图1 雪硅钙石/HAp复合材料的XRD图谱
选取以上各特征衍射峰所对应的晶面指数和d值根据晶格常数计算公式(3)可得晶格常数[12].其结果如表1所示;
(3)
式(3)中,d为各特征衍射峰对应d值(nm);h,k,l为晶面指数;a,b,c为晶格常数.
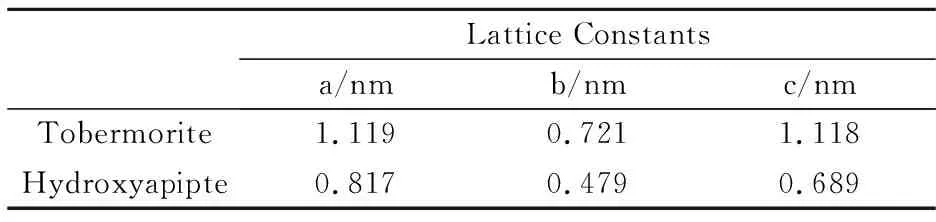
表1 合成Tob/HAp复合材料的晶格常数
由表1可知,所得样品含11 Å雪硅钙石,且结晶状况良好,为斜方晶体[12].
2.2 表面形貌分析
图2是Tob/HAp复合材料的SEM图,由图可知,所得样品由长棒状晶体和微球组成,结合XRD分析可知,长棒状为雪硅钙石斜方晶体,而微球则为羟基磷灰石晶体.

(a)100 000倍 (b)20 000倍图2 Tob/HAp复合材料SEM图
2.3 Cd2+吸附性能分析
2.3.1 pH的影响
在多个100 mL锥形瓶中,加入50 mg·L-1Cd2+溶液25 mL,分别调节pH为2.0,2.5,2.8,3.5,4.5,6.5,7.5,9.0,10.5,12.0.称取0.05 g Tob/HAp样品加入其中,调节吸附温度为30 ℃,匀速搅拌,反应30 min.反应结束,离心过滤,测定滤液中剩余Cd2+的浓度;吸附结果如图3所示.

图3 pH与Cd2+吸附率的关系
由图3可知,pH小于4.0的较强的酸性环境不利于吸附反应的进行,这可能是因为强酸环境导致Tob/HAp复合材料溶解,晶格结构被破坏,晶格中能够用于离子交换的Ca2+随着材料的溶解而减少,从而导致吸附动力不足;随着pH的逐渐增大,吸附率也逐渐上升并在pH大于4.0以后稳定在94%~98%之间.碱性条件下吸附率较高,这是因为在碱性条件下,溶液中含有大量的OH-,能够与Cd2+发生化学沉淀作用,增大去除率.
2.3.2 吸附温度的影响
量取25 mL Cd2+浓度为50 mg·L-1溶液加入100 mL锥形瓶中,称取0.05 g样品加入其中,调节pH为6.5,温度依次为15 ℃,20 ℃,25 ℃,30 ℃,40 ℃,50 ℃,60 ℃,70 ℃,80 ℃,分别匀速搅拌反应30 min.反应结束,离心过滤,测定滤液中剩余Cd2+浓度.结果如图4所示.
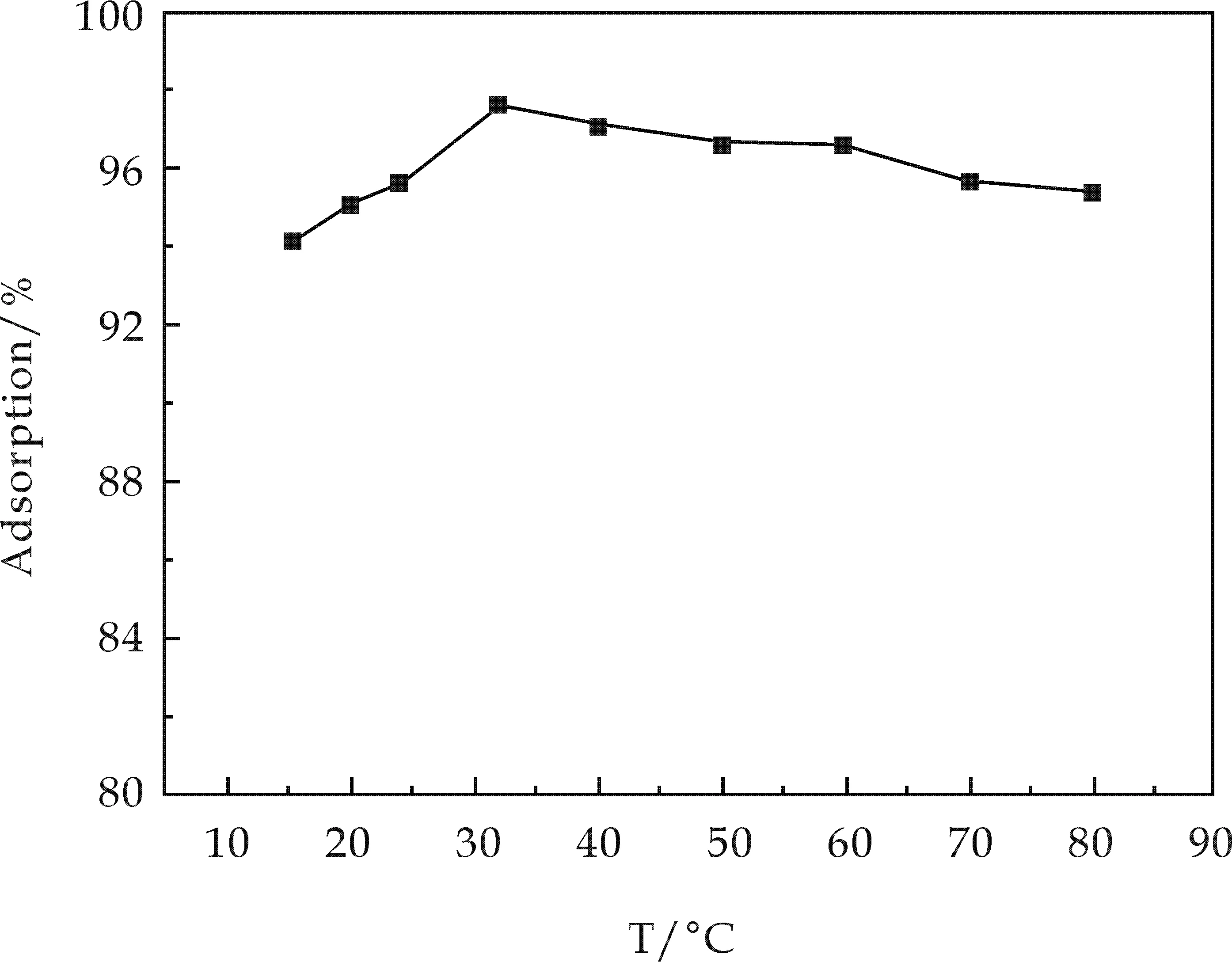
图4 吸附温度对Cd2+吸附率的影响
由图4可知,Tob/HAp材料对Cd2+的吸附率随着温度的变化不是很大,基本全部稳定在94%~98%之间,且温度较高时的吸附率高于温度较低时的吸附率,这是由于温度的升高使得离子在溶液中的活动能力增强,从而能够比较容易的进入吸附材料的晶格之中进行离子交换.
2.3.3 吸附时间的影响
在多个100 mL锥形瓶中,加入50 mg·L-1Cd2+溶液25 mL,称取0.05 g样品加入其中,调节pH为6.5,控制温度为30 ℃,分别反应不同的时间.反应结束离心过滤,测定滤液中剩余Cd2+的浓度.结果如图5所示.
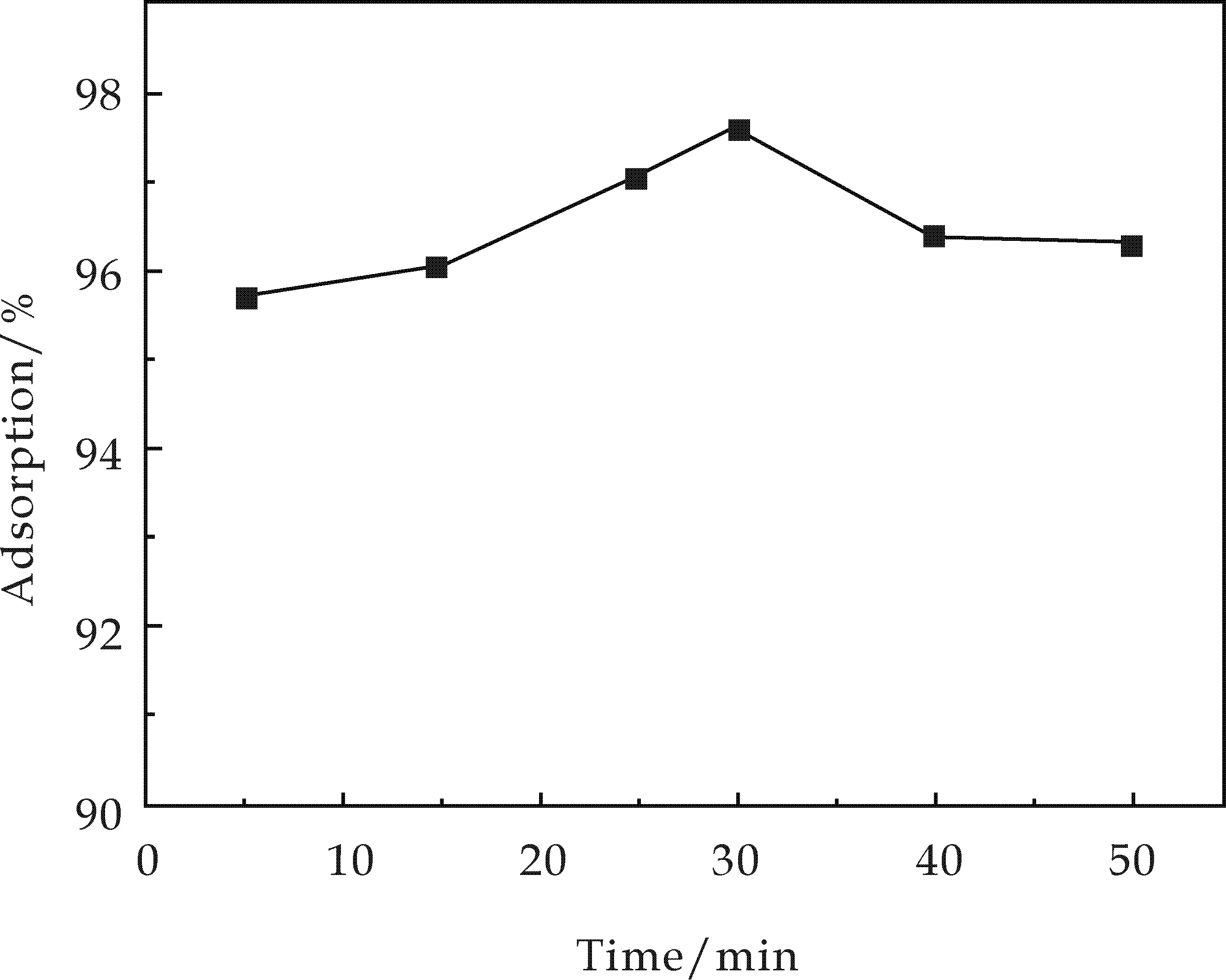
图5 吸附时间对Cd2+吸附率的影响
由图5可知,吸附刚进行5 min时吸附率已达95.5%,随着反应时间的延长,样品对Cd2+的吸附率逐渐增大,并在30 min左右达到97.5%,随后呈现下降趋势并逐渐趋于平稳.这可能是因为反应前期样品对Cd2+的吸附能力大于解吸能力,随着反应时间的增加逐渐达到吸附-解吸平衡的状态.
2.3.4 Cd2+初始浓度的影响
用100 mg·L-1镉离子标准溶液分别配制浓度为50,70,100,150,200,250,300,400 mg·L-1的Cd2+工作溶液25 mL,加入锥形瓶中,调节pH为6.5,各加入0.05 g样品,控制吸附温度为30 ℃,匀速搅拌反应30 min.反应结束后离心过滤,测定滤液中剩余Cd2+的浓度.结果如图6所示.
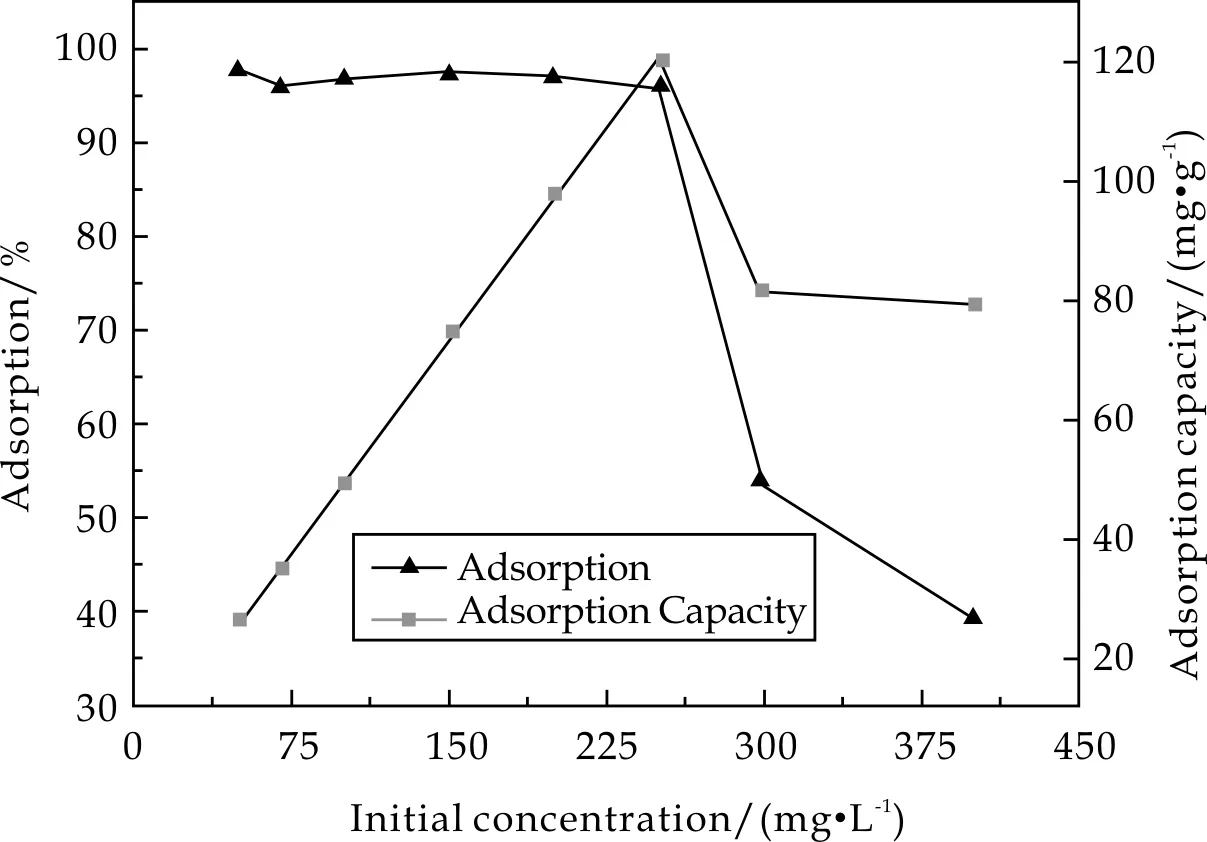
图6 Cd2+初始浓度对吸附率和吸附容量的影响
由图6可知,Cd2+浓度低于250 mg·L-1时吸附率稳定在95%左右,吸附容量则随着浓度的升高逐渐增大达到120 mg·g-1左右.当浓度超过250 mg·L-1时,解吸能力强于吸附能力,吸附率则有明显的下降趋势,且吸附容量也随之下降并在80 mg·g-1左右趋于平稳.
2.3.5 正交试验设计及分析
为了考察Cd2+初始浓度,pH,吸附温度,吸附时间四个影响因素对吸附率影响的大小次序,分别对四个因素各取三个水平值,以吸附率为考察指标,设计如表2所示四因素三水平正交实验.实验设计及结果如表2所示;吸附率最大的为第9组,达到98.96%,对各因素的极差进行比较可知,对Cd2+的吸附率影响先后次序为pH值,Cd2+初始浓度,时间和温度.优化吸附条件为:pH 6.5,初始浓度200 mg·L-1,吸附时间30 min,吸附温度40 ℃.

表2 Tob/HAp吸附Cd2+正交试验
2.4 吸附热力学分析
Langmuir单分子层吸附等温模型[7]是在表面均匀,吸附物之间无相互作用,且达到吸附-解吸动态平衡基本假设下建立的,其线性方程如式(4)所示:
(4)
式(4)中,Ce为吸附平衡时剩余Cd2+浓度(mg·L-1),qe为单位质量样品吸附Cd2+的量(mg·g-1),Q0为吸附平衡时吸附容量(mg·g-1),K为吸附常数.
Freundlich吸附等温方程[7]是在假设表面能不均匀的前提下提出的经验公式,其线性方程如式(5).
(5)
式(5)中,qe为单位质量样品吸附Cd2+的量(mg·g-1),Ce为吸附平衡时剩余Cd2+浓度(mg·L-1),Kf和n为吸附常数.
在正交实验的基础之上,分别配制50~250 mg·L-1不同浓度的Cd2+溶液各25 mL,调节pH为6.5,加入样品0.05 g,吸附30 min,温度为40 ℃,反应结束后离心过滤,将所得实验数据作Langmuir拟合和Freundlich拟合,结果如图7、图8、表3和表4所示;样品吸附Cd2+的过程更为符合Langmuir单分子层吸附模型,Langmuir拟合结果显示平衡吸附容量可达79.37 mg·g-1,与单因素实验Cd2+初始浓度的影响所得结果相近.

表3 Tob/HAP吸附Cd2+的Langmuir拟合结果

表4 Tob/HAP吸附Cd2+的Freundlich拟合结果

图7 Langmuir拟合曲线

图8 Freundlich拟合曲线
2.5 吸附动力学分析
对于吸附动力学的分析主要采用准二级速率方程[18],Elovich方程[19]和Weber-Morris方程进行拟合;它们的线性表达式如式(6)~式(8)所示.
准二级速率学方程:
(6)
Elovich方程:
(7)
Weber-Morris方程:
qt=kidt1/2+c
(8)
式(6)~(8)中,qt为t时刻的吸附容量(mg·g-1);t为吸附时间(min);K,a,b为相应吸附常数;Kid为颗粒扩散速率常数.
分别测定30 ℃条件下样品对50 mg·L-1Cd2+溶液吸附5,15,25,30,40,50 min时刻的吸附量,将实验结果依次进行准二级动力学方程,Elovich方程,Weber-Morris方程拟合.拟合结果如表5所示,当采用准二级动力学模型拟合时,R2等于0.999 9,拟合结果最好.所以Tob/HAp复合材料对Cd2+的吸附符合准二级动力学模型.

表5 样品吸附动力学拟合结果
3 结论
采用一次水热合成法成功制备出对Cd2+具有较强吸附性的Tob/HAp复合材料,结果表明:Tob/HAp复合材料对Cd2+吸附性能影响的次序依次为pH值,Cd2+初始浓度,吸附时间,吸附温度.并确定优化吸附条件为pH6.5,初始浓度200 mg·L-1,吸附时间30 min,吸附温度40 ℃.
吸附热力学结果表明吸附符合Langmuir单分子层吸附,平衡吸附量可达79.37 mg·g-1;吸附动力学拟合结果表明:Tob/HAp复合材料对Cd2+的吸附符合准二级动力学速率方程.
[1] Hua M,Zhang S,Pan B,et al.Heavy metal removal from water/wastewater by nanosized metal oxides:a review[J].J Hazard Mater,2012,211-212:317-331.
[2] Pepe F,de Gennaro B,Aprea P,et al.Natural zeolites for heavy metals removal from aqueous solutions:Modeling of the fixed bed Ba2+/Na+ion-exchange process using a mixed phillipsite/chabazite-rich tuff[J].Chemical Engineering Journal,2013,219:37-42.
[3] Mandaliev P,Wieland E,Dähn R,et al.Mechanisms of Nd(III) uptake by 11 Å tobermorite and xonotlite[J].Applied Geochemistry,2010,25(6):763-777.
[4] Coleman N J.Interactions of Cd(II) with waste-derived 11 Å tobermorites[J].Separation and Purification Technology,2006,48(1):62-70.
[5] Coleman N J,Bishop A H,Booth S E,et al.Ag+and Zn2+exchange kinetics and antimicrobial properties of 11 Å tobermorites[J].Journal of the European Ceramic Society,2009,29(6):1 109-1 117.
[6] Siauciunas R,Janickis V,Palubinskaite D,et al.The sorption properties of tobermorite modified with Na+and Al3+ions[J].Ceram-Silikaty,2004,48(2):76-82.
[7] Mobasherpour I,Salahi E,Pazouki M.Comparative of the removal of Pb2+,Cd2+and Ni2+by nano crystallite hydroxyapatite from aqueous solutions:Adsorption isotherm study[J].Arabian Journal of Chemistry,2012,5(4):439-446.
[8] 钱光人,白红梅,孙福成,等.含镉羟基磷灰石的形成及其稳定性[J].无机材料学报,2008,23(5):1 016-1 020.
[9] Feng Y,Gong J L,Zeng G M,et al.Adsorption of Cd (II) and Zn (II) from aqueous solutions using magnetic hydroxyapatite nanoparticles as adsorbents[J].Chemical Engineering Journal,2010,162(2):487-494.
[10] 张 俊,王德平,姚爱华,等.纳米羟基磷灰石对Ni2+的吸附性能及机理研究[J].无机材料学报,2009,24(2):269-274.
[11] Maeda H,Ogawa Y,Ishida E H,et al.Hydrothermal synthesis of tobermorite doped with phosphorus species for removing heavy metal ions[J].J Aust Ceram Soc,2012,48(1):8-11.
[12] Maeda H,Ishida E H,Kasuga T.Hydrothermal preparation of tobermorite incorporating phosphate species[J].Mater Lett,2012,68:382-384.
[13] Maeda H,Abe K,Ishida E H.Hydrothermal synthesis of aluminum substituted tobermorite by using various crystal phases of alumina[J].J Ceram Soc Jpn,2011,119(1 389):375-377.
[14] Mostafa N Y,Kishar E A,Abo-El-Enein S A.FTIR study and cation exchange capacity of Fe3+and Mg2+substituted calcium silicate hydrates[J].Journal of Alloys and Compounds,2009,473(1-2):538-542.
[15] Maeda H,Ioku K,Ishida E H.Hydrothermal synthesis of tobermorite/hydroxyapatite composites[J].Mater Lett,2008,62(17-18):3 291-3 293.
[16] Maeda H,Okada T,Ishida E H.Hydrothermal solidification of zeolite/tobermorite composites[J].J Ceram Soc Jpn,2009,117(1 362):147-151.
[17] Wei W,Sun R,Cui J,et al.Removal of nitrobenzene from aqueous solution by adsorption on nanocrystalline hydroxyapatite[J].Desalination,2010,263(1-3):89-96.
[18] Coleman N J,Trice C J,Nicholson J W.11 Å tobermorite from cement bypass dust and waste container glass:A feasibility study[J].International Journal of Mineral Processing,2009,93(1):73-78.
[19] 薛继龙,曹根庭,倪哲明.AB24在MgAl-LDO上的吸附性能及机理研究[J].无机化学学报,2012,28(6):1 117-1 124.

