尿脱落足细胞与IgA肾病的相关性研究
李利利,杨浩杰,张文静,尹爱平,孙吉平
(1.西安交通大学医院;2.西安交通大学医学院第一附属医院肾病中心肾内科,陕西西安 710061)
IgA肾病(IgA nephropathy, IgAN)已成为世界范围内最常见的原发性肾小球疾病,占原发性肾小球疾病的20%~50%[1-2]。IgA肾病的临床表现和病理表现多种多样,大多数患者病情呈进展性,约15%~40%的成人患者在10年后会进入终末期肾病[3-4],需替代治疗维持生命,给患者及社会带来了巨大的精神和经济负担。因此,正确认识和评价IgA肾病的疾病状态,寻找与疾病活动性、进展或预后相关指标对临床工作有重要意义。肾脏病理是IgA肾病诊断的金指标,但肾脏穿刺活检是一项有创检查,临床上难以通过反复肾脏穿刺来监测疾病的发展。近年来,血清、尿液中的一些无创伤性检查在IgA肾病诊断及病理损伤评估的研究已成为热点,对临床工作有重要的指导意义。
足细胞(podocyte)与基底膜和毛细血管内皮细胞一起构成肾小球血液滤过屏障,是维持肾小球滤过膜结构和功能正常的主要细胞之一[5]。当足细胞受到损伤时,细胞会发生一系列的形态改变,直至从基底膜上分离剥脱到肾小囊中,随尿液排除[6]。Podocalycin(PCX)由肾小球内皮细胞和足细胞合成,在足细胞成熟过程中固定于肾小球足细胞顶膜,对肾小球滤过屏障起负调节作用[7]。Podocalyxin蛋白是主要的足细胞标志蛋白,通常仅以抗Podocalyxin用于鉴别足细胞[8]。因此,我们试图通过检测尿中足细胞的标志性蛋白Podocalyxin表达来判断尿脱落足细胞数量,并与IgA肾病的临床病理进行相关性分析,以期为临床上治疗、预测疾病进展及预后提供一个新的无创伤的指标。
1材料与方法
1.1研究对象2011年4月至2011年10月在西安交通大学医学院第一附属医院肾脏内科行肾脏穿刺活检明确诊断为原发性IgA肾病的患者。入选标准:①行肾脏穿刺活检,病理明确诊断为原发性IgA肾病,其中包括光镜、免疫荧光及部分电镜诊断,每例标本光镜下肾小球数目≥5个肾小球,免疫荧光可见IgA或以IgA为主的免疫复合物在肾小球系膜区(伴有或不伴有毛细血管区)沉积,强度可分为+~;②性别不限,年龄≥12岁。排除标准:①排除过敏性紫癜、慢性酒精性肝病、乙肝病毒相关性肾病、强直性脊柱炎、银屑病、狼疮肾炎等继发性肾脏损害;②排除伴有其他原发性肾小球肾炎及糖尿病伴发IgA肾病;③排除各种药物、有机溶剂以及肿瘤等原因引起的肾脏损害。本研究经本院伦理委员会批准;参试者均签署知情同意书。
共收集到原发性IgA肾病的患者108例,有12例因光镜下肾小球数目<5个而剔除,最终入组共96例(男性58例,女38例,男∶女=1.52∶1);对照组10例,系来自我院泌尿外科单纯肾肿瘤切除,并排除肾脏其他疾病的患者。
1.2资料收集①基本资料。包括一般情况,如年龄、性别、病程、发病时是否伴有高血压、浮肿、腰痛;②实验室检查指标。包括尿液检查,如尿中红细胞、尿中上皮细胞、尿中管型细胞、24 h尿蛋白定量、尿β2微球蛋白;血液学检测包括白蛋白、血红蛋白、胆固醇、血β2微球蛋白、尿素氮、血肌酐、尿酸、胱抑素及免疫学指标IgA、IgE、IgG、IgM、C3、C4;③肾脏穿刺病理指标。肾小球、肾小管间质评分包括肾小球系膜增生程度、肾小球硬化程度、肾小管间质评分(RTIS)等;活动性指标如内皮细胞增生指数(endoI)、破坏肾小球毛细血管袢活动性指数(dGAI)、系膜细胞增生指数(MsHI)、系膜基质增多指数(MsMI)、肾小球慢性病变指数(GCI)、肾间质炎症细胞浸润指数(infI),慢性化指标包括肾小管萎缩和肾间质纤维化指数(TCI)及小动脉慢性病变指数(VCI)等。
1.3患者分组①不同程度蛋白尿分组:1组,24 h尿蛋白定量为0.3~1.0 g;2组,24 h尿蛋白定量为1.0~3.0 g;3组,24 h尿蛋白定量>3 g;对照组,24 h尿蛋白量<0.15 g。②不同程度肾功能分级分组:根据中国人改良后的公式eGFR=175×Pcr-1.234×age-0.179×[0.79 if female]计算患者eGFR,慢性肾脏病(CKD)分期按照K/DOQI慢性肾脏病临床实践指南分组:CKD 1期:GFR≥90 mL/(min·1.73m2),CKD 2期:GFR 60~89 mL/(min·1.73m2),CKD 3期GFR 30~59 mL/(min·1.73m2),CKD 4期GFR介于15~29 mL/(min·1.73m2),CKD 5期GFR<15 mL/(min·1.73m2)或透析。③病理分型:按照Lee病理分级将IgA肾病分为5级,标准如下:Ⅰ级表现为肾小球绝大多数正常,偶尔轻度系膜增宽(节段、伴或不伴细胞增生),间质基本正常;Ⅱ级表现为肾小球示局灶系膜增殖和硬化(<50%),罕见小的新月体,间质基本正常;Ⅲ级表现为弥漫性系膜增殖和增宽(偶尔局灶节段),偶见小新月体和粘连;局灶间质水肿,偶尔细胞浸润,罕见小管萎缩;Ⅳ级表现为重度弥漫性系膜增生和硬化,部分或全部肾小球硬化,可见新月体(<40%);小管萎缩,间质浸润,可见间质泡沫细胞;Ⅴ级表现为病变性质类似Ⅳ型,但更严重,肾小球新月体形成(>45%);间质类似Ⅳ病变,但更严重。④按照肾小管间质损害TlL程度分为4级,标准如下:Ⅰ级肾小管间质基本正常,轻度肾小管变性扩张;Ⅱ级小管萎缩、间质纤维化范围<20%,散在炎细胞浸润;Ⅲ级小管萎缩、间质纤维化范围30%~40%,散在和(或)弥漫炎细胞浸润;Ⅳ级:小管萎缩、间质纤维化范围>50%,散在和(或)弥漫炎细胞浸润。
1.4方法
1.4.1主要试剂 小鼠抗人Podocalyxin单克隆抗体(美国Invitrogen 公司);FITC标记的山羊抗小鼠IgG、牛血清白蛋白(BSA)、TritonX-100、PV-6000试剂盒均购自北京中杉金桥生物技术有限公司;碘化吡啶(PI,美国Sigma公司);甘油(北京中杉金桥生物技术有限公司)。
1.4.2免疫荧光法检测尿中足细胞Podocalyxin表达 留取肾脏穿刺活检当日清洁晨尿100 mL,离心(1 500 r/min,5 min),弃上清液;沉渣混匀,取20 μL涂片于相差显微镜观察并计数各类细胞及管型,初步了解尿沉渣中有无单个核细胞;取600 μL沉渣置于自动涂片离心机(Cytopro 7620)中,离心(1 200 r/min,5 min),取出玻片,室温干燥,4 ℃丙酮固定10 min,自然干燥;将干燥后的载玻片以PBS漂洗(3 min,3次),置入Triton X-100浸泡5 min,PBS漂洗(3 min,3次);牛血清白蛋白(BSA)封闭,室温孵育30 min;滴加第一抗体小鼠抗人Podocalyxin单克隆抗体(1∶50稀释),4 ℃过夜;4 ℃冰箱拿出后在室温下暖孵30 min;滴加第二抗体山羊抗小鼠抗体(FITC 1∶75稀释);37 ℃孵育30 min,孵育结束时不用PBS漂洗;复染细胞核,滴加碘化吡啶(PI)染核,室温避光孵育5 min;PBS漂洗(3 min,3次),50%甘油封片;采用双盲法,在荧光显微镜下观察(绿色荧光波长580 nm,蓝色荧光波长510 nm),每份标本低倍镜观察全片,高倍确认足细胞后摄像计算机储存,选择全片左上、左下、右上、右下、中间等位置20个高倍镜视野,记录完整的足细胞个数。
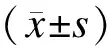
2结果
2.1尿脱落足细胞数量①按照蛋白尿程度分组:病例组尿脱落足细胞数量显著高于对照组(每个高倍镜下分别为5.334 8和0.300±0.674 9,P<0.05);不同程度蛋白尿组之间也存在统计学差异(表1)。②按照肾功能不同分组:病例组尿脱落足细胞数量显著高于对照组;随着肾功能进展,尿脱落足细胞数量也逐渐增多(表2)。③按照不同病理分型分组:病例组尿脱落足细胞数量显著高于对照组;随着病理改变加重,尿脱落足细胞数量也逐渐增多(表3)。④按照肾小管间质损害分组:病例组尿脱落足细胞数量显著高于对照组;肾小管间质损害越重,尿脱落足细胞数量也越多(表4)。
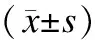
表1 不同程度蛋白尿水平IgA肾病尿脱落足细胞数量的比较
与对照组相比,*P<0.05;与1组相比,▲P<0.05;与2组相比,☆P<0.05。
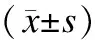
表2 不同肾功能IgA肾病尿脱落足细胞数量的比较
与对照组相比,*P<0.05;与1组相比,▲P<0.05;与2组相比,☆P<0.05。
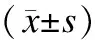
表3 不同病理分级IgA肾病尿脱落足细胞数量的比较
与对照组相比,*P<0.05;与1组相比,▲P<0.05;与5组相比,☆P<0.05。
表4 不同肾小管间质损害分级IgA肾病尿脱落足细胞数量的比较
与对照组相比,*P<0.05;与1组相比,▲P<0.05;与4组相比,☆P<0.05。
2.2脱落足细胞与肾脏病理的相关性分析尿脱落足细胞数量与endoI、MsHI 、MsMI之间无相关性(P分别为0.548、0.945、0.938);与dGAI 、GCI、infI、TCI、(VCI、总评分之间均呈显著的正相关,相关系数R分别为0.225(P=0.003)、0.325(P=0.001)、0.243(P=0.017)、0.335(P=0.001)、0.226(P=0.027)、0.409(P<0.001)。
2.3逐步线性回归分析尿脱落足细胞线性回归分析:24 h尿蛋白定量、收缩压、舒张压以及dGAI、TCI进入回归方程,回归方程:尿脱落足细胞=3.520+1.070 24 h尿蛋白-0.065收缩压+0.075舒张压+0.316 dGAI+0.691 TCI。尿脱落足细胞与上述指标有显著的关系,可以显著影响尿脱落足细胞数量(表5)。
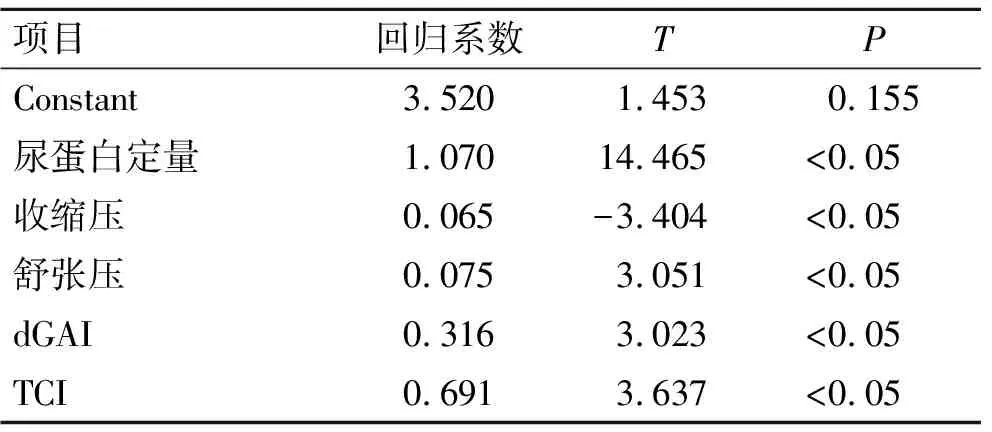
表5 尿脱落足细胞线性回归分析
3讨论
IgA肾病(IgA nephropathy, IgAN)是以肾小球系膜细胞和(或)基质增生、伴有系膜区IgA或者IgA为主的免疫复合物的颗粒状沉积、电镜下系膜区可见大量电子致密物沉积为特征的一类肾小球疾病。既往研究多集中于系膜细胞在IgA肾病的肾小球硬化中的作用,但近来研究表明足细胞的损伤与IgA肾病之间有密切的联系。足细胞除通过足突构成分子屏障外,电荷屏障也是阻止白蛋白从肾小球滤过的重要机制。足细胞Podocalyxin蛋白正常表达可以保证肾小球滤过膜电荷屏障的完整性,其抗粘附作用可使足突裂隙隔膜得以维持[9]。
目前,公认的IgA肾病预后不良的因素有大量蛋白尿、肾功能不全、发病时高血压等,特别蛋白尿是影响IgA肾病的独立危险因素,而足细胞的损伤常常与蛋白尿密切相关[10]。本研究结果提示,尿中Podocalyxin表达与蛋白尿程度呈正相关,这与NAKAMURA[11]研究慢性肾小球肾炎伴高胆固醇血症患者尿蛋白定量与尿足细胞数量呈正相关相一致。肾小球足细胞受损而导致足细胞数目的减少不仅可引起蛋白尿的发生,而且是肾小球硬化的始动环节[12-13]。而YU等[14]研究表明,尿中足细胞可能在反映肾小球损伤方面较尿蛋白更为敏感,因此尿足细胞数量有助于判断肾小球损伤程度及预后。
当足细胞受到损伤后,细胞发生一系列的表型改变,早期表现为足突回缩、整个足突的消失,随后出现足细胞胞体的缩小,假囊形成,阴离子电荷减少,最终从基底膜上分离剥脱到肾小囊中,这样肾小球的滤过膜发生损伤,引起肾小球滤过率的改变,即滤过率下降。MACCONI等[15]对大鼠的研究发现,足细胞数目的减少是足细胞功能缺陷和肾小球滤过功能障碍的决定因素。本研究发现,肾功能受损越严重,尿脱落足细胞数量越多,提示肾功能受损越严重,肾小球足细胞脱落越多,肾小球足细胞数量越少。研究表明,足细胞缺失与肾小球硬化的发生密切相关,当足细胞数减少10%~20%时,肾小球硬化即开始[16]。本研究发现,足细胞数量与系膜细胞评分之间无相关,可能与肾小球系膜细胞损害无直接关联。但是,尿中脱落足细胞数量与肾小球硬化评分、肾间质评分及活动性指标dGAI、infI间呈正相关,推测尿中Podocalyxin表达可能提示存在活动性病变。与慢性病变指标GCI、TCI、VCI均呈正相关性,证实了足细胞脱落只有在肾小球硬化达到20%时才能脱落入尿中,推测尿中Podocalyxin表达存在肾小球硬化的基础,可能是IgA肾病的进展因素之一。既往有学者[17]发现,IgA肾病尿中足细胞数量与肾脏病理活动性病变相关,连续监测结果得出累计足细胞脱落量与病理慢性病变的加重相关,提示尿中足细胞作为一项无创指标不仅能反映病理活动性,也是疾病进展因素之一。对IgA肾病患者长期随访研究发现,尿足细胞持续阳性者疾病持续进展。
有研究表明,足细胞与蛋白尿、肾小球硬化及慢性肾损伤进展密切相关,足细胞的减少及丢失已成为反映肾小球损伤严重程度和疾病进展的重要观测指标[10]。肾小球硬化、肾间质纤维化、高血压、大量蛋白尿和肾功能损害是学术界意见比较一致的影响IgA肾病进展的危险因素。由于肾小球硬化和肾间质纤维化是不可逆的损害,因此是预后不良强有力的危险因素。本研究发现24 h尿蛋白定量、血压、dGAI、TCI对尿脱落足细胞有显著影响;根据病理指标推测尿脱落足细胞不仅提示IgA肾病的活动性病变,且与慢性基础病变有一定关系,推测可能是IgA肾病进展因素之一。
本研究样本量有限,仅能发现尿脱落足细胞与临床病理变化存在相关性。此外,本研究为横断面研究,未随访患者病情进展情况,加入随访资料可能能更有力地说明尿脱落足细胞可能是IgA肾病进展因素之一。
参考文献:
[1] LIL S, LIU ZH. Epidemiologic data of renal disease from a single unit in China: Analysis based on 13.519 renal biopsies[J]. Kidney Int, 2004, 66(3):920-923.
[2] 刘刚,马序竹,邹万忠,等. 肾活检患者肾脏病构成十年对比分析[J]. 临床内科杂志, 2004, 21(12):834-838.
[3] HASS M. IgA nephropathy and Henoch-SChonlein Purpuera nephritis [J]. Heptinstall’s Pathol Kidney, 2007, 12(2):423-459.
[4] D’AMICO G. Natural history of idiopathic IgA nephropathy and factors presdictive of disease outcome[J]. Sem in Nephrol, 2004, 24(5):179-196.
[5] SMITH AC, FEEHALLY J. New in insight into the pathogenesis of IgA nephropathy, pathogenesis of IgA nephropathy[J]. Springer Sem in Immunpathol, 2003, 24(4):477-499.
[6] 王永钧. 肾脏病足细胞损伤及其防治研究进展[J]. 医学研究杂志, 2007, 36(11):11-14.
[7] TAKEDA T. Podocyte cytoskeleton is connected to the integral membrane protein podocalyxin through Na+/H+exchanger regulatory factor 2 and ezrin[J]. Clin Exp Nephrol, 2003,7:260-269.
[8] PETERMANN A, FLOEGE J. Podocyte damage resulting in podocyturia: A potential diagnostic marker to assess glomerular disease activity[J]. Nephron Clin Pract, 2007, 106(2):61-66.
[9] ERSHAW DB, THOMAS PE, WHARRAM BL, et al. Molecular cloning, expression, and characterization of podocalyxin 2 like protein 1 from rabbit as a transmembrane protein of glomerular podocytes and vascular endothelium[J]. J Biol Chem, 1995, 270 (49):29439-29446.
[10] SHANKLAND SJ. The podocyte’s response to injury: Role in proteinuria and glomerulosclerosis[J]. Kidney Int, 2006, 69 (12):2131-2147.
[11] NAKAMURA T, USHIYAMA C, HIROKARA K, et al. Effect of cerivastatin on proteinuria and urinary podocytes in patients with chronic glomerulonephritis[J]. Nephrol Dial Transplant, 2002, 17 (5):798-802.
[12] LY J, ALEXANDER M, QUQGGIN SE. A podocentric view of nephrology[J]. Curr Opin Nephrol Hypertens, 2004, 13:299-305.
[13] SMEETS B, TELOEKE NA, DIJMAN HB, et al. The parietal epithelial cell: a key player in the pathogenesis of focal segmental glomerulosclerosis in Thy-1.1 transgenic mice[J]. J Am Soc Nephrol, 2004, 15:928-939.
[14] YU D, PETERMANN A, KUNTER U, et al. Urinary podocyte loss is a more specific marker of ongoing glomerular damage than proteinuria[J]. J Am Soc Nephrol, 2005, 16 (6):1733-1741.
[15] MACCONI D, BONOMELLI M, BENIGNI A, et al. Pathophysiologic implications of reduced podocyte number in a rat model of progressive glomerular injury[J]. Am J Pathol, 2006, 168(1):42-54.
[16] KIM BK, HONG HK. Differential expression of nephrin in acquired human proteinuric diseases[J]. Am J Kidney Dis, 2002, 40(5):964-973.
[17] ARA M, YANAGIHARA T, KIHARA I. Cumulative excretion of urinary podocytes reflects disease progression in IgA nephropathy and Schonlein-Henoch purpura nephritis[J]. Clin J Am Soc Nephrol, 2007, 2(2):231-238.

