红枣果肉中黄酮类物质的提取及抗氧化性研究
李敏,刘月菊,张馨月
(西安文理学院 化学与化学工程学院,陕西 西安 710065)
绝大多数天然植物都能合成黄酮类化合物,黄酮类化合物在植物的组织内大多与糖结合,以黄酮苷的形式存在,少部分以游离态存在,此类化合物具有抗癌、抗菌、抗病毒、抗炎症、抗过敏、抗糖尿病并发症等多种生理活性及药理作用,同时它还是一种天然抗氧化剂,具有清除人体超氧离子自由基,抗衰老,增加机体免疫力的生理活性,是一类具有广泛开发前景的天然药物[1]。黄酮常见的提取方法有有机溶剂提取法、微波提取法、超临界萃取法、超声波辅助萃取法[2]。红枣是鼠李科属植物枣树的果实,在我国各地均有栽培,以色红、肉厚、饱满、核小、味甜者为佳。红枣具有极高的营养价值及药用价值。是集药、食、补三大功能为一体的保健食品,被誉为“木本粮食,滋补佳品”[3]。红枣还有一些具有很高生理活性的特殊功能成分,主要有红枣多糖、黄酮、腺苷、生物碱等。
本文采用超声波辅助法来研究新疆和陕北红枣中的黄酮类物质的最佳提取工艺,对比两种红枣黄酮提取液对超氧阴离子自由基、羟基自由基的清除能力,研究其抗氧化性。为红枣加工的进一步开发利用提供理论基础。
1 实验部分
1.1 试剂与仪器
红枣;亚硝酸钠、硝酸铝、氢氧化钠、无水乙醇、硫酸亚铁、水杨酸、三羟甲基氨基甲烷、邻苯三酚均为分析纯。
FW80 型高速粉碎机;722N 型可见分光光度计;YP202N 型电子天平;SHD-Ⅲ型循环水式多用真空泵;SB25-12D 型超声波清洗器;CMD-20X 型干烘箱。
1.2 实验方法
1.2.1 样品制备 红枣洗净去核,切碎,在75 ℃下烘干24 h,用粉碎机粉碎,过60 目筛备用。
1.2.2 芦丁标准曲线的绘制 精密吸取0.1 mg/L的芦丁标准液0,2.50,5.00,7.50,10.00,12.50 mL 于25.00 mL 容量瓶中,分别加入5%的NaNO20.75 mL静置6 min,再加入0.75 mL 10% Al(NO3)3摇匀静置6 min,再加入4% NaOH 溶液10 mL,摇匀,再用无水乙醇定容,摇匀静置10 min,以1 号为空白对照,在510 nm 处测其吸光度值。以芦丁含量为横坐标,吸光度为纵坐标绘制标准曲线,得回归线方程。
1.2.3 超声辅助法正交实验设计 为了进一步找出超声辅助法的最佳提取条件,将乙醇浓度(A)、提取时间(B)、料液比(C)3 个因素,各自取3 个水平,进行L9(34)正交设计实验,因素水平见表1。

表1 实验因素及水平Table 1 Factors and Levels of the test
1.2.4 红枣黄酮提取物抗氧化性的研究
1.2.4.1 对超氧阴离子自由基的清除能力 分别加入0.05 moL/L 的Tris-HCl 缓冲液5.00 mL,然后再分别加入2.00 mL 上述配制好的红枣黄酮提取液,再分别加入1. 00 mL 邻苯三酚反应4 min,加8 moL/L HCl 终止反应,摇匀。以蒸馏水为参比在300 nm 处测定吸光度Ax。按照上述步骤,以蒸馏水代替样品,测定吸光度A0。考虑到色素本身的吸光度值做了对照实验,以1.00 mL 蒸馏水代替邻苯三酚按照上述步骤测定Ax0,清除率计算公式如下[2]:

式中 A0——不含红枣提取物的标准体系吸光度;
Ax——标准体系的吸光度值;
Ax0——不含邻苯三酚的标准体系吸光度。1.2.4.2 对羟基自由基的清除能力 分别加入1.00,2.00,3.00,4.00 mL 红枣黄酮提取液再分别加入9.00,8.00,7.00,6.00 mL 蒸馏水,摇匀待用。
再分别取 4 支试管加 6 mmoL/L FeSO42.00 mL,6 mmoL/L H2O22.00 mL,6 mmoL/L 水杨酸5.00 mL,在37 ℃水浴中保温30 min 后取出,以蒸馏水为参比,在510 nm 下测其吸光度A0,然后再分别加入上述配制好的不同浓度的新疆红枣黄酮提取液2.00 mL 摇匀,在37 ℃水浴中保温30 min,以蒸馏水为参比,在510 nm 下测其吸光度Ax。考虑到色素本身的吸光度值,以2. 00 mL 蒸馏水代替H2O2,按照上述步骤,以蒸馏水为参比,在510 nm下测其吸光度Ax0,计算公式如下[4]:
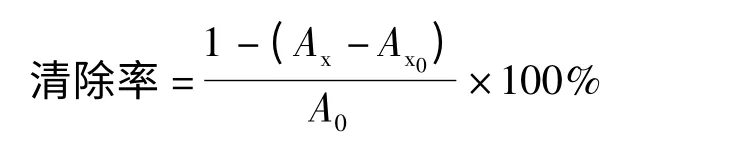
式中 A0——蒸馏水代替样品的对照组;
Ax——加样品后的吸光度;
Ax0——样品本身的本底吸光度值。
2 结果与讨论
2.1 芦丁标准曲线
按照1.2.2 节的方法,测得不同浓度的芦丁标准溶液的吸光度,所绘制的标准曲线见图1,回归线方程为y=14.326x+0.072 9,R2=0.996 9。

图1 芦丁标准曲线Fig.1 Standard curve of rutin
2.2 正交实验结果
由表2 可知,影响新疆红枣黄酮提取率的因素次序为:A >B >C,即乙醇浓度>提取时间>料液比,因此最佳提取工艺为A1B3C2,即乙醇浓度为50%,提取时间为50 min,料液比为1 ∶30 g/mL。新疆红枣黄酮的提取率可达8.91 mg/g。
由表3 可知,影响陕北红枣黄酮提取率的因素的次序为:A >C >B,即乙醇浓度>料液比>提取时间,因此最佳提取工艺为:A2B3C1,即乙醇浓度为60%,提取时间为50 min,料液比1 ∶20 g/mL。陕北红枣黄酮的提取率可达18.56 mg/g。
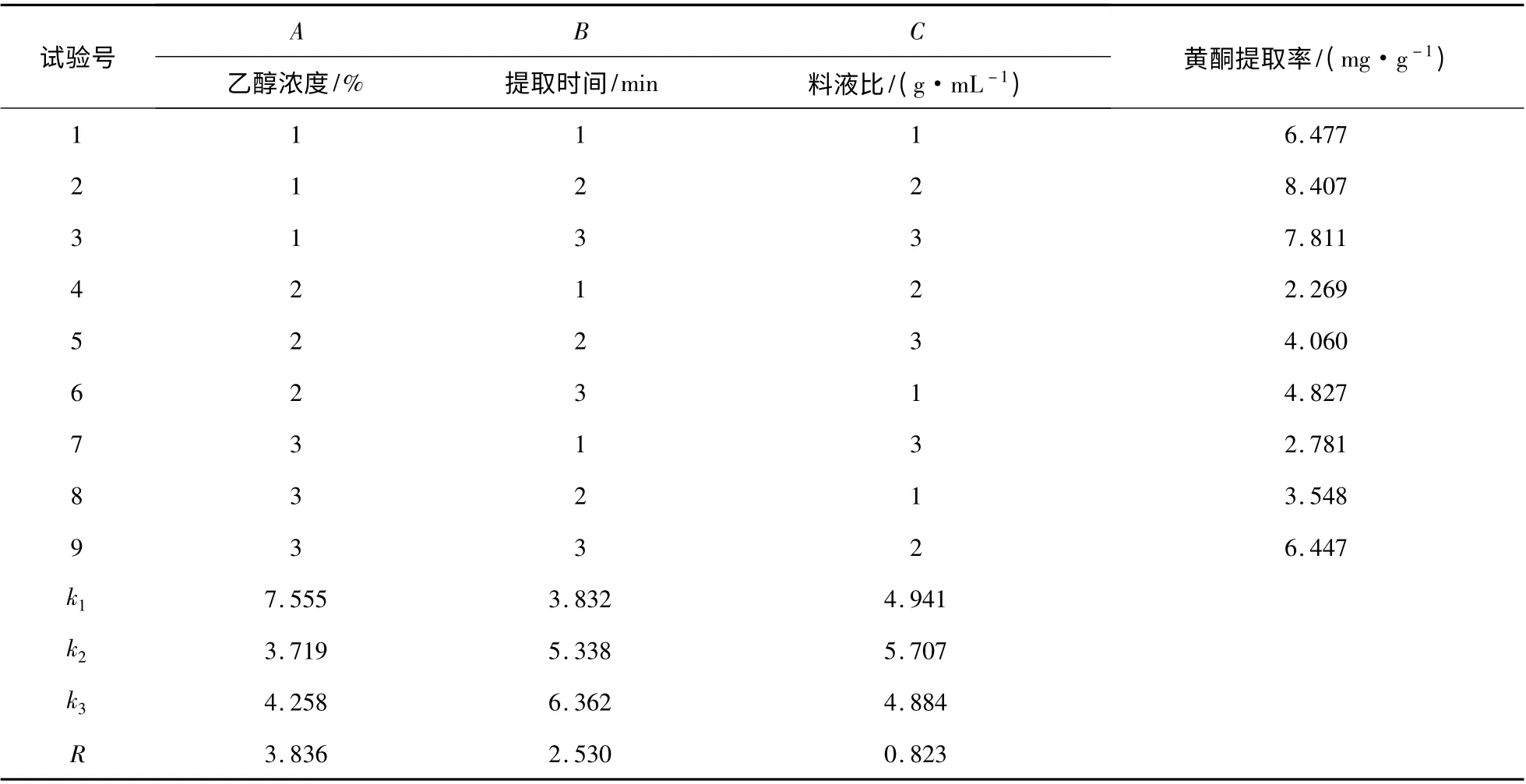
表2 新疆红枣正交实验结果Table 2 The orthogonal experiment results of Xinjiang red dates
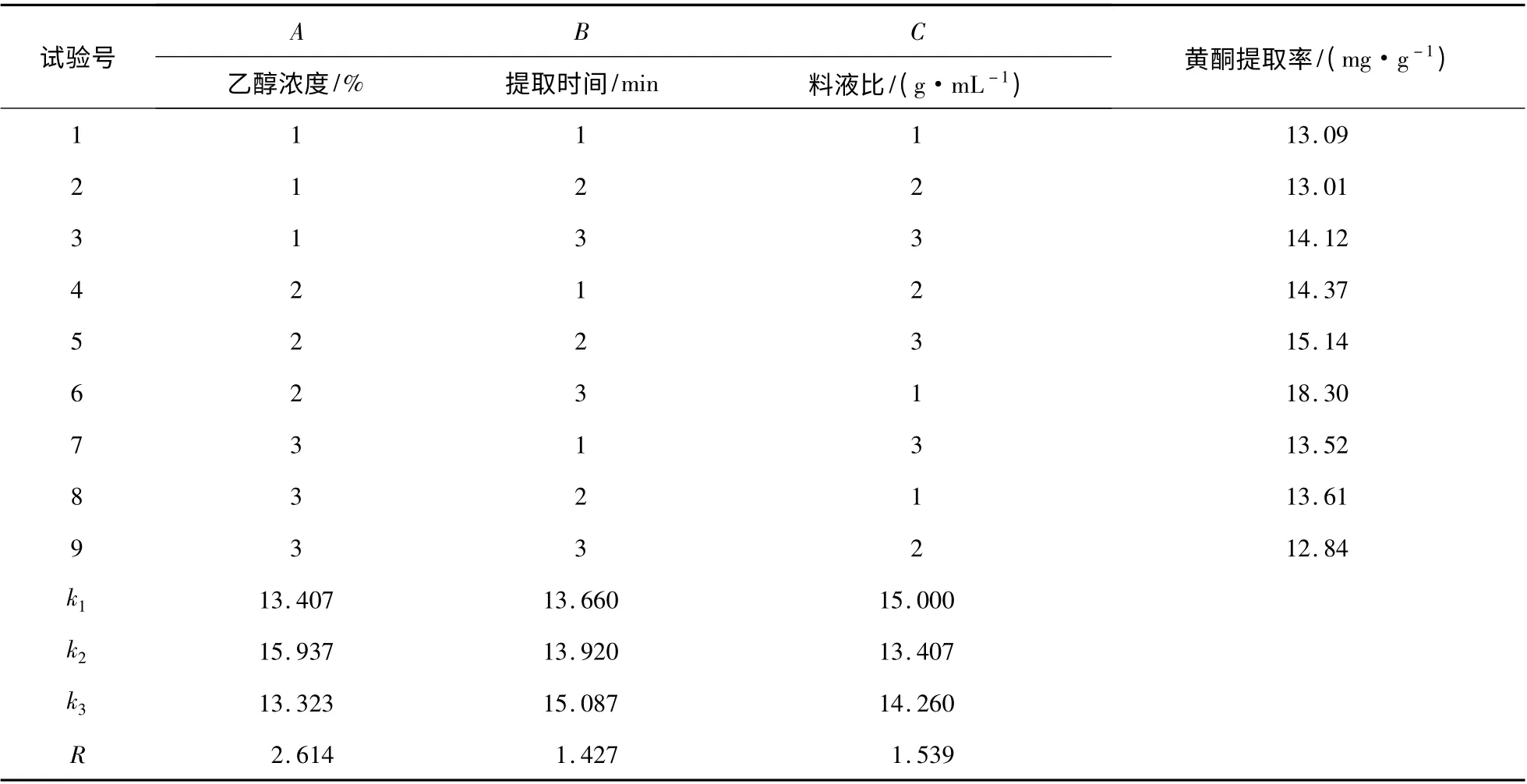
表3 陕北红枣正交实验结果Table 3 The orthogonal experiment results of Shanbei red dates
2.3 红枣黄酮提取液抗氧化性的研究
2.3.1 对超氧阴离子的清除率 按照1.2.4.1 节的方法测定两种不同浓度的黄酮提取液对超氧阴离子的清除能力,实验结果见图2。
由图2 可知,新疆和陕北红枣黄酮提取液对超氧阴离子自由基有较强的清除能力,并且随着新疆红枣黄酮提取液浓度的增加清除率在不断增加。在浓度低于0.13 mg/mL 时陕北红枣黄酮提取液的清除能力大于新疆红枣黄酮提取液,当浓度>0.13 mg/mL 时 新疆红枣黄酮提取液显示出较强的清除能力。
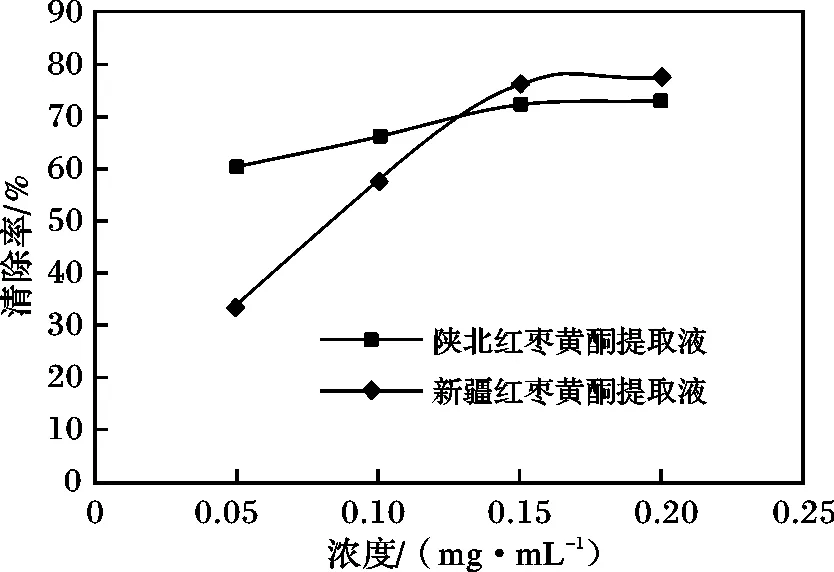
图2 红枣黄酮提取液对超氧阴离子自由基的清除率Fig.2 Red dates flavonoids extract on superoxide anion radical scavenging rate
2.3.2 对羟基自由基的清除率 按照1.2.4.2 节的方法测定两种不同浓度的黄酮提取液对羟基自由基的清除能力,实验结果见图3。
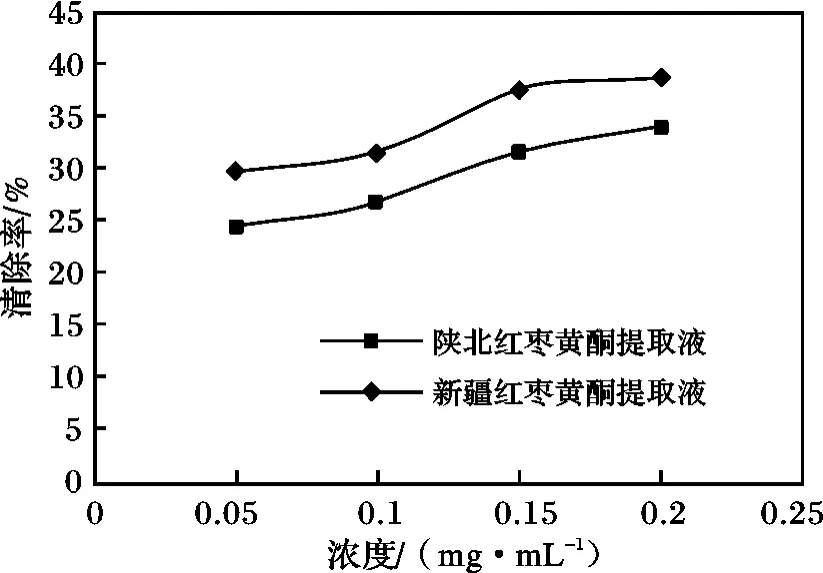
图3 红枣黄酮提取液对羟基自由基的清除率Fig.3 Red dates flavonoids extract on hydroxyl radical scavenging rate
由图3 可知,新疆、陕北红枣黄酮提取液对羟基自由基都有清除作用,随着黄酮提取液浓度的增加清除率也在不断增加。并且新疆红枣黄酮提取液清除羟基自由基的能力强于陕北红枣黄酮提取液。
3 结论
(1)新疆红枣的最佳提取工艺为:乙醇浓度为50%,提取时间为50 min,料液比为1 ∶30 g/mL,在此条件下黄酮的提取率可达8.91 mg/g。陕北红枣黄酮最佳提取工艺为:乙醇浓度为60%,提取时间为50 min,料液比1 ∶20 g/mL,在此条件下黄酮的提取率可达18.56 mg/g。
(2)新疆、陕北两种红枣的黄酮提取液对过氧阴离子和羟基自由基都具有比较强的清除能力,并且随着提取液浓度的增加清除率也在不断增加。相同浓度的新疆和陕北红枣黄酮提取液,在浓度低于0.13 mg/mL 时,陕北红枣黄酮提取液对O-2 ·的清除能力大于新疆红枣黄酮提取液,当浓度>0.13 mg/mL 时新疆红枣黄酮提取液显示出较强的清除能力。相同浓度的新疆红枣黄酮提取液对·OH 的清除能力略大于陕北红枣黄酮提取液。
[1] 杨保求,张春兰,陈娟,等.酶法提取红枣核中总黄酮的研究[J].食品工业,2013,34(6):8-10.
[2] 刘荣飞,刘晓宇.红枣多糖和黄酮类化合物的研究[J].农产品加工学刊,2010,214(7):73-75.
[3] 张春兰,张锐利,张建花,等.枣核中黄酮类化合物的提取工艺[J].食品研究与开发,2011,32(9):33-35.
[4] 焦士蓉,郑贵菊.柚皮黄酮类物质的微波辅助提取及其抗氧化活性研究[J].食品与机械,2007,23(1):73-75.

