壳寡糖对异育银鲫抗环境应激能力的影响
陈勇
(南京晓庄学院应用生态研究所,江苏 南京 211171)
随着集约化养殖程度的提高和养殖环境的恶化,水产动物面临着越来越多的应激因素,如饲养密度过大、水质污染、气候突变、药物刺激、长途运输、饲料营养不当等。轻度应激会对水产动物正常生长发育产生影响,严重的可导致其机体免疫力下降,诱发疾病甚至死亡[1],因此,减少或消除养殖水产品的应激,是养殖者不可忽视的重要问题。有研究表明,除了实行科学饲养管理外,还可以根据具体情况在饲料中添加一些抗应激添加剂,以消除或减少应激反应[2–3]。壳寡糖作为免疫增强剂能提高水产动物免疫功能[4–6]。笔者研究壳寡糖对异育银鲫抗应激能力的影响,旨在为壳寡糖作为抗应激添加剂应用于水产动物提供参考数据。
1 材料与方法
1.1 材 料
异育银鲫(Carassius auratus gibelio)由南京市水产研究所提供,初始体重为(1.5±0.2) g,初始体长为(4.5±0.1) cm。嗜水气单胞菌(Aeromonas hydrophila)菌种由江苏省淡水水产研究所提供。壳寡糖由上海海洋大学食品学院提供。碱性磷酸酶(AKP)试剂盒、超氧化物歧化酶(SOD)试剂盒、葡萄糖(GLU) 及组织蛋白测定试剂盒均为南京建成生物工程研究所产品。试验饲料原料购自南京水产研究所养殖实验场。间氨基苯甲酸乙酯甲磺酸盐(MS–222)为北京格林恒兴生物科技有限公司产品。
1.2 方 法
1.2.1 饲料制备
试验用基础饲料配方为:鱼粉5.00%、豆饼35.00%、菜饼5.00%、棉籽饼5.00%、次粉35.00%、麦麸5.00%、皮糠5.00%、磷酸氢钙1.50%,沸石粉2.00%、盐0.50%、预混料1.00%。4 种试验饲料为在基础饲料中分别添加质量分数为 0.25%、0.50%、0.75%、1.00%壳寡糖(相应减少次粉质量分数)的饲料。将各种原料分别粉碎后过孔径450 μm分析筛,按配比精确称量,采用逐级放大法使微量原料充分混匀,加适量水,用小型绞肉机加工成颗粒饲料(不同阶段粒度不同),60 ℃恒温干燥后,置–20 ℃冰箱中保存、备用。
1.2.2 试验设计及饲养方法
试验在南京晓庄学院生态学省级重点建设学科水产动物生理生态研究室内的15 个水族箱(60 cm× 45 cm×38 cm)中进行。试验用异育银鲫先驯养7 d。驯养期投喂基础饲料。驯养结束后,挑选健康状况良好、大小基本相同的异育银鲫,称重后随机放入15 个水族箱中,每个水族箱中放15 尾,各箱随机排列,经检验各箱鱼的初始体重无显著差异。试验分成5 个处理组进行,1 个对照组和4 个试验组,分别称为K0和K1、K2、K3、K4组。每组3 个重复。试验期间对照组投喂基础饲料,4 个试验组分别投喂在基础饲料中添加0.25%、0.50%、0.75%、1.00%壳寡糖的试验饲料。试验用水为曝气后的自来水。试验期间水温为室内自然温度(后期经常开空调,水温保持在21~28 ℃),全天24 h 充气增氧。各处理组分别在每天清晨和傍晚投喂饲料,并做记录,投喂量为每箱鱼体重的5%,每周调整1 次。每次投喂前1 h 吸净前次粪便。每周换水1 次,每次换水1/2,连续饲养2 个月。饲养试验结束后,禁食24 h,从各处理组随机捞取30 尾试验鱼(每个重复箱10 尾),分别置入缺氧(溶氧量≤2.0 mg/L)、拥挤(2 L 烧杯含约500 mL 水)和低温(7 ℃)的环境10 min,用50 µg/L MS–222 麻醉后,用2 mL 一次性无菌注射器从尾部静脉取血,转移至1.5 mL 离心管中,于4 ℃冰箱中放置过夜后,取血清用于检测;同时取肝胰组织保存于–20℃冰箱中,待测。
1.2.3 测定方法
准确称取肝胰中组织的质量,按1 g 组织加9 mL生理盐水,制备成组织匀浆,以3 000 r/min 离心10 min,取上清,再用生理盐水按1∶9 稀释成1%组织匀浆。用碱性磷酸酶(AKP)试剂盒、超氧化物歧化酶(SOD)试剂盒及组织蛋白测定试剂盒来测定和计算各组组织匀浆样品中AKP 和SOD 活力。每克组织蛋白在37 ℃与基质作用15 min 产生1 mg 酚为1 个AKP 活力单位(U)。每毫克组织蛋白在每毫升反应液中SOD 抑制率达50%时所对应的SOD 量为1 个SOD 活力单位(U)。血清中葡萄糖(GLU)含量的测定采用葡萄糖氧化酶–过氧化物酶法进行。
1.2.4 病原感染试验
嗜水气单胞菌菌种经28 ℃活化、复壮(大试管斜面培养)后,在无菌条件下接种于多个营养琼脂试管斜面培养基中重新培养18 h 后,分别将菌落用鱼用生理盐水洗脱、混匀成菌悬液,用浊度法将菌液调至2.25×108CFU/mL,备用。将每个处理组剩余的15 尾鱼(每个重复5 尾)置入拥挤环境10 min 后进行致病菌感染试验。每尾鱼腹腔注射浓度为2.25×108CFU/mL的嗜水气单胞菌菌液0.2 mL(依预试验求得LD50后调整确定),记录5 d 内试验鱼的死亡情况。试验过程中水温保持在25~28 ℃。
1.3 数据统计方法
试验数据用 ANOVA 进行方差分析;用Duncan’s 进行多重比较。
2 结果与分析
2.1 壳寡糖对缺氧应激时异育银鲫血糖含量及肝胰中AKP、SOD 活力的影响
从表1 可以看出,处于缺氧应激时,饲料中添加0.25%~0.75%壳寡糖试验组(K1、K2、K3组)的异育银鲫的血糖含量与对照组(K0组)的相比显著下降(P<0.05),其中添加0.5%和0.75%壳寡糖试验组(K2、K3组)异育银鲫的血糖下降幅度更大,分别比K0组的降低了28.06%和24.22%,而添加1.00%壳寡糖试验组(K4组)异育银鲫的血糖含量与K0组的差异不显著(P>0.05)。

表1 缺氧应激时壳寡糖对异育银鲫的血糖含量及肝胰中AKP、SOD 活力的影响Table 1 Effect of chitosan oligosaccharide on glucose in blood and AKP,SOD in liver of the fish in low oxygen
从表1 还可以看出,与K0组相比,饲料中添加0.25%~1%的壳寡糖均能显著提高缺氧应激时异育银鲫肝胰中的AKP活力(P<0.05),添加0.5%~1%的壳寡糖均能显著提高缺氧应激时异育银鲫肝胰中SOD 的活力(P<0.05),其中添加0.5%壳寡糖试验组的异育银鲫AKP 和SOD 活力提高效果最明显,分别比对照组的提高了223.03%和114.90%,而饲料中添加0.25%的壳寡糖对缺氧应激时异育银鲫肝胰中SOD 活力的影响不显著(P>0.05)。
2.2 壳寡糖对拥挤应激时异育银鲫的血糖含量及肝胰中AKP、SOD 活力的影响
从表2 可以看出,饲料中添加0.25%~0.75%的壳寡糖均能显著降低拥挤应激时异育银鲫的血糖含量(P<0.05),其中添加0.50%壳寡糖试验组的(K2组)异育银鲫的血糖下降程度最大,比对照组的降低了35.28%,而添加1.00%的壳寡糖对拥挤应激下异育银鲫的血糖含量无显著影响(P>0.05)。
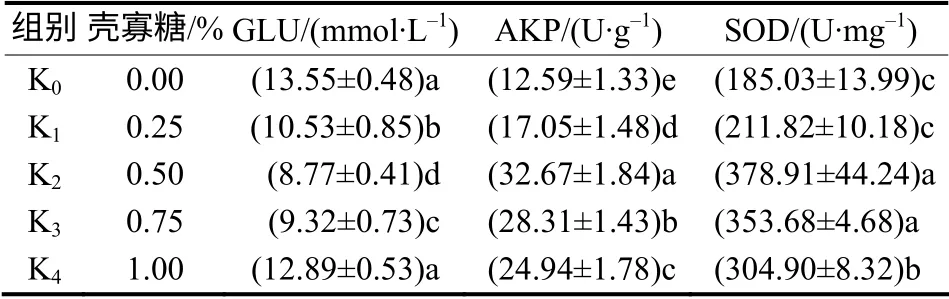
表2 拥挤应激时壳寡糖对异育银鲫的血糖含量及肝胰中AKP、SOD 活力的影响Table 2 Effect of chitosan oligosaccharide on glucose in blood and AKP,SOD in liver of the fish under crowding
饲料中添加0.25%~1%的壳寡糖均能显著提高拥挤应激时异育银鲫肝胰中AKP 活力(P<0.05),其中添加0.50%壳寡糖试验组异育银鲫的AKP 上升程度最大,比对照组的提高了159.49%;添加0.5%~1%的壳寡糖均能显著提高拥挤应激时异育银鲫肝胰中的SOD 活力(P<0.05),其中添加0.5%和0.75%的壳寡糖试验组异育银鲫的SOD 提高幅度更大,分别比对照组提高了104.78%和91.15%;但添加0.25%的壳寡糖对拥挤应激下异育银鲫AKP和SOD 活力的影响不显著(P>0.05)。
2.3 壳寡糖对低温应激时异育银鲫的血糖含量及肝胰中AKP、SOD 活力的影响
从表3 可以看出,饲料中添加0.25%~0.75%的壳寡糖均能显著降低低温应激时异育银鲫的血糖含量(P<0.05),其中添加0.50%壳寡糖试验组异育银鲫的血糖降低幅度最大,比对照组降低了42.01%;添加1.00%的壳寡糖对低温应激下异育银鲫的血糖无显著影响(P>0.05)。

表3 低温应激时壳寡糖对异育银鲫的血糖含量及肝胰中AKP、SOD 活力的影响Table 3 Effect of chitosan oligosaccharide on glucose in blood and AKP,SOD in liver of the fish in low temperature
从表3 还可以看出,饲料中添加0.50%~1.00%的壳寡糖均能显著提高低温应激下异育银鲫肝胰中AKP 的活力(P<0.05),其中添加0.50%的壳寡糖试验组异育银鲫的AKP 提高幅度最大,比对照组提高了143.96%,但添加0.25%的壳寡糖对低温应激下异育银鲫的AKP 影响不显著(P>0.05);添加0.25%~1.00%的壳寡糖均能显著提高低温应激时异育银鲫肝胰中SOD 的活力(P<0.05),其中添加0.50%的壳寡糖试验组异育银鲫肝胰中SOD 活力提高幅度最大,比对照组的提高了77.39%。
2.4 壳寡糖对异育银鲫感染致病菌后成活率的影响
从表4 可以看出,添加0.50%和0.75%的壳寡糖均能显著提高拥挤应激后的异育银鲫在感染致病菌后的成活率(P<0.05)。添加0.5%、0.75%壳寡糖的试验组(K2、K3组)的异育银鲫在感染致病菌5 d后的成活率分别比对照组(K0)提高了71.42%和57.12%。

表4 壳寡糖对异育银鲫感染致病菌后成活率的影响Table 4 Effect of chitosan oligosaccharide on survive rate of the infected fish %
3 讨 论
应激反应中能量代谢上的改变突出表现之一为血糖含量的持续升高,其幅度也与应激程度成正相关。由于应激时血糖升高的时效比血浆皮质醇更迟缓,也更容易测定,因此血糖也被广泛用作监测和量化鱼类应激反应的指标[7]。异育银鲫禁食时血糖含量为6.06 mmol/L[8]。从本试验血糖测定结果看,在缺氧、拥挤和低温应激下,对照组(K0组)异育银鲫的血糖含量均在12.60 mol/L 以上,说明在3 种环境应激中,异育银鲫产生了应激反应。而添加0.25%以上壳寡糖试验组的异育银鲫在3 种应激环境下,其血糖含量与对照组(K0组)的相比均有显著降低,说明添加适量的壳寡糖能够缓解3 种应激环境下异育银鲫的应激反应,其中,饲料中添加0.50%壳寡糖缓解异育银鲫应激反应的效果最好,但即使添加0.50%壳寡糖,异育银鲫的血糖含量还是高于6.06 mmol/L,说明异育银鲫的应激反应没有彻底消除。
AKP是一种非特异性的磷酸水解酶,在调节动物体内钙磷吸收,维持钙磷平衡方面起着重要作用,是水产动物赖以生存、生长的重要调控酶类之一。AKP的活性和鱼的免疫力有着紧密的联系[9]。SOD是机体内关键性的抗氧化酶,SOD活力的高低可以反映机体抗氧化体系活性氧清除的能力[10],也可以反应出鱼体内免疫力的强弱[11],同时经常被用作环境应激与水域污染的潜在指标[12]。从本试验结果看,与对照组相比,添加适量(本试验中为0.5%~1.0%)壳寡糖可以显著提高缺氧、拥挤和低温应激时异育银鲫肝胰中AKP、SOD的活力,说明添加适量壳寡糖对提高环境应激时异育银鲫免疫力能力是有效的。
本研究中异育银鲫经过拥挤应激后再感染致病菌,对照组异育银鲫成活率为46.67%,而饲料中添加了壳寡糖的异育银鲫的成活率比对照组的均有提高,其中添加0.5%和0.75%壳寡糖的2个试验组的异育银鲫的成活率与对照组的相比有显著提高,可见适量添加壳寡糖可以提高异育银鲫的抗病能力。
孙立威等[4]应用壳寡糖对吉富罗非鱼幼鱼的研究表明,壳寡糖能显著提高幼鱼血清中溶菌酶和超氧化物歧化酶活性及抗嗜水气单胞菌感染的能力,其适宜添加量为饲料质量分数的0.30% ~ 0.50%。蔡雪峰等[13]研究表明,在饲料中添加质量分数0.2%~ 0.6%的壳寡糖可使虹鳟抗嗜水气单胞菌感染的能力显著提高。本研究结果表明,壳寡糖用于提高异育银鲫抗应激能力的适宜添加量为0.5%。
[1]韩杰.水产动物应激因素及防治措施[J].北京水产,2007(2):30–33.
[2]葛红云,王兰梅,郑银桦,等.棉子糖对花鲈生长、免疫抗应激及抵御嗜水气单胞菌攻毒的影响[J].水生生物学报,2011,35(2):283–290.
[3]朱选,曹俊明,赵红霞,等.饲料中添加虾安Ι 对南美白对虾生长性能和抗非离子氨应激的影响[J].饲料工业,2007,28(6):28–30.
[4]孙立威,文华,蒋明,等.壳寡糖对吉富罗非鱼幼鱼生长性能、非特异性免疫及血液学指标的影响[J].广东海洋大学学报,2011,31(3):43–49.
[5]徐后国,艾庆辉,麦康森,等.饲料中添加枯草芽孢杆菌和壳寡糖对大黄鱼幼鱼血清免疫指标的影响[J].中国海洋大学学报:自然科学版,2011,41(7):42–47.
[6]王红权,赵玉蓉,余建波.壳聚糖对草鱼非特异性免疫功能的影响[J].湖南农业大学学报:自然科学版,2010,36(2):215–217.
[7]刘小玲.鱼类应激反应的研究[J].水利渔业,2006,27(3):1–3.
[8]蔡春芳,陈立侨,宋学宏,等.异育银鲫口服葡萄糖后血糖、血脂和肝糖原的变化[J].水产学报,2002,26(3):237–241.
[9]孔祥会,刘占才,郭彦玲,等.汞暴露对草鱼器官组织中碱性磷酸酶活性的影响[J].中国水产科学,2007,14(2):270–275.
[10]管越强,裴素蕊,李泽健.急性硫化物胁迫对日本沼虾免疫和抗氧化系统的影响[J].水生态学杂志,2011,32(6):89–94.
[11]庄惠生,杨光.双酚A 对鲤鱼急性和亚急性毒性的研究[J].环境科学,2005,24(6):682–684.
[12]Roche H,Boge G.Fish blood parameters as a potential tool for identification of stress caused by environmental factors and chemical intoxication[J].Marine Environmental Research,1996,41(1):27–43.
[13]蔡雪峰,罗琳,战文斌,等.壳寡糖对虹鳟幼鱼肠道菌群影响的研究[J].中国海洋大学学报,2006,36(4):606–610.

