丙戊酸群体药代动力学研究进展
李新林,赵明明,姜 力,肇丽梅*
丙戊酸群体药代动力学研究进展
李新林1,赵明明1,姜 力2,肇丽梅1*
丙戊酸是广谱抗癫疒间药,临床应用广泛。该药体内代谢个体差异大,治疗窗窄,需要个体化治疗。丙戊酸体内代谢受多种因素影响,大量研究报道了丙戊酸群体药代动力学参数及其在个体化治疗中的应用。本文分别从人口学因素、遗传因素及合并用药等方面,对丙戊酸群体药代动力学研究及应用进行综述,为临床制定合理、安全的给药方案提供参考。
丙戊酸;基因多态性;合并用药;群体药代动力学
0 引言
丙戊酸(Valproic acid,VPA)是广谱抗癫疒间药物,对各型癫疒间均有治疗作用。其作用机制与γ-氨基丁酸(γ-aminobutyric acid,GABA)有关:抑制GABA代谢酶,使脑内GABA聚集,抑制病灶神经元过度放电,同时遏制异常放电的扩散。此外,还抑制Na+通道,减弱T型Ca2+电流[1]。丙戊酸体内代谢受多种因素的影响,个体差异大,且治疗窗窄,需监测血药浓度,进行个体化给药[2]。虽然血药浓度监测对丙戊酸个体化治疗有一定贡献,但患者的遗传因素及环境因素对丙戊酸的体内代谢和药物效应的影响也是导致其个体差异的重要因素。因此,近年来,国内外的研究主要集中在通过建立丙戊酸非线性混合效应模型(Nonlinear Mixed Effect Model,NONMEM),来探索影响丙戊酸药代动力学参数的因素,实现预测丙戊酸体内浓度的目标。本综述针对国内外丙戊酸群体药代动力学(Population Pharmacokinetics,PPK)的研究情况进行阐述,为临床制定更加合理、安全的用药方案提供一定参考。
1 群体药代动力学和应用意义
1977年Sheiner 等[3]提出按非线性混合效应模型法编制的NONMEM程序,用于PPK分析,首次提出了PPK这一概念。近年来,PPK得到了长足的发展,PPK是将经典的药动学的基本原理和统计学模型相结合,通过收集病人的稀疏数据建立数学模型,计算PPK参数值。从中分析药代动力学特性存在的变异性,研究药物体内的群体规律,以及PPK参数的统计分布及其影响因素[4]。与传统药代动力学相比,PPK 有着其独特的优越性,不但能从来自受试者的相对稀疏的数据获取资料,而且还能从相对密集的数据或从稀疏数据和密集数据的组合获取资料。
PPK可定量地考察患者群体中药物浓度的决定因素,即PPK参数,包括群体典型值、固定效应参数、个体间变异、个体自身变异等[5]。将PPK应用于丙戊酸血药浓度的分析,根据丙戊酸群体药动学参数结合Bayes反馈法,即可获得癫疒间患者的个体药动学参数,从而使临床更加方便、合理、有效地优化给药方案,达到提高疗效、减少不良反应的目的,并且能减轻癫疒间患者疾病负担,极大减少癫疒间患者痛苦,具有实效性。
2 丙戊酸PPK的研究现状
2.1 儿童体内丙戊酸PPK特点 丙戊酸是临床常用的癫疒间治疗用药,更是儿童多种癫疒间发作的首选药。在针对儿童的研究中,Serrano等[6]收集了255例0.1~14岁的癫疒间患儿丙戊酸稳态血药浓度数据770个,按照一室一级吸收模型用NONMEM法进行拟合,分析年龄、体重、合并卡马西平对丙戊酸清除率的影响,并建立最终模型:CL(L/h)=0.012×TBW0.715×DOSE0.306×(1.359×CBZ),该研究表明,丙戊酸的清除率随着儿童的年龄、体重的增长逐渐降低,当体重超过40 kg(平均年龄12岁)时接近成人值。Hall等[7]的研究有类似的结论:当儿童的年龄超过10岁时,丙戊酸的CL值与成人值相似。Correa等[8]回顾性收集了110例墨西哥儿童丙戊酸血清药物浓度值119个,通过NONMEM程序建立最终VPA清除率模型:CL/F (L/h)=(0.046 6+0.0036 3×TBW +0.000 282 DD)×(1+0.236PB)。研究结果显示,在儿童群体中,VPA日剂量的增加或合并肝药酶诱导剂苯巴比妥(Phenobarbital,PB)都可以使儿童体内丙戊酸清除率增加。
Sánchez-Alcaraz等[9]收集了62 例8个月~6 岁的西班牙患儿丙戊酸稳态血药浓度数据151个,通过研究癫疒间患儿CL和年龄的关系,得出CL (L/h)=47.6×年龄(月)-0.29(r=0.87),适用于8~72个月的儿童,此外,研究结果还显示,<2岁、2~4岁、4~6岁儿童的CL分别为(24.5±12.4)mL/(kg·h)、(19.9±6.1)mL/(kg·h)、(12.7±3)mL/(kg·h),随着年龄的增大,CL逐渐降低。Juárez-Olguín等[10]前瞻性分析了108 例1~16岁、体重5.2~50 kg的癫疒间儿童丙戊酸血药浓度数据,通过PKS程序建立VPA清除率最终模型:CL/F (L/h)=0.069 6 + 0.003 1(Age)+ 0.007 5(Weight),研究结果显示,VPA的表观分布容积(Vd)及清除率与年龄相关系数分别为0.903和0.816。此结果提示,儿童的年龄和丙戊酸的药代动力学参数相关,临床应根据年龄适当调整给药剂量。姜德春等[11]研究了中国癫疒间患儿丙戊酸血药浓度的群体药代动力学特征,并首次针对儿童建立了PK-PD模型,最终通过NONMEM程序建立CL最终模型:CL(L/h)=0.097 8+0.010 4×AGE(y)、CL/F(L/h)=0.1060.98·CO+ 0.015 7AGE[12],研究表明,年龄是儿童体内丙戊酸群体药代动力学参数预测的一个重要变量,且随着年龄的增加,VPA的清除率逐渐降低。
上述研究发现,丙戊酸在儿童体内的清除率较成年人高,且年龄、体重对儿童群体丙戊酸药代动力学参数影响显著,临床用药应针对儿童的年龄和体重,适当地调整剂量,制定个体化的给药方案,以达到较好的治疗效果。
2.2 老年人体内丙戊酸群体药代动力学特点 随着年龄的增长,各器官均有不同程度的衰退,药物在老年人体内代谢具有特殊性。Fattore等[13]回顾性地收集了平均年龄为(70±4.4) 岁的71 例老年癫疒间患者的血药浓度监测数据,并建立VPA清除率模型:CL/F (L/h)=11.7-0.04×age-4.0×comedication+0.3×dose,研究结果表明,丙戊酸在老年人体内的清除率与剂量、年龄、合并用药有关,老年人VPA的清除率低,但是在与酶诱导剂合并用药时,其清除率增加20%左右。Birnbaum等[14]通过建立NONMEM模型,对丙戊酸在146例老年人体内清除率的影响因素进行了研究,结果发现,年龄和体重对老年人体内VPA的清除率无影响;合并卡马西平(Carbamazepine,CBZ)或苯妥英(Phenytoin,PHT)可使VPA的清除率增加41%,服用丙戊酸糖浆制剂可使VPA的清除率增加25%,提示临床采用丙戊酸进行抗癫疒间治疗时,当合并酶诱导药物时,应适当地调整剂量,避免丙戊酸血药浓度过低,导致癫疒间发作。
2.3 遗传因素对丙戊酸群体药代动力学的影响 丙戊酸在体内主要由细胞色素P450酶(Cytochrome P450,CYP450)和鸟苷二磷酸葡萄糖醛酸转移酶(UDP-glucuronosyltransferase,UGT)介导代谢[15]。药物代谢酶的遗传多态性是药动学产生个体化差异的重要因素。目前,CYP450酶基因多态性对丙戊酸体内代谢影响的研究较多。Ho等[16]的一项研究表明,CYP2C9与丙戊酸代谢有关,且不同的基因型代谢丙戊酸的能力不同。野生型CYP2C9*1代谢丙戊酸的能力明显强于突变型CYP2C9*2和CYP2C9*3。王玉琴等[17]研究显示,CYP2C19也参与丙戊酸代谢,携带CYP2C19突变基因的患者体内丙戊酸浓度显著高于携带CYP2C19*1基因的患者,说明野生型CYP2C19*1基因型代谢丙戊酸的能力较CYP2C19*2/*3基因型高。在基因多态性对丙戊酸群体参数的评估研究中,姜德春等[18]收集了287例基因型为CYP2C19*2/*3和CYP2C9*3的癫疒间患者的丙戊酸血药浓度数据,并且首次使用NONMEM软件建立了丙戊酸清除率与基因型的最终模型:CL/F (L/h)=0.095 1×(1+e0.026 7×(3-genotype))+0.007 1×age,结果得出基础模型和最终模型的平均预测误差、均方预测误差、根均方预测误差分别是-6.89 μg/mL和-6.24 μg/mL、665.79 (μg/mL)2和588.28 (μg/mL)2、19.65 μg/mL和18.91 μg/mL。这表明CYP2C9和CYP2C19的基因多态性作为协变量纳入最终模型,可以增加丙戊酸药代动力学参数预测的准确度和精密度。王化明等[19]回顾性收集了111例癫疒间患者的丙戊酸的稳态血药浓度数据及CYP2A6基因型等资料,通过NONMEM程序建立丙戊酸群体药代动力学的最终模型:CL/F (L/h)=0.363×DDO0.525×1.29 GENECYP2A6,研究结果表明,CYP2A6基因多态性对丙戊酸的药代动力学参数的改变有影响,CYP2A6野生型(CYP2A6*1/*1)组患者较CYP2A6 突变型(CYP2A6*1/*4、CYP2A6*4/*4)组患者有更高的VPA清除率(P<0.01),前者是后者的1.29倍。
UGT基因多态性对丙戊酸体内代谢研究相对较少。马虹英等[20]在关于UGT2B7基因多态性对丙戊酸浓度影响的研究中发现,野生型纯合子A/A与突变型纯合子G/G的浓度差异有统计学意义(P=0.048),其他组间差异无统计学意义(P>0.05),表明UGT2B7-268>G基因多态性对丙戊酸血药浓度有一定影响,且突变纯合型G/G比野生纯合型A/A代谢能力强。Krishnaswamy等[21]对48例癫疒间患者UTG1A6基因多态性的研究中发现,UGTlA6有13种基因型,其中主要为UGTlA6*1、UGTIA6*2和UGTlA6*3。通过以丙戊酸为底物的研究发现,UGTlA6*2、UGTlA6*3代谢丙戊酸的能力明显高于野生型UGTlA6*1。而Munisamy等[22]的研究发现,UGT1A6 552A>C突变会导致丙戊酸体内代谢减弱,因此,UGT1A6不同基因位点突变对丙戊酸体内代谢的影响还需进一步研究。Chu等[23]对242例癫疒间患者UGT1A3、UGT1A6、UGT2B7的基因型进行了分析,并且收集了225例癫疒间患者的稳态丙戊酸血药浓度,研究发现,UGT1A3*5基因携带患者的体内丙戊酸血药浓度比野生型携带者低[(3.24±1.05) vs.(4.68±1.24) μg·kg/(mL·mg),P<0.01]。Guo等[24]分析了98例癫疒间患者丙戊酸血药浓度与UGT1A6、UGT2B7、CYP2C9基因多态性地相关性,结果发现,UGT1A6的核苷酸位点T19G、A541G和A552C的双重杂合型与丙戊酸高治疗剂量相关(P=0.01),在UGT2B7*2和CYP2C9*3基因组中未发现丙戊酸服药剂量与体内丙戊酸血药浓度存在相关性。
上述研究结果表明,携带CYP2C9、CYP2C19、CYP2A6野生基因型患者比携带突变基因型患者有更高的丙戊酸清除率,UGT1A6、UGT1A3等基因型不同也会影响丙戊酸个体代谢差异。目前,UGT基因多态性对于丙戊酸血药浓度影响的研究较少,未见将UGT基因多态性作为一种影响因素纳入群体模型的研究。
2.4 合并用药对丙戊酸群体药代动力学的影响
2.4.1 与其他抗癫疒间药合用时对丙戊酸群体药代动力学的影响 丙戊酸在癫疒间治疗时一般为长期用药,由于治疗需要,有时需联合其他抗癫疒间药使用。药物的相互作用使丙戊酸体内代谢产生显著差异,明确其他抗癫疒间药对丙戊酸体内代谢的影响,能对临床合理用药提供一定的指导。丙戊酸在与具有肝药酶诱导作用的抗癫疒间药如卡马西平、苯巴比妥、苯妥英合用时,能够降低丙戊酸的血药浓度。胡敏等[25]收集了162例癫疒间患者丙戊酸谷浓度数据196个,用NONMEM考察固定效应对丙戊酸相对清除率的影响并建立最终模型:CL (L/h)=0.004 82×WT+0.110×TAMT+0.394×CBZS +0.108×PHT+0.082 2×PB+0.058 3,研究表明,VPA清除率随着合并卡马西平剂量的增加而逐渐降低,与Desoky等[26]研究结果一致,此外,当合用苯妥英剂量大于150 mg/(d·m2)、苯巴比妥剂量大于40 mg/(d·m2)时,VPA清除率均增加。焦正等[27]前瞻性地收集了上海、北京两地350例癫疒间患者丙戊酸稳态血药浓度数据435个,数据分析采用NONMEM模型并建立最终模型:CL (L/h)=0.042 2×Dose×BSA0.269×1.41(如果合用CBZ,否则为1)×1.37(如果合用PHT,否则为1)×(0.007 35×PBS+ 0.807) (如果合用PB,否则为1)×(Dose/950)[如果Dose大于950 mg/(m2·d),否则为1]×1.21(如果BSA大于1.7 m2,否则为1)×1.24 (如果年龄小于6,否则为1),研究结果显示:合用PB时,VPA的清除率增幅与PB剂量有关,合用CBZ或PHT可使VPA清除率增加41%或37%。其他关于丙戊酸PPK的研究也有相似的文献报道:合用CBZ可使VPA的清除率增加10%~61%,PHT可使VPA的清除率增加54%,合并PB可使VPA的清除率增加10%或39.7%[6,28]。
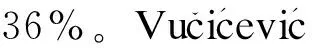
综上所述,其他对肝药酶具有抑制或诱导作用的抗癫疒间药,合并应用时,对丙戊酸群体药代动力学参数影响显著。拉莫三嗪、奥卡西平等新型抗癫疒间药对丙戊酸群体药代动力学参数影响的研究较少,还需进一步研究。
2.4.2 与口服避孕药合用时对丙戊酸群体药代动力学的影响 丙戊酸与口服避孕药(Oral Contraceptives,OCs)合用时,其药代动力学参数也会受到影响,可能会导致癫疒间的发作。研究表明,口服避孕药可以诱导UGT的表达[31],且丙戊酸在体内代谢过程的50%是通过UGT介导的,因此,丙戊酸在合并OCs时,患者体内丙戊酸清除率会增加。Herzog等[32]的研究发现,合并OCs组的丙戊酸血药浓度比单用丙戊酸组血药浓度低23.4%。Galimberti等[33]研究结果显示,合并OCs应用时,丙戊酸的总清除率增加21.5%,丙戊酸游离浓度清除率增加45.2%。
以上研究结果可以看出,合用OCs可显著影响癫疒间的治疗情况,使癫疒间患者体内丙戊酸的清除率增加,同时增加癫疒间发作的风险。因此,在服用丙戊酸治疗癫疒间期间同时服用OCs时,临床应进行血药浓度监测,并且适量增加丙戊酸的用药剂量。
2.5 性别和种族对丙戊酸群体药代动力学的影响 男性与女性在生理上存在一定的差异,这种差异影响丙戊酸用药后体内的药效学和药动学,尤以对后者的影响更为显著。Birnbaum等[14]通过NONMEM研究老年人体内VPA清除率的影响因素发现,老年男性体内丙戊酸清除率比女性高27%。Ibarra等[34]也有类似研究结果:男性体内丙戊酸清除率为0.900 L/h,女性体内丙戊酸清除率为0.581 L/h,男性体内丙戊酸清除率较女性高。因此,临床应用丙戊酸时,应适当的增加男性患者丙戊酸的给药剂量。对于不同种族,遗传多态性、生理和病理、生活饮食习惯等因素可能会导致丙戊酸体内清除率的改变。在对丙戊酸群体药代动力学的研究中,不同国家人群的丙戊酸清除率不同。Park等[35]收集了102例癫疒间患者丙戊酸血药浓度数据354例来探究丙戊酸群体药代动力学参数的影响因素,结果显示,韩国人的VPA清除率典型值为0.864 L/h,高于日本人(0.653 L/h)和塞尔维亚人(0.377 L/h)的VPA清除率[28,36],也高于中国人的VPA清除率群体典型值(0.223 L/h)[29]。
3 小结
抗癫疒间药物治疗的理想状态是在控制发作和药物的不良反应之间取得平衡,从而使患者的生活质量得到真正的改善。丙戊酸在体内代谢受多种因素的影响,体内代谢个体差异大,临床应用丙戊酸时,应该充分考虑患者的年龄、性别、合并用药等因素,适当调整用药剂量并进行血药浓度监测。目前,基因组学对丙戊酸群体药代动力学参数的影响还待进一步研究。通过基因组学来估算群体参数,进而实行个体化给药,是值得关注的热点问题。
[1] 杨宝峰.药理学[M].北京:人民卫生出版社,2008:137.
[2] 邓颖,刘莹珍,宋彧,等.癫疒间患者丙戊酸钠血药浓度监测结果分析及个体化用药方案[J].中国基层医药,2010,17(24):3348-3350.
[3] Sheiner LB,Rosenberg B,Marathe W.Estimation of population characteristics of pharmacokinetic parameters from routine clinical data[J].J Pharmacokinet Biopharm,1977,5(5):445-479.
[4] FDA.Guidance for industry population pharmacokinetics.http://www.fda.gov/cder/guidance/index.htm.
[5] Boeckmann AJ,Sheiner LB,Beal SL.N0NMEM Users Guide[M].Part V:102-103.
[6] Serrano BB,García Sánchez MJ,Otero MJ,et al.Valproate population pharmacokineticcs in children[J].J Clin Pharm Ther,1999,24(1):73-80.
[7] Hall K,Otten N,Irvine-Meek J,et al.First-dose and steady-state pharmacokinetics of valproic acid in children with seizures[J].Clin Pharmacokinetics,1983,8(5):447-455.
[8] Correa T,Rodríguez I,Romano S.Population pharmacokinetics of valproate in Mexican children with epilepsy[J].Biopharm Drug Dispos,2008,29(9):511-520.
[9] Sánchez-Alcaraz A,Quintana MB,López E,et al.Valproic acid clearance in children with epilepsy[J].J Clin Pharm Ther,1998,23(1):31-34.
[10]Juárez-Olguín H,Lugo-Goytia G,Flores-Murrieta F,et al.Effect of treatment and additional disease on pharmacokinetic of valproic acid in children with epilepsy[J].Rev Invest Clin,2010,62(6):516-523.
[11]姜德春,王丽,卢炜.用NONMEM法建立中国癫疒间儿童丙戊酸钠的群体药动学药效学结合模型[J].中国临床药理学与治疗学,2005,10(11):1279-1285.
[12]Jiang DC,Wang L,Wang YQ,et al.Population pharmacokinetics of valproate in Chinese children with epilepsy[J].Acta Pharmacol Sin,2007,28(10):1677-1684.
[13]Fattore C,Messina S,Battino D,et al.The influence of old age and enzyme inducing comedication on the pharmacokinetics of valproic acid at steady-state:a case-matched evaluation based on therapeutic drug monitoring data[J].Epilepsy Res,2006,70(2-3):153-160.
[14]Birnbaum AK,Ahn JE,Brundage RC,et al.Population pharmacokinetics of valproic acid concentrations in elderly nursing home residents[J].Ther Drug Monit,2007,29(5):571-575.
[15]Chen LC,Chou MH,Lin MF,et a1.Lack of pharmacokinetic interaction between valproic acid and a traditional Chinese medicine,paeoniae radix,in healthy volunteers[J].J Clin Pharm Ther,2000,25(6):453-459.
[16]Ho PC,Abbott FS,Zanger UM,et al.Influence of CYP2C9 genotypes on the formation of a hepatotoxie metabelite of valproie acid in human liver microsomes[J].Pharmacogenomics J,2003,3(6):335-342.
[17]王育琴,齐晓涟,黄越,等.丙戊酸药物浓度与CYP2C19基因多态性关系的研究[J].中国医院药学杂志,2003,23(11):670-673.
[18]Jiang D,Bai X,Zhang Q,et al.Effects of CYP2C19 and CYP2C9 genotypes on pharmacokinetic variability of valproic acid in Chinese epileptic patients:nonlinear mixed-effect modeling[J].Eur J Clin Pharmacol,2009,65(12):1187-1193.
[19]王化明,赖萍,谢娟.用NONMEM法建立癫疒间患者丙戊酸群体药代动力学模型[J].今日药学,2012,22(1):1-6.
[20]马虹英,张婷,龚志成,等.UGT2B7基因多态性对丙戊酸血药浓度的影响[J].中南大学学报,2013,38(8):766-772.
[21]Krishnaswamy S,Hao Q,AI-Rohaimi A,et a1.UDP glucuronocyltransferase(UGT)1A6 phannacogeneties:Ⅱ.FunctionalImpact of the three most common nonsynonymous UGTlA6 polymorphisms(S7A,T181A,and R184S)[J].J Pharmacol Exp Ther,2005,313(3):1340-1346.
[22]Munisamy M,Tripathi M,Behari M,et al.Effect of uridine diphosphate glucuronocyltransferase(UGT)1A6 genetic polymorphism on valproic acid pharmacokinetics in Indian patients with epilepsy:A pharmacogenetic approach[J].Mol Diagn Ther,2013,17(5):319-326.
[23]Chu XM,Zhang LF,Wang GJ,et al.Influence of UDP-glucuronocyltransferase polymorphisms on valproic acid pharmacokinetics in Chinese epilepsy patients[J].Eur J Clin Pharmacol,2012,68(10):1395-1401.
[24]Guo Y,Hu C,He X,et al.Effects of UGT1A6,UGT2B7,and CYP2C9 genotypes on plasma concentrations of valproic acid in chinese children with epilepsy[J].Drug Metab Pharmacokinet,2012,27(5):536-542.
[25]胡敏,张静华,孙鹤,等.丙戊酸群体药动学模型的建立与临床应用[J].中国医院用药评价与分析,2001,1(2):95-97.
[26]EL Desoky ES,Fuseau E,EL Din Amry S,et al.Pharmacokinetic modelling of valproic acid from routine clinical data in Egyptian epileptic patients[J].Eur J Clin Pharmacol,2004,59(11):783-790.
[27]焦正,钟明康,胡敏,等.丙戊酸清除率的群体药动学模型的建立[J].中国医院药学杂志,2004,24(9):515-517.
[28]Blanco-Serrano B,Otero MJ,Santos-Buelga D,et al.Population estimation of valproic acid clearance in adult patients using routine clinical pharmacokinetic data[J].Biopharm Drug Dispos,1999,20(5):233-240.
[29]郁莉斐,丁俊杰,石珩,等.中国癫疒间患儿丙戊酸群体药动学模型的建立[J].中国循证儿科杂志,2009,4(6):509-513.
[31]Soars MG,Petulo DM,Eckstein JA,et al.An assessment of UDP-glucuronocyltransferase induction using primary human hepatocytes[J].Drug Metab Dispos,2004,32(1):140-148.
[32]Herzog AG,Blum AS,Farina EL,et al.Valproate and lamotrigine level variation with menstrual cycle phase and oral contraceptive use[J].Neurology,2009,72(10):911-914.
[33]Galimberti CA,Mazzucchelli I,Arbasino C,et al.Increased apparent oral clearance of valproic acid during Intake of combined contraceptive steroids in women with epilepsy[J].Epilepsia,2006,47(9):1569-1572.
[34]Ibarra M,Vázquez M,Fagiolino P,et al.Sex related differences on valproic acid pharmacokinetics after oral single dose[J].J Pharmacokinet Pharmacodyn,2013,40(4):479-486.
[35]Park HM,Kang SS,Lee YB,et al.Population pharmacokinetics of intravenou valproic acid in Korean patients[J].J Clin Pharm Ther,2002,27(6):419-425.
Progress in population pharmacokinetic of valproic acid
LI Xin-lin1,ZHAO Ming-ming1,JIANG Li2,ZHAO Li-mei1*
(1.Department of Pharmacy,Shengjing Hospital of China Medical University,Shenyang 110004,China;2.Department of Urological Surgery,The 202th Hospital of PLA,Shenyang 110003,China)
Valproic acid (VPA) is a broad-spectrum anti-epileptic drugs,widely used in clinical therapy.The individual treatment is useful for VPA because of the significant inter-individual differences in metabolism and its narrow therapeutic index.VPA metabolism is affected by many factors,studies have reported a population pharmacokinetics parameters of VPA in individual treatment and their clinical application.This paper reviews the population pharmacokinetics of VPA and its application from demographic factors,genetic factors and concomitant medications,for the clinical development of rational and safe dosing regimen for reference.
Valproic acid;Genetic polymorphism;Combined medication;Population pharmacokinetic
2013-10-16
1.中国医科大学附属盛京医院药学部,沈阳 110004;2.中国人民解放军第二0二医院泌尿科,沈阳 110003
辽宁省自然科学基金项目(2013021078)
*通信作者

