抗丙型肝炎病毒新药波普瑞韦和替拉瑞韦
许 寅,姚晓英,董 平
(复旦大学附属上海市公共卫生临床中心药剂科,上海 201508)
丙型肝炎病毒(hepatitis C virus, HCV)感染已成为威胁全球1.7亿人口健康的严峻问题。目前,HCV感染的标准治疗方案是注射聚乙二醇干扰素α(peginterferon alpha,PEG-IFNα)联合口服利巴韦林(ribavirin)片,基因1型HCV感染者疗程是48周,基因2型和3型HCV感染者为24周[1],治疗24周后检测HCV RNA,并计算持久病毒学应答(sustained virological response,SVR)率以评价治疗效果。2011年欧洲肝病学会指南明确指出,HCV感染的治疗终点是获得SVR,SVR达到99%以上就等同于治愈。通过标准治疗方案后,基因2型和3型的HCV感染病人的 SVR达到80%,而基因1型HCV感染病人的SVR只有约50%[2]。为了缩短疗程、减少不良反应和提高对基因1型HCV感染病人的SVR,全球制药业都在寻找更有效的治疗药物。2011年5月,针对基因1型HCV的直接抗病毒药物(direct acting antiviral agents,DAA)取得突破性进展,其中波普瑞韦(boceprevir, BOC)和替拉瑞韦(telaprevir, TVR)在美国和欧洲相继获得批准上市。
BOC和TVR均为口服的丙型肝炎病毒非结构蛋白3/4A丝氨酸蛋白酶(HCV-NS3/4A serine protease,HCV-NS3/4A SP)抑制剂,两者直接作用于病毒酶功能区,即病毒蛋白酶。通过与NS3/4A SP结合,起到抑制病毒复制的作用[3,4]。
1 药动学[3,4]
健康志愿者分别口服BOC 800 mg和 TVR 750 mg后, AUC分别为5408和11 102 ng·h·ml-1,cmax为1723和1741 ng/ml,tmax为2和5 h,t1/2为3.4和 4 h,血浆清除率为161和101 L/h,V/F为772和523 L,血浆蛋白结合率为75%和76%。两药的主要排泄途径均为粪便,口服治疗量BOC和TVR后,分别有79%和81.6%代谢产物经粪便排出体外,9%和1%的代谢产物经尿排出体外。
2 临床试验[4,5]
临床试验证实,对于基因1型的慢性丙型病毒性肝炎(chronic hepatitis C,CHC)病人,应用BOC或TVR联合PEG-IFNα和利巴韦林的三联疗法比标准治疗方案的效果更佳。三联疗法不仅对难治的初治病人有显著的SVR,而且对PEG-IFNα+利巴韦林标准疗法停药后复发或部分无应答的病人,都能获得较高的SVR。BOC和TVR的用法各有异同,BOC临床试验中,先皮下注射PEG-IFNα和口服利巴韦林4周为诱导,然后再与BOC联合用药;而TVR临床试验中起始即联合治疗。在联合用药的疗程方面,BOC联合治疗24~44周,而TVR联合治疗12周,之后给予PEG-IFNα和利巴韦林治疗12~36周。
2.1 初治病人的疗效[6,7]标准治疗方案加用BOC或者TVR均能显著提高初治病人的SVR。
BOC的Ⅲ期临床试验共入组1097名基因1型CHC的初治受试者,分成3组,对照组、病毒学应答指导(RGT)组和BOC/PR组。所有受试者先用PR(PEG-IFNα-2b 1.5 μg/kg,每周一次+利巴韦林600~1400 mg/d)治疗4周作为诱导, 然后对照组给予PR和安慰剂44周, 共48周。 RGT组受试者在PR诱导4周后,均接受24周的BOC(800 mg/次,tid)+ PR 治疗,根据第8~24周血浆HCV RNA检测结果决定第28周还是第48周结束试验(详见2.3项)。BOC/PR组受试者在用PR诱导4周后用PR+BOC治疗44周(剂量同上),共48周。上述3组初治病人中,第24周血浆HCV RNA呈阳性,均立即终止所有治疗,作为治疗失败者。
TVR的Ⅲ期临床试验入组了1088名基因1型CHC的初治受试者,分为3组,对照组、T12PR组和T8PR组。T12PR组和T8PR组的受试者分别接受12周和8周的TVR(750 mg/d,q8 h,与食物同服)+PR [PEG-IFNα-2b 1.5 μg/kg,每周一次;利巴韦林1000 mg/d(体重<75 kg)或1200 mg/d(体重≥75 kg)]治疗,然后根据HCV RNA检测结果给予12~40周的PR,详见2.3项。
BOC或TVR联合PEG-IFNα和利巴韦林治疗初治基因1型CHC病人的疗效见表1[6]。
2.2 复治病人的疗效[8-10]复治病人包括既往标准疗法停药复发、部分应答或无应答的病人。BOC的Ⅲ期临床试验共入组403名基因1型CHC的复治受试者,分成3组,对照组、BOC/RGT组和BOC/PR组。对照组受试者用PR诱导4周后,继续PR治疗44周,共48周;BOC/RGT组,用PR诱导4周后,均接受32周的BOC+PR治疗,根据第8~12周血浆HCV RNA检测结果决定是否还要PR治疗(详见2.3项)。BOC/PR组,用PR诱导4周后,用BOC+PR治疗44周,共48周。上述3组复治受试者,到第12周血浆HCV RNA仍呈阳性的受试者,均立即终止所有治疗,作为治疗失败者。
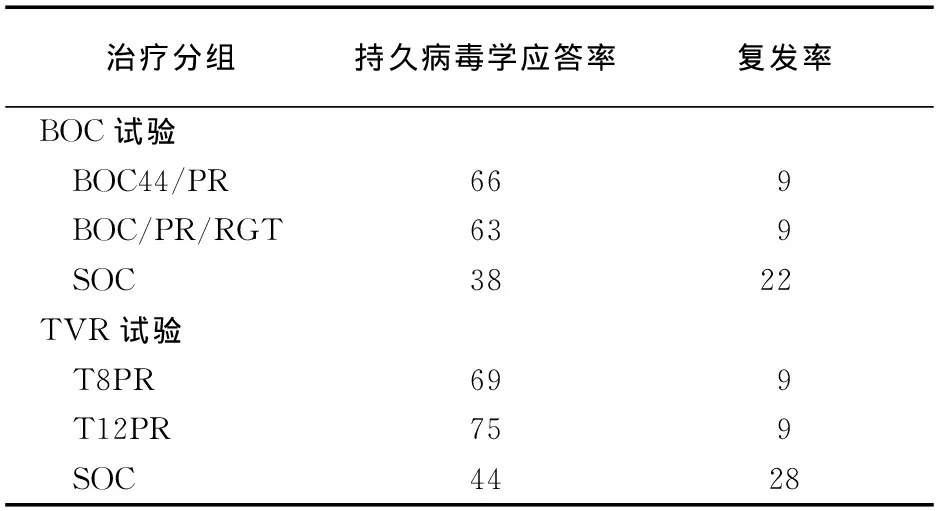
表1 波普瑞韦或替拉瑞韦联合PEG-IFNα和利巴韦林对初治基因1型CHC病人的疗效和复发率
TVR对基因1型CHC的复治受试者的临床试验,分成3组,对照组、T12/PR48组和LI-T12/PR48组。对照组受试者接受48周PR治疗。T12/PR48组受试者接受TVR+PR治疗12周,然后PR治疗36周,共48周。LI-T12/PR48组受试者先接受4周PR治疗,然后TVR+PR治疗12周,最后PR治疗32周,共48周。
临床试验表明,BOC治疗组和TVR治疗组对复治病人的SVR均高于对照(标准治疗)组。BOC临床试验中见,BOC/PR 48和BOC/RGT治疗组总体SVR为59%和66% ;对照组(PR48)为21%。TVR临床试验中见,T12/PR48和LI-T12/PR48治疗组总体SVR为64%和66% ;对照组(PR48)为 17%。其中,TVR对复治病人做了亚组比较,分为既往标准治疗复发组、部分应答组和无应答组,分别与对照组比较SVR,各亚组的SVR也均高于对照组。BOC对标准治疗复发组及部分应答组的SVR也高于对照组。BOC、TVR治疗基因1型的CHC复治病人的疗效见表2[6]。
2.3 病毒学应答指导的治疗(virological response guided therapy,RGT)[11,12]使用病毒学应答指导的治疗方案能缩短疗程,缓解治疗过程中带来的药物不良反应(ADRs),还能减轻病人的经济负担。

表2 波普瑞韦或替拉瑞韦联合PEG-IFNα和利巴韦林对复治的基因1型CHC病人的疗效和复发率
当采用BOC的联合疗法时,初治受试者在PR导入治疗4周后,均接受24周的BOC+PR治疗,在总疗程的第8~24周病毒学检测若为阴性(HCV RNA<25 IU/ml)的受试者,第28周结束试验;若总疗程第8周为阳性(HCV RNA>25 IU/ml),到总疗程的第24周转阴的受试者,第28周停用BOC后,再用20周的PR,共48周。对复治受试者,在PR导入治疗4周后,均接受32周的BOC+PR治疗,在总疗程第8~12周时病毒学检测为阴性的受试者,第36周结束试验;若总疗程第8周为阳性,到总疗程的第24周转阴者,第36周停用BOC后,再用12周的PR,共48周。RGT组受试者的最短疗程,初治者可缩短至28周(三联疗法用24周),复治者可缩短疗程至36周(三联疗法用32周)。
TVR的RGT治疗见于初治受试者。T8PR组受试者先给予8周的TVR+PR治疗,其中达到eRVR者(即第4~12周HCV RNA检测阴性者),再接受16周的PR治疗,共24周;而未达到eRVR者,则需要再接受40周的PR治疗,共48周。T12PR组先给予12周的TVR+PR治疗,其中达到eRVR者,再接受12周的PR治疗,共24周;而未达到eRVR者,则需要再接受36周的PR治疗,共48周。故对于初治受试者,RGT治疗的疗程最短可缩短至24周。复治病人的病毒应答治疗方案未查到。
3 安全性与药物相互作用
BOC三联疗法的ADRs排前5位的是疲劳、贫血、恶心、头痛和味觉障碍。用BOC而引起的味觉障碍主要是口中有金属味、泥土味或苦杏仁味,但都是短暂的和可逆的[3]。TVR常见的ADRs有贫血、皮疹、白细胞减少。此外,TVR还可引起痔疮、肛门或直肠刺激和疼痛[13]。
BOC和TVR都是通过抑制HCV-NS3/4A SP,从而抑制病毒的复制;BOC/TVR还可抑制CYP3A4,与其他经此酶代谢的药物合用,可增加这类药物的血药浓度。此外,BOC和TVR还是P-糖蛋白的抑制剂,与P-糖蛋白的底物合用时,同样也可增加此类药物的血药浓度[3]。
总之,BOC和TVR代表了HCV感染治疗领域的一类新药,它们联合PEG-IFNα和利巴韦林治疗基因1型CHC病人,能提高SVR,且对既往标准治疗方案治疗后复发病人、部分应答病人以及无应答病人均有较好的疗效。此外,采用RGT,通过个体化给药,能够在保证疗效的前提下缩短疗程,减轻病人经济负担,同时提高病人战胜病患的信心。
【参考文献】
[1] Marcellin P,Forns X,Goeser T,etal. Telaprevir is effective given every 8 or 12 hours with ribavirin and peginterferon alfa-2a or -2b to patients with chronic hepatitis C[J]. Gastroenterology, 2011,140(2):459-468.
[2] Aghemo A,Colombo M. Telaprevir for hepatitis C re-treatment: an open door on a long and winding road[J]. Gastroenterology,2010,139(4):1412-1416.
[3] FDA.VICTRELIS (boceprevir) capsules[EB/OL].(2011-05) [2013-03-04].http:// www.accessdata.fda.gov/drugsatfda_docs/label/2011/202258lbl.pdf.
[4] Seo S K,Zheng J H. Clinical pharmacology and biopharmaceutics review(s),application number:201917 Origls000[EB/OL].(2010-11-22) [2013-03-04].http:// www.accessdata.fda.gov/drugsatfda_docs/nda/2011/201917Orig1s 000ClinPharmR.pdf.
[5] Birnkrant D. Direct-acting antivirals: a new era for the treatment of chronic hepatitis C[EB/OL].(2011-04-27) [2013-03-04].http:// www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/AntiviralDrugsAdvisoryCommittee/UCM254076.pdf.
[6] Ghany M G, Nelson D R, Strader D B,etal. An update on treatment of genotype 1 chronic hepatitis C virus infection:2011 practice guideline by the American Association for the Study of Liver Diseases[J]. Hepatology,2011,54(4):1433-1444.
[7] Esteban R,Buti M. Triple therapy with boceprevir or telaprevir for treatment of naive HCV patients[J]. Best Pract Res Clin Gastroenterol,2012,26(4):445-453.
[8] Hezode C, Fontaine H, Dorival C,etal. Effectiveness of telaprevir or boceprevir in treatment-experienced patients with HCV genotype 1 infection and cirrhosis[J].Gastroenterology,2014,147(1):132-142.
[9] Macartney M J,Irish D,Bridge S H,etal. Telaprevir or boceprevir based therapy for chronic hepatitis C infection:development of resistance-associated variants in treatment failure[J]. Antiviral Res,2014,105:112-117.
[10] Asselah T. Triple therapy with boceprevir or telaprevir for prior HCV non-responders[J]. Best Pract Res Clin Gastroenterol,2012,26 (4):455-462.
[11] Pawlotsky J M. The Results of phase Ⅲ clinical trials with telaprevir and boceprevir presented at the liver meeting 2010:a new standard of care for hepatitis C virus genotype 1 infection,but with issues still pending[J].Gastroenterology,2011,140(3):746-754.
[12] Division of Antiviral Products(DAVP). Background material for Boceprevir Advisory Committee[EB/OL].(2011-04-27) [2013-03-04].http:// www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/ Drugs/ Antiviral DrugsAdvisoryCommittee/UCM252341.pdf.
[13] Yancey C L. Risk assessment and risk mitigation review(s),application number:201917 Origls000[EB/OL].(2011-04-25) [2013-03-04].http://www.accessdata.fda.gov/drugsatfda_docs/nda/2011/201917Orig1s000RiskR.pdf.

