对大丽轮枝菌具有拮抗作用的萎缩芽胞杆菌的分离和鉴定
孙崇思,陈晓敏,束长龙,齐放军,高继国,张 杰*
(1.东北农业大学生命科学院,哈尔滨 150030;2.中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
研究报告
对大丽轮枝菌具有拮抗作用的萎缩芽胞杆菌的分离和鉴定
孙崇思1, 2,陈晓敏2,束长龙2,齐放军2,高继国1*,张 杰2*
(1.东北农业大学生命科学院,哈尔滨 150030;2.中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
旨在从新疆棉花主产区的土壤中分离对重要植物病原菌大丽轮枝菌的拮抗菌,鉴定其种类,并探讨其应用前景。采用平板对峙培养法对抗性菌株、发酵滤液进行初步筛选,并对其发酵滤液热稳定性进行测试,采用16S rDNA和gyrB基因序列分析的方法确定该菌的分类地位。共分离出61株对大丽轮枝菌拮抗菌,其中59号菌株拮抗活性强,产色素,其发酵滤液经100 ℃加热5 min后,仍然具有抑菌活性,抑菌圈直径为15.8 mm,盆栽试验结果表明该菌对大丽轮枝菌具有良好的拮抗作用,并能促进棉苗生长。经过16S rDNA和gyrB基因相结合构建的系统发育树分析,结果显示59号等9株菌株为萎缩芽胞杆菌(Bacillusatrophaeus)。这是萎缩芽胞杆菌对大丽轮枝菌有拮抗作用的首次报道。
大丽轮枝菌; 萎缩芽胞杆菌; 16S rDNA;gyrB基因; 鉴定
大丽轮枝菌(VerticilliumdahliaeKleb.)属丝胞目(Hyphomycetales)淡色孢科(Moniliaceae)轮枝孢菌属(Verticillium),广泛存在于土壤中,是广宿主的植物病原菌,能够侵染400多种植物,特别是侵染棉花,引起棉花黄萎病的发生,严重影响棉花生产。我国从1973年第一次普查棉花枯、黄萎病,发病棉田为36.7万 hm2,到1993年,发病棉田发展到267万 hm2[1],发病棉田呈现逐年增加的趋势。长期以来,黄萎病已发展成为制约我国棉花生产的主要障碍和顽症[2]。国内外防控棉花黄萎病发生的主要技术措施有:培育抗耐病的棉花品种、种子处理、土壤处理、轮作倒茬等[3-6]。然而,由于大丽轮枝菌产生的微菌核在土壤中存活时间长、寄主广泛、传播途径多,这些技术实际防效有限,难以满足生产的需求。对于土传病害而言,着眼于土壤生态改良的“以菌治菌”的生物防治措施逐渐引起了人们的重视,有望发展成为防控土传性病害的重要手段[7]。
近年来,对大丽轮枝菌具有拮抗作用的细菌陆续被发现,如芽胞杆菌(BacillusCohn)、荧光假单胞菌[Pseudomonasfluorescens(Trev.) Migula]、嗜麦芽寡养单胞菌[Stenotrophomonasmaltophilia(Hugh) PalleronietBradbury]、肠杆菌属(EscherichiaCastellani)[8-10]等;其中具有拮抗作用的芽胞杆菌主要包括枯草芽胞杆菌[Bacillussubtilis(Ehrenberg) Cohn]、解淀粉芽胞杆菌(B.amyloliquefaciensPriest)、蜡样芽胞杆菌(B.cereusFranklandetFrankland)、多黏芽胞杆菌(B.polymyxaMacé)、漠海威芽胞杆菌(B.mojavensisRoberts)等[11-15]。萎缩芽胞杆菌(B.atrophaeusNakamura)属芽胞杆菌,1989年Nakamura等曾对产生色素的40株枯草芽胞杆菌进行研究,发现其DNA相关性和多位点酶电泳分析(multilocus enzyme electrophoresis analyses)与其他枯草芽胞杆菌存在明显差异,因此将这类产色素的芽胞杆菌从枯草芽胞杆菌中分离出来,命名为萎缩芽胞杆菌[16]。现已发现萎缩芽胞杆菌对尖孢镰刀菌(FusariumoxysporumSchlechtendahl)、核盘菌[Sclerotiniasclerotiorum(Lib.) de Bary]等植物病原菌具有拮抗作用[17-18],但迄今未见萎缩芽胞杆菌拮抗大丽轮枝菌的报道。
随着分子生物学的迅速发展,对于微生物的鉴定不再仅仅依赖于微生物形态和生理生化特性的分析,以16S rDNA[19]和gyrB基因序列为靶分子进行细菌分类和系统进化研究得以迅速发展。16S rDNA序列分析存在着基因进化速率慢、序列保守、无法有效区分亲缘关系很近的物种等局限性,gyrB基因序列分析方法恰能很好地弥补。gyrB即促旋酶(gyrase)的B亚单位基因,Yamamoto建立了一种基于gyrB基因直接测序的快速鉴别微生物近缘种的方法[20]。Dauga等发现,16S rDNA基因序列适用于描述亲缘关系较远的细菌之间的关系,而gyrB序列更适用于属内或属间关系的比较分析[21]。因此选用16S rDNA与gyrB基因测序结合的方法,将能更加准确地鉴定细菌的种类,明确其分类地位。
本文报道从北疆棉花主产区常年发病棉田的棉株根系土壤中,分离出对大丽轮枝菌具有拮抗作用的芽胞杆菌,经16S rDNA及gyrB基因序列比对,同时构建系统发育树,鉴定出部分拮抗菌为萎缩芽胞杆菌,丰富了选择对大丽轮枝菌具有良好拮抗作用的芽胞杆菌新的种类。
1 材料与方法
1.1 材料
病原菌:大丽轮枝菌(VerticilliumdahliaeKleb.)V991。中国农业科学院植物保护研究所经济作物病害组保存。
土壤样品:从新疆农七师129团棉田棉株根围采集。采集点黄萎病常年发生,中度偏重。
棉花种子品种:棉花感黄萎病品种‘新陆早7号’。
培养基:拮抗细菌的分离采用PDAY培养基(200 g 马铃薯煮20 min取滤液,20 g葡萄糖,5 g酵母提取物,15 g琼脂粉,配成1 L的培养基,121 ℃灭菌20 min。),拮抗细菌的培养采用LB固体培养基和LB液体培养基,病原菌培养及对峙试验采用马铃薯葡萄糖琼脂(PDA)培养基[22]。
生化和分子生物学试剂购自北京冰达生物科技有限公司;引物由上海生工生物技术有限公司北京部合成,测序由中国农业科学院测序部完成。
1.2 芽胞杆菌的分离
刮取大丽轮枝菌V991的孢子,打散后用灭菌的脱脂棉过滤去除菌丝,制成孢子悬液。取5 g抗病棉花植株的根际土壤,加入无菌玻璃珠和无菌水50 mL,充分振荡,80 ℃水浴20 min。取土壤悬液与大丽轮枝菌的孢子悬液混合,涂于PDA平板上,25 ℃培养3 d后挑取产生抑菌圈的细菌,在LB平板上进行画线纯化培养。
1.3 大丽轮枝菌拮抗细菌的筛选
采用传统的对峙培养法进行初筛,挑取单菌落在LB液体培养基中,30 ℃培养过夜。在PDA平板上培养V99110 d后打圆形菌饼倒置于90 mm PDA平板中央,在平板对称等距的4个位置放置无菌圆形滤纸片,滴加5 μL菌液,置于25 ℃暗培养至V991长满平板。观察并记录测量抑菌圈直径[22]。
初筛得到的菌株接种于LB液体培养基中,220 r/min、30 ℃恒温振荡培养44 h。4 ℃、12 000 r/min离心5 min,收集上清液,经0.22 μm微孔滤膜过滤后4 ℃保存备用。在PDA平板中央接种V991菌饼,在距培养皿边缘等距处放置灭菌牛津杯,每杯中加入100 μL初筛菌株的发酵滤液,3次重复,25 ℃暗培养10 d后测量抑菌圈直径。
1.4 拮抗菌胞外代谢产物的热稳定性检测
取0.5 mL发酵滤液,经过100 ℃煮沸5 min处理,进行对峙试验。在PDA平板中央接种V991菌饼,在距培养皿边缘等距处放置灭菌牛津杯,每杯中加入100 μL加热处理过的发酵滤液,3次重复,25 ℃暗培养10 d后测量处理菌落直径。
1.5 盆栽试验
活化59号菌株过夜,按照1%的比例转接于LB液体培养基中,30 ℃培养48 h。5 000 r/min,离心5 min收集菌体,菌体用同体积的无菌水悬浮均匀,制成浓度为1010cfu/mL的菌悬液。将1 L菌悬液与24盆量的土壤拌匀,为拌土处理,分别在拌土处理和未处理的24盆土壤中播种经过表面消毒的棉花种子。待棉苗显露两片真叶,并且第一片真叶展开时,进行黄萎病菌(大丽轮枝菌)的接种处理[23]。处理如下:拌土处理的24盆全部接种大丽轮枝菌,4盆为一组,6个重复;未处理的12盆接种大丽轮枝菌,4盆为一组,3个重复;未处理的12盆不接种作为空白对照,4盆为一组,3个重复。接种后在25 ℃,16 h光照,22 ℃,8 h黑暗条件培养,15 d后观察黄萎病发病进程,按以下标准记录黄萎病的发病级别:0=健株,无任何病症;1=1片以下或部分子叶变黄或坏死;2=2片子叶变黄或坏死;3=出现1片真叶变黄或坏死的现象;4=2片真叶变黄或坏死,或完全脱落。
发病指数=[(∑发病级别×发病植株数)/
(4×总植株数)] ×100。
1.6 拮抗细菌黑色素形成量的测定
挑取抑菌效果最好的单菌落,PDA液体培养基中30 ℃活化过夜,按1%的接种量转接于50 mL PDA液体培养基中,220 r/min、30 ℃振荡培养;同时以不产生色素的苏云金芽胞杆菌HD73作为对照。在培养12、24、36、48、60、72 h各取1.0 mL菌液,12 000 r/min离心10 min,取上清液在400 nm波长下测其吸光值[24],3个重复。
1.7 拮抗菌株的鉴定
提取拮抗菌株基因组DNA,方法参照《分子克隆实验指南》[25]。
PCR扩增:以细菌16S rDNA通用引物27F(5′-AGAGTTTGATCATGGCTCAG-3′)和1492R(5′-TACGGYTACCTTGTTACGACTT-3′)[26]对基因组DNA进行扩增。16S rDNA PCR扩增反应体系(50 μL):2×TaqMix 25 μL、引物各1 μL、模板DNA 1 μL、 超纯水22 μL。PCR反应条件:95 ℃预变性3 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1.5 min,30个循环;最后72 ℃延伸10 min。以细菌gyrB基因扩增引物UP-1(5′-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3′)和UP-2r(5′-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3′)[20]对基因组DNA进行扩增。gyrB基因PCR扩增反应体系(50 μL):2×TaqMix 25 μL、引物各1 μL、模板DNA 1 μL、超纯水22 μL。PCR反应条件:95 ℃预变性4 min;94 ℃变性1 min,62 ℃退火1 min,72 ℃延伸2 min,30个循环;最后72 ℃延伸10 min。产物经1%琼脂糖凝胶电泳检测,纯化后送交测序。
序列比对分析:采用BLAST软件,将测序获得的序列与GenBank中的核酸序列进行比对分析;采用MAGE 5.1软件构建系统发育树。
2 结果分析
2.1 芽胞杆菌的分离
从供试土壤悬液和大丽轮枝菌孢子悬液涂布的PDA平板上观察到有抑菌圈产生,挑取有抑菌活性的芽胞杆菌在LB固体平板上画线得到单菌落,再挑取单菌落在LB平板画线培养得到纯化菌株,于4 ℃保存。共得到94株拮抗芽胞杆菌,编号为1~94。
2.2 对大丽轮枝菌产生拮抗作用的芽胞杆菌筛选
使用菌液进行平板对峙培养初筛,61株菌菌液对大丽轮枝菌具有拮抗作用,占所分离菌株的64.9%。利用61株菌株的发酵滤液与大丽轮枝菌V991进行对峙试验,结果筛选出19株发酵滤液具有抑菌活性的菌株,其中59号菌株的菌液抑菌效果最好,产生的抑菌圈直径为30.2 mm,发酵滤液产生的抑菌圈直径为20.7 mm。如图1中所示,59号菌株的菌液和发酵滤液在与大丽轮枝菌对峙试验中均产生抑菌圈,对大丽轮枝菌均具有显著的抑制作用。
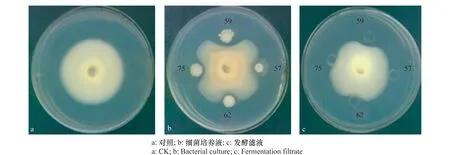
图1 部分样品抑菌试验结果Fig.1 Antagonistic assay of partial samples
2.3 抑菌物质热稳定性测定
19个具有抑菌活性的发酵滤液样品加热后,有9个样品仍然具有抑菌能力,表明其中的抑菌物质具有一定的热稳定性,菌株编号分别为15、46、54、59、61、70、75、77和89,其中59号菌样品产生的抑菌圈直径最大,为15.8 mm。进一步比较发酵滤液加热前后的抑菌活性,54、77菌株的两种处理产生的抑菌圈大小差异不显著,而15、46、59、61、70、75和89菌株的两种处理产生的抑菌圈直径差异较明显。
表1发酵滤液加热前后的抑菌活性对比结果
Table1Comparisonofantagonisticactivitywithfermentationfiltrateandheat-treatment
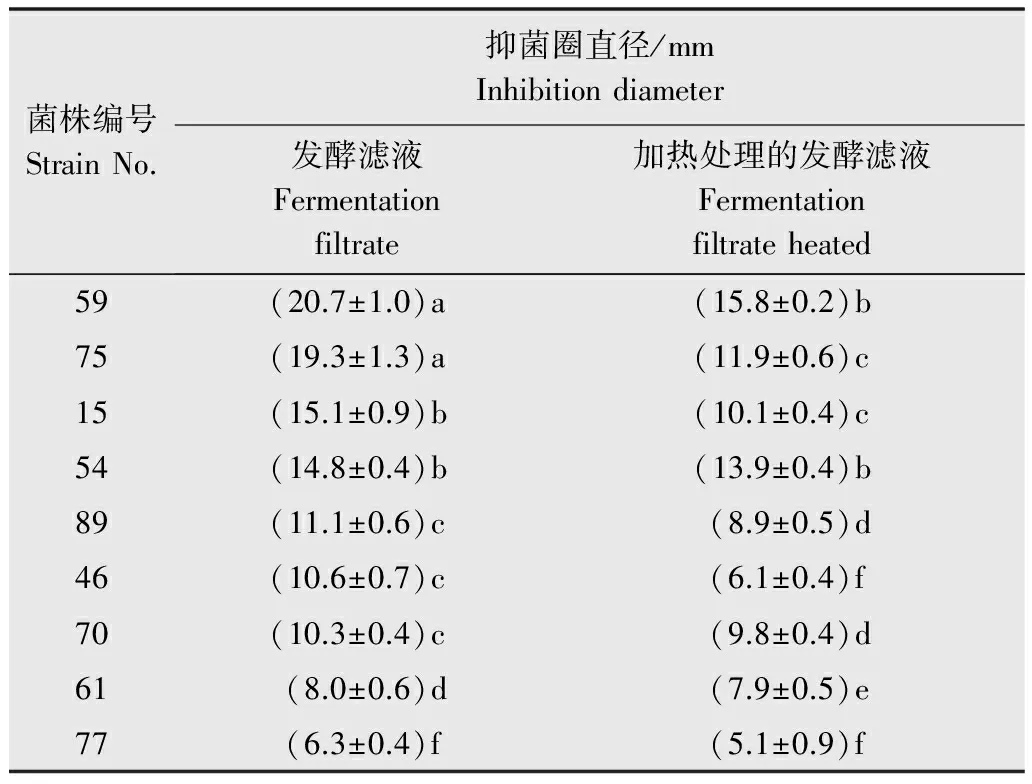
菌株编号StrainNo.抑菌圈直径/mmInhibitiondiameter发酵滤液Fermentationfiltrate加热处理的发酵滤液Fermentationfiltrateheated59(20.7±1.0)a(15.8±0.2)b75(19.3±1.3)a(11.9±0.6)c15(15.1±0.9)b(10.1±0.4)c54(14.8±0.4)b(13.9±0.4)b89(11.1±0.6)c(8.9±0.5)d46(10.6±0.7)c(6.1±0.4)f70(10.3±0.4)c(9.8±0.4)d61(8.0±0.6)d(7.9±0.5)e77(6.3±0.4)f(5.1±0.9)f
2.4 盆栽试验结果
未经过处理和经过拌59号菌处理的土壤中的棉花种子,萌发7 d后在生长状态上有明显的不同(如图2a),拌有59号菌悬液的处理组中棉苗长势优于未经处理的棉苗,说明59号菌株具有一定的促进棉苗生长的能力。在长出两片真叶,第一片真叶完全展开时进行大丽轮枝菌的接种,15 d后调查棉苗发病进程时,只长有两片子叶、两片真叶,图2b中观察到,空白对照组棉苗无染病症状;只接种大丽轮枝菌处理组的棉苗叶片有枯黄现象,并且植株矮小;经过59号菌株拌土和接种大丽轮枝菌处理组的棉苗叶片有少数枯黄,但是植株长势良好。对棉苗叶片的染病情况进行调查,结果如图2c,空白对照的病情指数为0,接种大丽轮枝菌处理组的病情指数为38.43,接种大丽轮枝菌的拌土处理组的病情指数为9.03,结果表明59号菌株在盆栽试验中对棉苗上的大丽轮枝菌具有显著的拮抗作用,对棉花黄萎病具有一定的防效。
2.5 拮抗细菌黑色素形成量的测定
59号菌株液体培养基的颜色与不产生色素的HD73菌株对比,明显偏深、变黑(如图3a),说明59号菌株产生黑色素。测量A400 nm黑色素的吸光值,黑色素产生的变化结果表明(如图3b),59号菌株在36 hA400 nm为0.89,产生黑色素达到顶峰,之后黑色素含量基本不变,明显高于不产生色素的HD73菌株的吸光值(该样品的A400 nm最大值为0.36)。

图2 盆栽试验结果Fig.2 The results of pot culture test
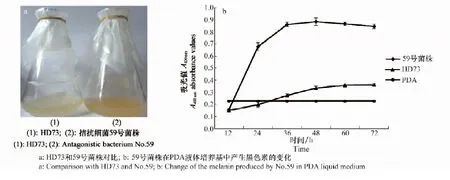
图3 在PDA液体培养基中产生黑色素的测定结果Fig.3 The assay results of melanin production in PDA liquid medium
2.6 芽胞杆菌16S rDNA序列分析鉴定
选择9株拮抗效果较好的菌株基因组DNA进行16S rDNA基因扩增,获得1 465 bp的片段。PCR产物纯化、测序后,序列比对分析结果表明(详见表2):菌株9、10、19、30、32、59、62、75、78与B.atrophaeusN15的相似性为100%,同时,除32号菌株与B.subtilisJAM A-6-10的相似性为99%以外,其余菌株与B.subtilisJAM A-6-10的相似性为100%。系统发育树构建结果表明(如图4),拮抗菌株59等9株菌与B.atrophaeusATCC 51189、B.atrophaeusLSSC3、B.subtilisATCC 49822聚在一簇,亲缘关系最近。
表2分离菌株16SrDNA和gyrB基因序列比对结果
Table2Comparisonof16SrDNAandgyrBgenesequencesfromtheisolatedstrainsandstandardstrains
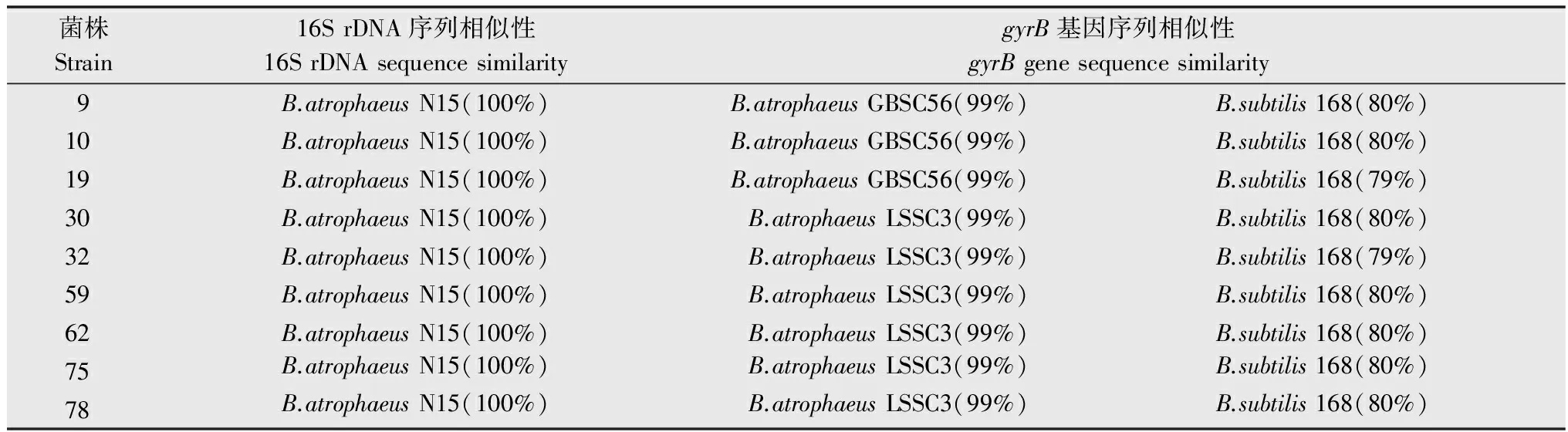
菌株Strain16SrDNA序列相似性16SrDNAsequencesimilaritygyrB基因序列相似性gyrBgenesequencesimilarity9B.atrophaeusN15(100%)B.atrophaeusGBSC56(99%)B.subtilis168(80%)10B.atrophaeusN15(100%)B.atrophaeusGBSC56(99%)B.subtilis168(80%)19B.atrophaeusN15(100%)B.atrophaeusGBSC56(99%)B.subtilis168(79%)30B.atrophaeusN15(100%)B.atrophaeusLSSC3(99%)B.subtilis168(80%)32B.atrophaeusN15(100%)B.atrophaeusLSSC3(99%)B.subtilis168(79%)59B.atrophaeusN15(100%)B.atrophaeusLSSC3(99%)B.subtilis168(80%)62B.atrophaeusN15(100%)B.atrophaeusLSSC3(99%)B.subtilis168(80%)75B.atrophaeusN15(100%)B.atrophaeusLSSC3(99%)B.subtilis168(80%)78B.atrophaeusN15(100%)B.atrophaeusLSSC3(99%)B.subtilis168(80%)
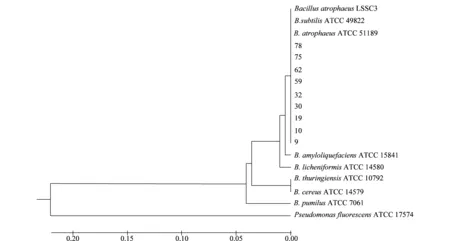
图4 基于16S rDNA序列构建的系统发育树Fig.4 Phylogenetic tree based on 16S rDNA sequences
2.7 gyrB基因序列分析鉴定
选择9株拮抗效果较好的菌株基因组DNA进行gyrB基因扩增,获得1300 bp的片段。PCR产物纯化、测序后,序列比对分析结果表明(详见表2):菌株9、10、19与B.atrophaeusGBSC56的相似性为99%,菌株30、32、59、62、75、78与B.atrophaeusLSSC3的相似性为99%;菌株9、10、30、59、62、75、78与B.subtilis168的相似性为80%,菌株19、32与B.subtilis168的相似性为79%。系统发育树构建结果表明(如图5),拮抗菌株59等9株菌与B.atrophaeusLSSC3聚在一簇,亲缘关系最近。
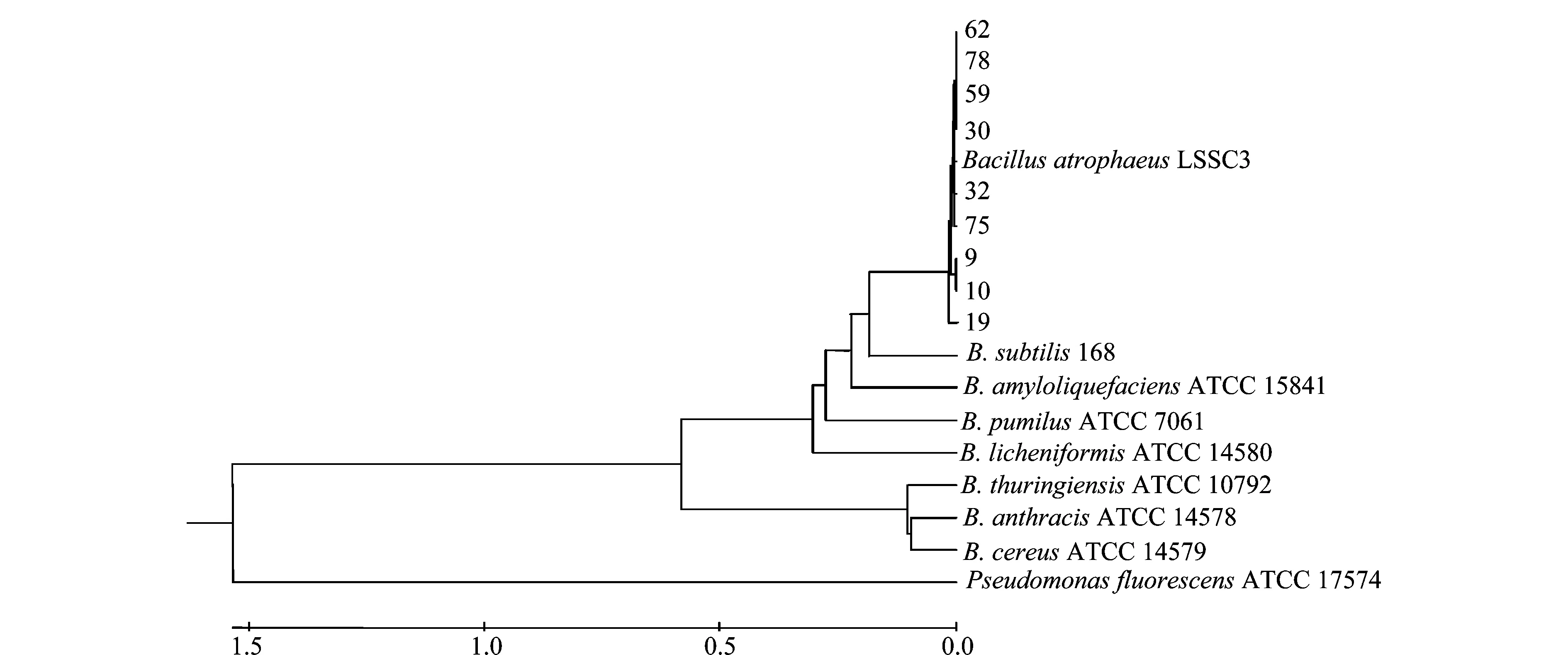
图5 基于gyrB基因序列构建的系统发育树Fig.5 Phylogenetic tree based on gyrB gene sequences
2.8 16S rDNA-gyrB基因序列构建系统发育树
将上述每一种类的标准菌株、待鉴定菌株均按照316 bp的16S rDNA与219 bp的gyrB基因序列的顺序拼接在一起得到615 bp的序列,比对结果显示(表略),菌株59等9株拮抗菌与B.atrophaeusLSSC3的相似性均为99%;菌株9、10、19与B.subtilisATCC 49822/168的相似性为93%,菌株30、32、59、62、75、78与B.subtilisATCC 49822/168的相似性为92%。9株拮抗菌与B.atrophaeus的序列相似性均高于B.subtilis。进行系统发育树的构建,结果表明(如图6),拮抗菌株59等9株菌与B.atrophaeusLSSC3聚在一簇,亲缘关系最近,说明菌株59等9株拮抗菌为B.atrophaeus,与gyrB基因序列构建系统发育树结果一致。
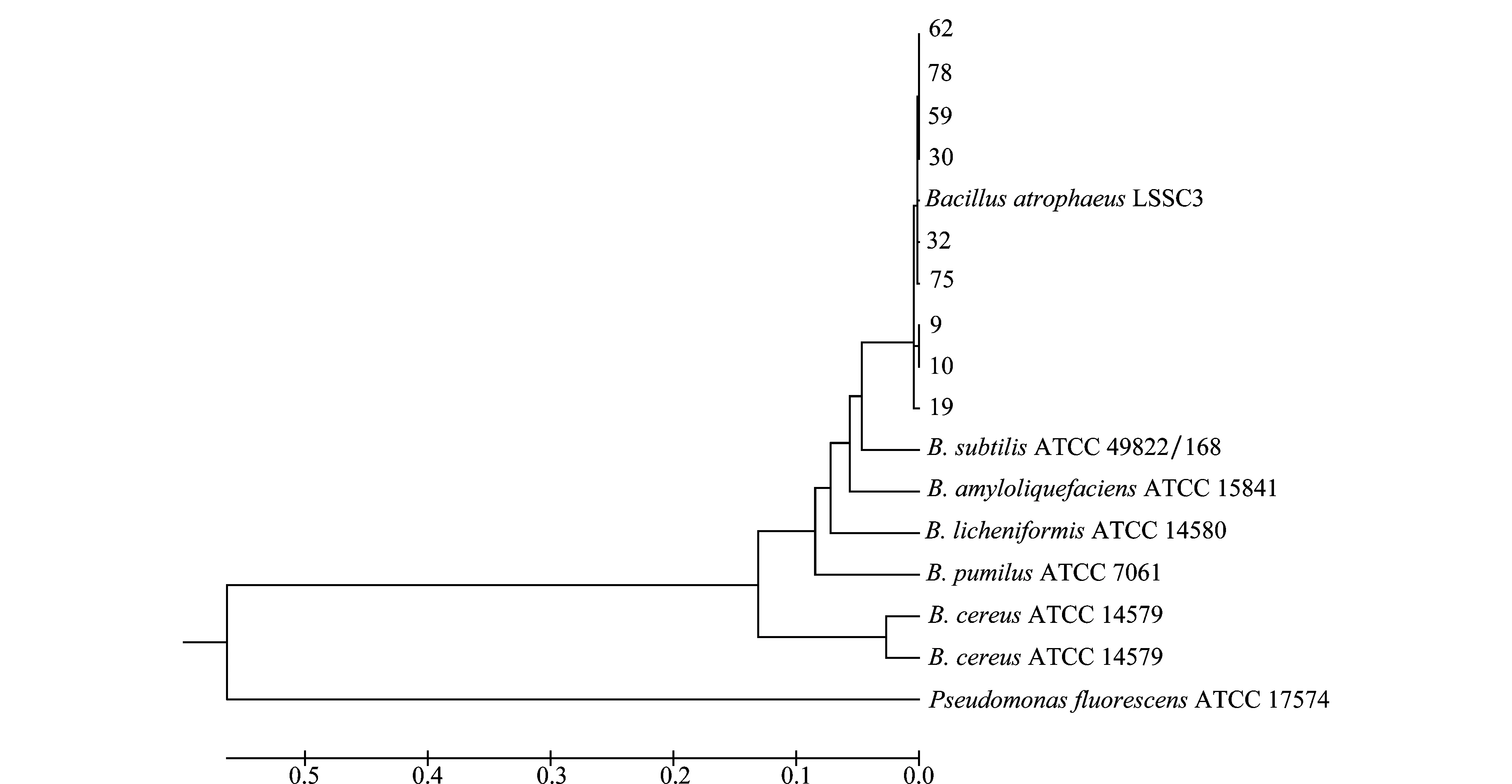
图6 基于16S rDNA-gyrB基因序列构建的系统发育树Fig.6 Phylogenetic tree based on 16S rDNA-gyrB gene sequences
3 讨论
对棉花黄萎病具有抑制作用的芽胞杆菌已报道多种[11-15],但是对大丽轮枝菌具有拮抗活性的萎缩芽胞杆菌尚未见正式报道。本研究从新疆发病棉田分离到抑菌活性显著的萎缩芽胞杆菌,分别测定了活菌和发酵滤液的抑菌活性,比较了发酵滤液中抑菌物质的热稳定性;并测定了该菌产生黑色素的能力,最后运用16S rDNA及gyrB蛋白编码基因鉴定的方法明确了该菌的分类地位,这是萎缩芽胞杆菌对大丽轮枝菌具有拮抗作用的首次报道。
我们从新疆棉区的棉花根际土壤中筛选对大丽轮枝菌具有拮抗作用的细菌,这些细菌更易于定殖在新疆地区的棉花根际土壤中,有利于发挥抑菌作用。黑色素能够吸收阳光中的部分紫外线,减少紫外线对细胞的伤害[27]。59号菌在平板和液体培养条件下均能产生黑色素,因此,该菌可能比不产生色素的芽胞杆菌具有更强的抗逆性,更适合在新疆等紫外线较强的地区存活、繁殖。而通过盆栽试验发现,59号对棉花幼苗生长有显著的促进作用,对棉花黄萎病有显著的抑制作用,说明该菌有望成为新的生防资源。分离出的拮抗细菌的发酵液经100 ℃加热5 min后,有9株样品仍然具有抑菌活性,推测其中分别含有热稳定和热敏感的不同的抑菌物质。根据报道,芽胞杆菌产生的热稳定性抑菌物质主要为脂肽类化合物[28],而热敏感抑菌物质多为几丁质酶、葡聚糖酶[17]等。在以后的工作中,我们将针对抑菌物质进行更加深入的研究。
16S rDNA及gyrB基因鉴定方法已经广泛地应用于细菌分类鉴定[19-20]。16S rDNA通常能够鉴定到属的水平,但是存在一定的局限性:由于16S rDNA具有高度保守性,且分子小、包含的信息量有限,对于亲缘关系较近的细菌,其分辨率有限,而在种的分类上仍然需要借助其他手段加以辅助分析。gyrB基因属于DNA复制、限制、修饰和修复的相关基因[29],微生物中gyrB基因的碱基变异频率远高于16S rDNA,因此gyrB基因序列鉴定的方法适用于区分和鉴定亲缘关系较近的菌株[21],利用gyrB基因序列分类鉴定的方法能够得到更准确的结果。此前已有使用16S rDNA与16S-23S ITS基因序列联合分析的方法对菌株进行鉴定[30],本文尝试了将16S rDNA和gyrB基因联合使用的方法,并明确了所分离菌株的分类地位为萎缩芽胞杆菌,这些工作为其他细菌的分类鉴定提供了借鉴。
[1] 李庆基.对防治棉黄萎病根本措施的几点看法[J].植物保护, 1994, 20(3): 40-41.
[2] Xu F, Yang L, Zhang J, et al.Prevalence of the defoliating pathotype ofVerticilliumdahliaeon cotton in central China and virulence on selected cotton cultivars[J].Journal of Phytopathology, 2012, 160(7-8): 369-376.
[3] Paplomatas E, Bassett D, Broome J, et al.Incidence of verticillium wilt and yield losses of cotton cultivars (Gossypiumhirsutum) based on soil inoculum density ofVerticilliumdahliae[J].Phytopathology, 1992, 82(12): 1417-1420.
[4] Hanson L.Reduction of verticillium wilt symptoms in cotton following seed treatment withTrichodermavirens[J].Journal of Cotton Science, 2000, 4(4): 224-231.
[5] Pullman G S, DeVay J E, Garber R H, et al.Soil solarization: Effects on verticillium wilt of cotton and soilborne populations ofVerticilliumdahliae,Pythiumspp.,Rhizoctoniasolani, andThielaviopsisbasicola[California][J].Phytopathology, 1981, 71(9): 954-959.
[6] El-Zik K M.Integrated control of verticillium wilt of cotton[J].Plant Disease, 1985, 69(12): 1025-1032.
[7] 李社增, 刘杏忠.利用拮抗细菌防治棉花黄萎病[J].华中农业大学学报, 2001, 20(5): 422-425.
[8] Erdogan O, Benlioglu K.Biological control of verticillium wilt on cotton by the use of fluorescentPseudomonasspp.under field conditions[J].Biological Control, 2010, 53(1): 39-45.
[9] Berg G, Ballin G.Bacterial antagonists toVerticilliumdahliaeKleb[J].Journal of Phytopathology, 2008, 141(1): 99-110.
[10]Li C H, Shi L, Han Q, et al.Biocontrol of verticillium wilt and colonization of cotton plants by an endophytic bacterial isolate[J].Journal of Applied Microbiology, 2012, 113(3): 641-651.
[11]李社增, 鹿秀云, 马平, 等.防治棉花黄萎病的生防细菌NCD-2的田间效果评价及其鉴定[J].植物病理学报, 2005, 35(5): 451-455.
[12]陈妍, 李红亚, 李术娜, 等.棉花黄萎病拮抗菌株DS45-2的分离鉴定[J].河南农业科学, 2010(1): 68-72.
[13]张洪涛, 于频频, 艾山江 阿布都拉, 等.棉花黄萎病高效拮抗菌XJUL-6的筛选鉴定及其特性研究[J].微生物学报, 2007, 47(6): 1084-1087.
[14]王笑颖, 孟成生, 雷白时.大丽轮枝菌拮抗细菌多粘芽胞杆菌7-4菌株的筛选与鉴定[J].湖北农业科学, 2011, 50(9): 1797-1925.
[15]李佳, 李术娜, 郭晓军, 等.一株大丽轮枝菌拮抗细菌7-47菌株的分离与鉴定[J].棉花学报, 2009, 21(2): 156-158.
[16]Nakamura L K.Taxonomic relationship of black-pigmentedBacillussubtilisstrains and a proposal forBacillusatrophaeussp.nov.[J].International Journal of Systematic Bacteriology, 1989, 39(3): 295-300.
[17]Shanmugam V, Kanoujia N.Biological management of vascular wilt of tomato caused byFusariumoxysporumsp.lycospersiciby plant growth-promoting rhizobacterial mixture[J].Biological Control, 2011, 57(2): 85-93.
[18]薛鹏琦, 刘芳, 乔俊卿, 等.油菜菌核病生防芽胞杆菌的分离鉴定及其脂肽化合物分析[J].植物保护学报, 2011, 38(2): 127-132.
[19]Woese C R, Kandler O, Wheelis M L.Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, Eucarya[J].Proceeding of the National Academy of Sciences of the United States of America, 1990, 87(12):4576-4579.
[20]Yamamoto S, Harayama S.PCR amplification and direct sequencing ofgyrBgenes with universal primers and their application to the detection and taxonomic analysis ofPseudomonasputidastrains[J].Applied and Environmental Microbiology, 1995, 61(3): 1104-1109.
[21]Dauga C.Evolution of thegyrBgene and the molecular phylogeny of Enterobacteriaceae: a model molecule for molecular systematic studies[J].International Journal of Systematic and Evolutionary Microbiology, 2002, 52(2): 531-547.
[22]沈萍, 范秀荣, 李广武.微生物学实验[M].北京:高等教育出版社, 1999.
[23]Zhang B L, Yang T W, Chen T Z, et al.Island cottonGbve1 gene encoding a receptor-like protein confers resistance to both defoliating and nondefoliating isolates ofVerticilliumdahliae[J].PLoS One, 2012, 7(12): e51091.
[24]段晓红, 毛歆, 彭珍荣.固定化细胞生产黑色素的研究[J].武汉大学学报(自然科学版), 1997, 43(2):249-253.
[25]詹姆布鲁克J, 拉塞尔D W.分子克隆实验指南(精编版)[M].第3版.黄培堂, 译.北京: 化学工业出版社, 2008.
[26]Brosius J,Palmer M L,kennedy J,et al.Complete nucleotide sequence of a 16S ribosomal RNA gene fromEscherichiacoli[J].Proceeding of the National Academy of Sciences of the United States of America, 1978, 75(10): 4801-4805.
[27]Park T J, Kim J, Kim T K, et al.Characterization of melanin-TiO2complexes using FT-IR and C-13 solid-state NMR spectroscopy[J].Bulletin of the Korean Chemical Society, 2008, 29(12): 2459-2464.
[28]Benitez L B, Velho R V, Lisboa M P, et al.Isolation and characterization of antifungal peptides produced byBacillusamyloliquefaciensLBM5006[J].Journal of Microbiology, 2010, 48(6): 791-797.
[29]Yamamoto S, Bouvet P J M, Harayama S.Phylogenetic structures of the genusAcinetobacterbased ongyrBsequences: comparison with the grouping by DNA-DNA hybridization[J].International Journal of Systematic Bacteriology, 1999, 49(1): 87-95.
IsolationandidentificationofBacillusatrophaeusantagonisticagainstVerticilliumdahliae
Sun Chongsi1, 2,Chen Xiaomin2,Shu Changlong2,Qi Fangjun2,Gao Jiguo1,Zhang Jie2
(1.CollegeofLifeSciences,NortheastAgriculturalUniversity,Harbin150030,China;2.StateKeyLaboratoryforBiologyofPlantDiseasesandInsectPests,InstituteofPlantProtection,ChineseAcademyofAgriculturalSciences,Beijing100193,China)
The purpose of this study is to isolate the bacteria antagonistic toVerticilliumdahliae, an important plant disease, from soil samples collected in cotton fields in Xinjiang Uygur Autonomous Region, and to identify bacterial species and discuss their application prospect.Antagonistic assay on the plates was conducted for the initial screening using strain culture and fermentation filtrate, and then the stability of heat treatment for fermentation filtrate was detected.16S rDNA andgyrBgene sequence analyses were used to classify antagonistic bacteria.Sixty-one strains inhibitingV.dahliaewere obtained.Among them, No.59 strain had highly antagonistic activity toV.dahliae, and could produce pigment.Its fermentation filtrate still kept antagonistic activity after heated at 100 ℃ for 5 min, and the diameter of fungistasis circle of the heated sample was 15.8 mm.The strain was antagonistic againstV.dahliaein pot tests, and promoted growth of cotton seedlings.The results indicated that No.59 strain belonged toBacillusatrophaeusthrough phylogenetic tree analysis based on 16S rDNA combined withgyrBgene sequences.This is the first report thatB.atrophaeushad antagonistic activity againstV.dahliae.
Verticilliumdahliae;Bacillusatrophaeus; 16S rDNA;gyrBgene; identification
2013-04-25
: 2013-07-10
“十二五”国家“863”计划课题(No.2011AA10A203)
S 476
: ADOI: 10.3969/j.issn.0529-1542.2014.01.005
* 通信作者 E-mail:jzhang@ippcaas.cn; gaojiguo1961@hotmail.com

