地黄对百草枯解毒机理的研究
徐 凤,杨德亮,杨 杰,刘 秀,张 闯,吴明根
(延边大学农学院,延吉 133000)
地黄对百草枯解毒机理的研究
徐 凤,杨德亮,杨 杰,刘 秀,张 闯,吴明根*
(延边大学农学院,延吉 133000)
地黄对百草枯表现出较强的耐药性,百草枯分别处理300 g/hm2或600 g/hm2时,药害等级分别为0级和2级,且药害症状恢复较快。研究结果表明,地黄块根、叶片乙醇提取物的DPPH自由基清除率随着提取物浓度的增加而增高;叶片对DPPH自由基的清除效果好于块根,DPPH自由基清除率为50%时所需的地黄块根、叶片乙醇提取物浓度分别为20.0 g/L和12.2 g/L。可以推测,地黄对百草枯的解毒是因为体内含有抗氧化活性物质,这种物质遇到百草枯时能够解除百草枯活性氧毒性,起到地黄对百草枯的解毒作用。
地黄; 百草枯; 抗氧化
地黄(RehmanniaglutinosaLibosch.)为玄参科地黄属植物,是一种传统的中药植物资源。具有较强的抗氧化性,目前地黄规模化栽培中遇到除草难或除草剂残留问题。
百草枯(paraquat)属于高氧化活性的灭生性除草剂,在土壤中易失去活性,无残留[1]。已有研究表明适量百草枯处理对地黄的生长和产量没有显著影响,因此可作为地黄田的特用除草剂[2-3]。研究显示,地黄同科的玄参科多数植物提取物-梓醇、毛蕊花糖苷、多糖等具有清除DPPH自由基能力的抗氧化特性[4-6]。
植物对氧化性除草剂百草枯的耐性机理大体分为两种类型,一是由植物结构特异而产生对百草枯体内吸收、传导的障碍性,二是由植物体内含有的抗氧化物质而产生的对百草枯氧化性的解毒作用。但目前为止,地黄对百草枯的耐性机理尚不清楚,对此,本文通过对地黄对百草枯解毒机理的研究,为使用高效、低残留百草枯除草剂防除地黄地杂草提供参考。
1 材料与方法
1.1 材料
1.1.1 供试植物
地黄[RehmanniaglutinosaLibosch.]:河北省引种品种(代号85-5)。大豆品种:‘黑农48’。
1.1.2 供试除草剂与试剂
百草枯:由先正达南通作物保护有限公司提供。二苯基苦基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):由日本东京化成工业株式会社提供,亚硝酸钠、硝酸铝、氢氧化钠、95%乙醇、99.5%乙醚均为分析纯。
1.1.3 供试仪器
UV-1700 PharmaSpec型分光光度计,CPA 324S型电子天平,EYEL4型减压旋转蒸发仪,SI500型轨道振荡箱,多功能粉碎机等。
1.2 试验方法
1.2.1 地黄对百草枯的耐性鉴定
地黄出苗后20 d进行百草枯田间茎叶处理,剂量分别为300、600 g/hm2,喷水处理设为对照。各处理重复3次,小区面积0.01 hm2。施药后第10、20天和40天分别调查药害症状。
1.2.2 地黄提取物对百草枯的解毒性测定
将20%百草枯1 mL与不同量的地黄块根提取液(1.2.3中的地黄样品待测液)混合,加水定容100 mL,利用微型喷雾器均匀喷洒到2个复叶长出的大豆叶片上,施药后第20天分别调查药害症状。
1.2.3 地黄提取物清除DPPH自由基能力测定
DPPH贮备液的配制:称取DPPH试剂0.128 8 g,用95%乙醇溶解、定容500 mL,得到质量浓度为257.7 mg/L 的DPPH贮备液(约6.5×10-4mol/L)备用[7]。
地黄提取、待测液的配制:将鲜地黄块根(10月18日取样)和叶片(7月9日取样)在烘干箱中60 ℃烘干72 h后进行粉碎过筛(40目),称取过筛根叶各10 g,分别以蒸馏水、80%乙醇溶剂静置浸24 h,然后在30 ℃、15 000 r/min条件下的振荡器中振荡24 h,过滤,将提取液减压蒸发浓缩,定容待测。
清除DPPH自由基能力的测定: 将DPPH贮备液用95%乙醇稀释至质量浓度为51.54 mg/L使用。在试管中依次加入2.0 mL 51.54 mg/L DPPH 溶液和2.0 mL样品提取、稀释溶剂(80%乙醇),总体积为4.0 mL,摇匀后,在513 nm波长处测吸光值(A),记为A0;在试管中依次加入DPPH 溶液的溶剂(95%乙醇)和2.0 mL待测试液,总体积为4.0 mL,摇匀后,在513 nm波长处测吸光值(A),记为Ar;在试管中依次加入2.0 mL 51.54 mg/L DPPH溶液和2.0 mL待测试液,总体积为4.0 mL,摇匀后,在513 nm波长处测吸光值(A),记为As。
按式(1)计算自由基清除率(Y)。
Y=1-(As-Ar)/A0
(1)
将待测地黄提取液配制成系列溶液,测定其DPPH自由基清除率,并绘制DPPH自由基清除率的提取液浓度曲线,用方程计算出当DPPH自由基清除率为50%时所需的提取液浓度(地黄材料重量/提取液体积)。
2 结果与分析
2.1 百草枯除草剂处理对地黄、大豆的药害观察
百草枯处理后调查药害症状、等级结果(表1),高剂量百草枯茎叶处理初期出现叶边缘枯萎的药害症状,药害等级相当于2级(0~10级分类法[8]),第20天后药害症状消失,恢复正常生长。当百草枯与地黄块根提取液混合处理大豆幼苗时,地黄提取液表现解毒百草枯活性氧的抗氧化特性(表2)。因此认为,地黄植株体内含有抗氧化活性物质,这种物质遇到百草枯时能够解除百草枯活性氧毒性。
表1地黄生长期百草枯处理的药害症状及等级
Table1ThephytotoxicitysymptomsandgradeofR.glutinosaingrouingperiodbyparaquat
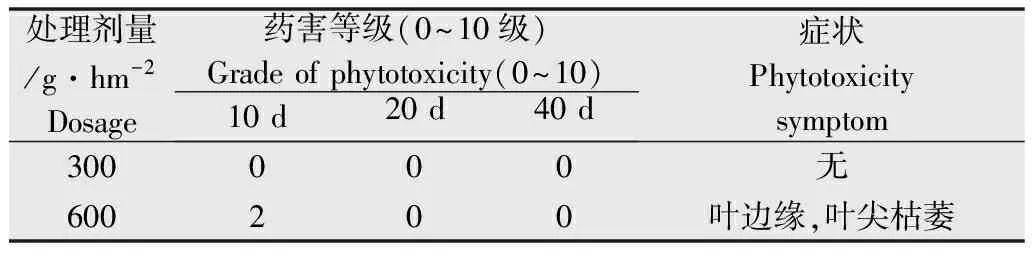
处理剂量/g·hm-2Dosage药害等级(0~10级)Gradeofphytotoxicity(0~10)10d20d40d症状Phytotoxicitysymptom300000无600200叶边缘,叶尖枯萎
表2百草枯和地黄块根提取液混合处理的大豆叶片的药害症状
Table2Thephytotoxicitysymptomsofsoybeanleavestreatedwithparaquatmixedwithrehmanniarootextracts
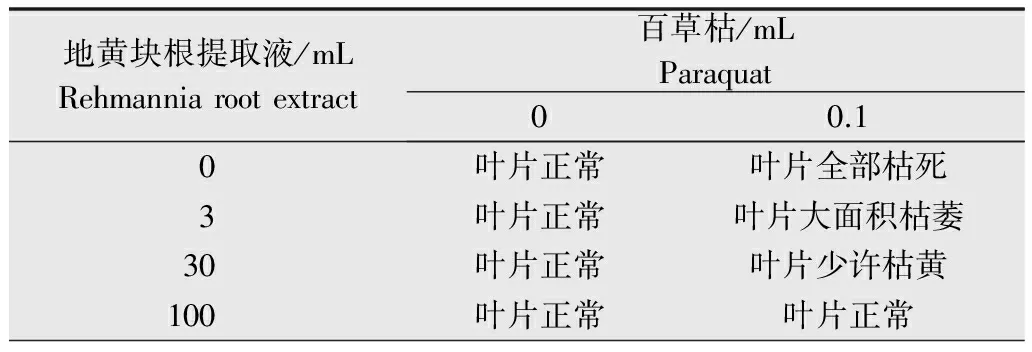
地黄块根提取液/mLRehmanniarootextract百草枯/mLParaquat00.10叶片正常叶片全部枯死3叶片正常叶片大面积枯萎30叶片正常叶片少许枯黄100叶片正常叶片正常
2.2 DPPH吸光值与浓度关系
将257.7 mg/L DPPH贮备液用95%乙醇稀释配成浓度梯度为206.16、103.08、51.54、41.23、20.62和10.31 mg/L的DPPH溶液,测吸光值(A)[9]。以吸光值(A)对DPPH浓度(C)作图,得到Y(A)与X(C)的线性关系方程(图1)。

图1 DPPH浓度和吸光度的线性关系Fig.1 Linearity correlation between DPPH concentration and absorbency
2.3 地黄块根、叶片提取液清除DPPH自由基的效果
测定结果(图2)表明,地黄块根、叶片提取物的DPPH自由基清除率都随着提取物浓度的增加而增高;利用方程式计算DPPH自由基清除率为50%时所需的提取液浓度,地黄块根、叶片提取物浓度分别为20.0 g/L和12.2 g/L,说明地黄叶片清除DPPH自由基的效果好于块根。

图2 地黄块根(a)和叶片(b)提取液浓度与DPPH清除率的线性关系Fig.2 Linearity correlation between ethanol extracts of rehmannia fresh roots and leaves and DPPH clearance rate
3 讨论与结论
除草难严重阻碍长白山区药用植物大规模栽培[10]。本试验结果表明,河北省引种的适宜延边地区栽培的地黄品种(代号85-5)对除草剂百草枯具有较强的耐药性,在推荐使用剂量(300~400 g/hm2)范围内使用时对地黄无药害症状。
通过观察DPPH溶液在280~600 nm波长区间的扫描光谱,得到两个特征吸收峰(329.5 nm)和(513 nm),加入抗氧化剂抗坏血酸两个吸收峰都降低,且513 nm处降低较显著,故选用可见光513 nm处吸收峰的变化来表示DPPH含量的变化,用以评价地黄提取物的清除DPPH自由基抗氧化能力,这与陈丛瑾[7]等和Larrauri[11]等报道的DPPH吸收峰在517 nm略有差异。DPPH稳定性试验结果吸光值A值在最初20 min内下降较快,在20~40 min内,反应体系的A值变化缓慢,45 min后A值基本保持不变。因此测定时间为DPPH与提取物反应后的50 min。测定结果,地黄块根、叶片乙醇提取物的DPPH自由基清除率都随着提取物浓度的增加而增高;叶片对DPPH自由基清除效果好于块根,DPPH自由基清除率为50%时所需的提取液浓度分别为20.0 g/L和12.2 g/L。
以上研究结果说明,地黄植株体内含有抗氧化活性物质,这种物质遇到百草枯时能够解除百草枯活性氧毒性,从而起到对百草枯的解毒作用。
[1] 武宝玕, Mitchell E D, Johnson B L,等.野生种花生叶片内超氧物歧化酶及其抗paraquat特性[J].植物生理学报,1990,16(2):147-152.
[2] 朴仁哲,赵洪颜,金玉姬.地黄田特用除草剂百草枯的初步研究[J].农药,2008,47(4):288-289,291.
[3] Chun J C, Ma S Y, S E, et al.Physiological response ofRehmanniaglutinosato paraquat and its tolerance mechanisms[J].Pesticide Biochemistry and Physiology,1997,59:51-63.
[4] Liu M J, Li J X, Guo H Z, et al.The effects of verbascoside on plasma lipid peroxidation level and erythrocyte membrane fluidity during immobilization in rabbits: a time course study[J].Life Science, 2003,73:883-892.
[5] Tsuda T, Shiga K, Ohshima K.Inhibition of lipid peroxidation and active oxygen radical scavenging effect of anthocyanin pigments isolated fromPhaseolusvulgarisL.[J].Biochemical Pharmacology,1996,52:1033-1039.
[6] 朴仁哲,赵洪颜,金玉姬,等.百草枯胁迫对地黄和苘麻膜脂过氧化及抗氧化酶活性的影响[J].江苏农业科学,2008,36(3):271-274.
[7] 陈丛瑾,黄克瀛,李德良,等.香椿叶提取物清除DPPH自由基能力的测定方法[J].林产化学与工业,2006,26(3):69-72.
[8] 魏福香.除草剂药害试验方法[J].杂草科学,1992,10(3):18-21.
[9] 郭雪峰,岳永德,汤锋,等.用清除有机自由基DPPH法评价竹叶提取物抗氧化能力[J].光谱学与光谱分析,2008,28(7):1578-1582.
[10]杨丽,刘文,刘俊华.农药残留评价及限量标准研究[J].世界标准化与质量管理,2002(10):40-41.
[11]Larrauri J A, Sanchez M C, Saura C F.Effect of temperature on the free radical scavenging capacity of extracts from red and white grape pomace peels[J].Journal of Agricultural and Food Chemistry, 1998, 46(7):2694-2697.
DetoxicationmechanismofRehmanniaglutinosatoparaquat
Xu Feng,Yang Deliang,Yang Jie,Liu Xiu,Zhang Chuang,Wu Minggen
(AgriculturalCollegeofYanbianUniversity,Yanji133000,China)
Rehmanniaglutinosashowed tolerance to paraquat.The phytotoxicity ofR.glutinosawas grade 0 and grade 2 with paraquat at 300 g/hm2or 600 g/hm2, respectively.The results showed that the DPPH free radical scavenging activity of ethanol extract fromR.glutinosaroot tubers and leaves increased with the extractive concentration adding; the DPPH scavenging effect in the leaves was better than that in the root tubers.The concentrations ofR.glutinosaroot tubers and leaves extracted with ethanol were 20.0 g/L and 12.2 g/L, respectively, when the DPPH free radical scavenging activity was 50%.In general, the detoxication ofR.glutinosato paraquat was caused by the antioxidant substance which could remove paraquat reactive oxygen toxicity.
Rehmanniaglutinosa; paraquat; antioxidant
2013-01-21
: 2013-04-07
国家自然科学基金(31160370)
S 481.4
: ADOI: 10.3969/j.issn.0529-1542.2014.01.026
* 通信作者 Tel:0433-2435566; E-mail:5minggen@163.com

