问荆(Equisetum arvense)水浸液对盆栽小麦的化感效应
焦 浩, 岳中辉*, 隋海霞, 王慧一, 郭立波, 刘宝林
(1. 哈尔滨师范大学生命科学与技术学院/黑龙江省普通高等学校植物生物学重点实验室,哈尔滨 150025;2.中储粮北方农业开发有限公司,嫩江 161400)
问荆(Equisetum arvense)水浸液对盆栽小麦的化感效应
焦 浩1, 岳中辉1*, 隋海霞1, 王慧一1, 郭立波1, 刘宝林2
(1. 哈尔滨师范大学生命科学与技术学院/黑龙江省普通高等学校植物生物学重点实验室,哈尔滨 150025;2.中储粮北方农业开发有限公司,嫩江 161400)
为了探究问荆生长对作物的化感效应,以小麦为材料,采用生物测定法研究不同浓度问荆根茎水浸液对5个小麦品种‘龙麦26’、‘垦九10’、‘龙麦33’、‘龙辐18’、‘格来尼’的株高、叶长、叶面积、干鲜重比及叶片丙二醛含量(MDA)、可溶性糖含量(WSS)、过氧化氢酶活性(CAT)、过氧化物酶活性(POD)的影响。结果表明,问荆根茎水浸液对各品种小麦根冠比及叶片WSS含量、CAT活性、POD活性具有促进作用,对小麦叶面积、叶长、干物质积累具有抑制作用,且促进和抑制作用均随问荆水浸液浓度的增加呈增强趋势。说明问荆生长对小麦有一定的化感作用。
问荆; 小麦; 化感作用
问荆(EquisetumarvenseLinn.)为蕨类植物门(Pteridophyta)木贼科(Equisetaceae)木贼属(Equisetum)多年生草本植物,繁殖力强,是我国北方农田常见的杂草[1]。在麦田中,问荆在小麦生长初期长势旺盛,这一方面是因为其占有绝对的资源优势,能够有效地利用光照等营养条件,另一方面,问荆体内富含酚酸、黄酮、生物碱、茚满酮等化感物质[2],这些物质可能会以某种方式释放到环境中,影响小麦和其他杂草的生长。当小麦生长达到一定高度时,由于其较大的密度效应,加之拔节期的快速生长,逐渐取代了问荆在竞争中的优势,导致问荆逐渐枯萎死亡,死亡后的部分残体会在微生物的作用下腐解,其体内富含的化感物质随之进入土壤,这些物质是否参与土壤与小麦间的代谢过程,从而对小麦的生长产生一定影响,是一个值得探讨的问题。已有的研究表明,麦田杂草对小麦均有一定的化感作用,如Sogaard等研究发现低密度麦仙翁(AgrostemmagithagoLinn.)对小麦的生长和产量有明显的促进作用,而高密度有抑制作用[3-5];杨超等研究指出播娘蒿[Descurainiasophia(Linn.)]浸提液对小麦种子的萌发及早期生长有明显的抑制作用[6];张军林等研究发现泽漆(EuphorbiahelioscopiaLinn.)水提液对小麦幼苗生长有明显的抑制作用,而婆婆纳(VeronicadidymaTenore)水提液对小麦幼苗生长有明显的促进作用[7];何红花等研究发现,猪殃殃(Galiumtricorne)可以通过释放化感物质抑制小麦种子发芽和早期生长,从而严重干扰小麦的正常生长,导致小麦减产和品质下降[8]。本试验利用生物测定法,研究问荆根茎水浸液对盆栽小麦形态及生理的化感效应,探讨问荆与小麦之间的化感作用机制,试图为小麦的合理生产提供一定的理论依据。
1 材料与方法
1.1 试验材料
试验选用的‘龙麦26’、‘垦九10’、‘龙麦33’、‘龙辐18’、‘格来尼’5个小麦品种由中储粮北方公司提供。‘龙麦26’为耐旱、耐湿品种;‘垦九10’为适时早播品种;‘龙麦33’为抗倒伏品种;‘龙辐18’为试验新品种;‘格来尼’为光不敏感品种。
1.2 研究方法
1.2.1 问荆水浸液的制备
2012年4月23日在中储粮北方农业公司科技园区的小麦田内采集营养器官萌动期的问荆根茎,蒸馏水冲洗后阴干剪碎,然后准确称取50 g,用蒸馏水定容至500 mL,充分振荡,于室温内浸泡48 h,浸泡期间多次搅动,双层纱布过滤后即为100 mg/mL(N4)问荆根茎水浸液,保存在4 ℃冰箱中。使用前将其稀释成3个不同浓度,即10 mg/mL(N1)、40 mg/mL(N2)、70 mg/mL(N3)。试验时的对照用蒸馏水(N0)代替问荆水浸液。
1.2.2 盆栽试验
2012年4月20日在黑龙江省北部中储粮北方农业公司科技园区的小麦田中取0~30 cm土层土壤,挑出杂物,过5 mm筛。在20 cm×30 cm的聚乙烯花盆中,先装入20 cm厚土,然后施加0.7 g混合肥(二铵、尿素、磷酸钾5∶1∶1),上面再覆上10 cm厚的土。
挑选籽粒饱满、大小均一的小麦种子,于2012年4月26日播入盆中,每个品种播5盆,共25盆,每盆播25粒。播种后每一品种分别用340 mL不同浓度(N0、N1、N2、N3、N4)问荆水浸液进行浇灌,以后每隔10 d再浇灌一次。每个处理重复5次。最后一次浇灌的时间为7月5日(抽穗期)。培养期间,当土壤含水量低于田间持水量时,适当补水。7月5日测量小麦的株高、叶长和叶面积;7月6日取部分小麦叶片,进行各项生理指标的测量;同时取小麦各部分进行干鲜重的测定。
1.2.3 各指标测定方法
小麦抽穗期株高、叶长直接用皮尺测定;单株叶面积用叶面积仪法测定;干物质重用烘干称重法测定。丙二醛(MDA)含量用硫代巴比妥酸法测定;可溶性糖(WSS)含量用蒽酮比色法测定;过氧化物酶(POD)活性用愈创木酚法测定;过氧化氢酶(CAT)活性用紫外分光光度计法测定[9-12]。
1.3 数据分析
试验数据的方差分析用SAS9.2软件进行,采用Duncan氏多重比较,分析同一品种不同处理间的差异显著性。
2 结果与分析
2.1 问荆水浸液对小麦生长形态的影响
不同浓度问荆水浸液处理后,小麦各品种株高呈先升高后降低的趋势。40 mg/mL浓度问荆水浸液处理后,品种‘垦九10’、‘龙辐18’的株高显著增加(P<0.05),其他浓度处理后,小麦各品种株高与对照相比没有显著差异。
不同浓度问荆水浸液处理后,小麦各品种叶面积呈降低趋势。但品种‘龙麦33’各浓度处理与对照相比都没达到显著水平;低浓度(10、40 mg/mL)问荆水浸液浓度处理后,品种‘垦九10’、‘龙辐18’、‘格来尼’的叶面积显著降低(P<0.05),其中品种‘龙辐18’的叶面积随浓度的增加呈显著降低趋势(P<0.05)。
不同浓度问荆水浸液处理后,小麦各品种旗叶长呈降低趋势。但品种‘龙麦33’各浓度处理与对照相比差异都不显著;品种‘龙麦26’、‘龙辐18’、‘格来尼’的旗叶长在浓度70 mg/mL处理后开始增加,与对照相比差异显著(P<0.05);而品种‘垦九10’各浓度处理与对照相比都达到差异显著水平(P<0.05),且随浓度的增加逐渐升高。

图1 问荆水浸液处理后小麦株高、叶面积、旗叶长的变化Fig.1 Variation of plant height, leaf area, leaf length of wheat under treatments with aqueous extracts of E.arvense
2.2 问荆水浸液对小麦生理的影响
不同浓度问荆水浸液处理后,小麦各品种穗干鲜重比呈降低趋势。但品种‘龙麦33’各浓度处理与对照相比都没达到显著水平;‘龙辐18’、‘格来尼’的穗干鲜重比在浓度10 mg/mL处理后开始降低,与对照相比差异显著(P<0.05),其中‘龙辐18’的穗干鲜重比随浓度的增加呈显著降低趋势;‘龙麦26’、‘垦九10’的穗干鲜重比分别在浓度70.40 mg/mL处理后开始降低,与对照相比差异显著(P<0.05)。
不同浓度问荆水浸液处理后,小麦各品种根干鲜重比呈降低趋势。但品种‘垦九10’、‘格来尼’各浓度处理与对照相比都没达到显著水平;‘龙麦26’、‘龙麦33’、‘龙辐18’根干鲜重比在浓度40 mg/mL处理后开始降低,与对照相比差异显著(P<0.05),其中品种‘龙麦26’、‘龙麦33’随浓度的增加呈逐渐降低趋势。
不同浓度问荆水浸液处理后,小麦各品种茎干鲜重比与对照相比均未达到显著水平。
不同浓度问荆水浸液处理后,小麦各品种叶干鲜重比呈降低趋势。品种‘龙辐18’的叶干鲜重比在浓度10 mg/mL处理后开始降低,与对照相比差异显著(P<0.05);当处理液浓度达到70、100 mg/mL品种‘龙麦26’、‘龙麦33’、‘格来尼’的叶干鲜重比开始降低,与对照相比达到差异显著水平(P<0.05)。
不同浓度问荆水浸液处理后,小麦各品种根冠比呈降低趋势。但品种‘格来尼’各浓度处理与对照相比都没达到显著水平;品种‘龙麦26’、‘龙辐18’的根冠比在10 mg/mL问荆水浸液处理后开始降低,与对照相比差异显著(P<0.05),其中‘龙麦26’随浓度的增加呈显著降低趋势;‘龙麦33’的根冠比在40 mg/mL问荆水浸液处理后开始降低,与对照相比差异显著(P<0.05),‘垦九10’的根冠比在100 mg/mL问荆水浸液处理后开始降低,与对照相比差异显著(P<0.05)。
2.3 问荆水浸液对小麦叶片MDA含量、WSS含量的影响
不同浓度问荆水浸液处理对小麦叶片MDA含量、WSS含量影响如图3所示。随着问荆水浸液浓度的增加,小麦MDA含量均呈升高趋势,40 mg/mL问荆水浸液浓度处理后,各品种小麦的MDA含量显著增加(P<0.05),其中品种‘垦九10’、‘龙麦33’随处理液浓度的增加逐渐升高,与对照相比差异显著(P<0.05)。随着问荆水浸液浓度的增加,小麦WSS含量均呈升高趋势,品种‘垦九10’WSS含量在10 mg/mL浓度处理后开始升高,与对照相比差异显著(P<0.05),且随浓度的增加呈显著升高趋势;其他品种小麦WSS含量在40 mg/mL处理后开始升高,与对照相比差异显著(P<0.05),且随浓度的增加呈显著升高趋势。

图3 问荆水浸液处理小麦叶MDA、WSS含量的变化Fig.3 Variation of MDA and WSS content in wheat leaves under treatment with aqueous extracts of E.arvense
2.4 问荆水浸液对小麦叶片CAT活性、POD活性的影响
不同浓度问荆水浸液处理对小麦叶片CAT活性、POD活性影响如图4所示。随着问荆水浸液浓度的增加,小麦叶片CAT活性均呈升高趋势,品种‘龙麦26’CAT活性在浓度40 mg/mL处理后开始升高,与对照相比差异显著,且随浓度的增加呈显著升高趋势;当处理液浓度达到70、100 mg/mL,品种‘龙麦33’、‘龙辐18’、‘格来尼’CAT活性与对照相比显著升高(P<0.05)。随着问荆水浸液浓度的增加,小麦叶片POD活性均呈升高趋势,低浓度(10、40 mg/mL)问荆水浸液处理后,品种‘龙麦26’、‘垦九10’、‘龙麦33’POD活性与对照相比显著升高(P<0.05),且随浓度的增加逐渐升高;40mg/mL问荆水浸液处理后,‘龙辐18’POD活性与对照相比显著升高(P<0.05);当处理液浓度达到70 mg/mL,‘格来尼’POD活性与对照相比显著升高(P<0.05)。
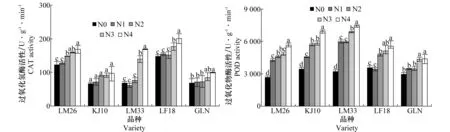
图4 问荆水浸液处理后小麦叶片CAT、POD活性的变化Fig.4 Variation of CAT and POD activity of wheat leaves under treatment with aqueous extracts of E.arvense
3 结论与讨论
在自然环境下,植物产生的水溶性化感物质可以通过雨水淋溶方式进入土壤,当化感物质在土壤中积累超过一定浓度后,就会产生化感作用,从而影响其他植物的生长[13-14]。一般情况下作物在营养生长阶段的干物质积累是产量形成的物质基础,而根冠比是衡量植物生长状况及环境因素对植物生长影响的重要指标。本研究发现,各浓度问荆水浸液处理后,小麦株高变化不显著;小麦叶面积、叶长、干物质积累及根冠比均随问荆水浸液浓度的增加逐渐降低。这可能是由于问荆释放化感物质进入土壤中,当化感物质在土壤中积累超过一定浓度时首先抑制了根的生长,从而降低了小麦根的吸水、吸肥效率,进而阻碍小麦营养体的生长及营养体中干物质的积累,导致小麦植株生长缓慢,最终影响小麦的生长发育。这与何红花[7]等报道的猪殃殃能够释放化感物质,抑制小麦的生长结果相同。
CAT、POD是植物体内重要的保护酶系统[15],可清除活性氧自由基减少活性氧对膜脂的过氧化作用[16],从而提高植物的抗性。当植物处于逆境胁迫时,往往发生膜脂过氧化作用,MDA是其产物之一,通常用来表示细胞过氧化程度和植物对逆境条件反应的强弱[17]。张美云[18]等研究发现植物受到环境胁迫时会影响有机物的形成、转化和运输,使得营养器官内积累较多的WSS,从而调节体内的渗透势,以利其在逆境下维持正常生长提高抗逆适应性。本研究表明,随问荆水浸液浓度的增加,各品种小麦叶片的CAT、POD活性迅速增加并维持在较高水平,其中品种‘垦九10’、‘龙麦33’叶片的CAT、POD活性升高率最高,分别达到46.56%、101.52%和145.82%、130.33%;各品种小麦叶片的WSS含量与对照相比显著升高;而MDA含量在低浓度问荆水浸液处理后迅速增加,随着处理液浓度的增加逐渐维持一定水平。这说明问荆水浸液处理后激发了小麦的抗逆系统,保护酶活性的升高使得活性氧的清除能力增加,小麦的抗逆性加强,从而使得膜脂过氧化程度逐渐减弱。但问荆水浸液对不同品种小麦保护酶系统的影响不同,其中品种‘垦九10’、‘龙麦33’比其他3个品种表现出更强的抗逆性,可进一步利用大田试验研究其与问荆互作的机理,并监测其有效产量,为小麦的合理生产提供依据。
问荆水溶性化感物质可抑制小麦生长、干物质积累,并影响其体内保护酶活性,但植物的化感作用机制是一个十分复杂的生理过程,化感物质可以通过对植物各种生理生化代谢过程来影响植物的生长发育,对保护酶系统的影响只是其中一部分,还可通过影响植物的光合呼吸作用,物质代谢等方面最终对植物的生长发育产生影响[19]。因而还需要从各种代谢途径等方面对问荆的化感作用机制进行更加深入的研究。
[1]Asgarpanah J, Roohi E.Phytochemistry and pharmacological properties ofEquisetumarvenseL.[J]. Journal of Medicinal Plants Research, 2012, 6(21):3689-3691.
[2]李熙灿, 杨小冬. 问荆化学成分及其药理作用的研究进展[J]. 辽宁中医学院学报, 2005, 7(6):633-635.
[3]Rydrych D J. Corn cockle(AgrostemmagithagoL.) competition in winter wheat(TriticumaestivumL.)[J]. Weed Science, 1981, 29:360-363.
[4]Sogaard B,Doll H. A positive allelopathic effect of corn cockle,Agrostemmagithago, on wheat,Triticumaestivum[J]. Canadian Journal of Botany-revue Canadienne de Botanique, 1992, 70:1916-1918.
[5]Wakjira M, Berecha G, Bulti B.Allelopathic effects ofPartheniumhysterophorusextracts on seed germination and seedling growth of lettuce[J].Tropical Science,2005,45(4):159-162.
[6]杨超, 慕小倩. 伴生杂草播娘蒿对小麦的化感效应[J]. 应用生态学报, 2006, 17(12):2389-2393.
[7]张军林, 慕小倩, 李晓玲, 等. 伴生杂草对小麦化感作用的研究初报[J]. 中国农学通报, 2006, 22(7):458-461.
[8]何红花, 慕小倩, 董志刚. 杂草猪殃殃对小麦的化感作用[J]. 西北农业学报, 2007(5):250-255.
[9]Soheila P G, Sirous H, Ramin L. Seed to seed allelopathic effects between wheat and weeds[J]. International Journal of Agriculture and Crop Sciences, 2012, 4(22):1660-1665.
[10]张志良. 植物生理实验指导[M]. 第3版. 北京:高等教育出版社, 2003:127-128.
[11]Pejman N, Hassan K, Morteza M, et al. Allelopathic potential of sunflower on weed management in safflower and wheat[J]. Australian Journal of Crop Science, 2011, 5(11):1434-1440.
[12]中国科学院上海植物生理研究所. 现代植物生理学实验指南[M]. 北京:科学出版社, 1999:305-306.
[13]Meiners S J, Kong C H, Ladwig L M, et al. Developing an ecological context for allelopathy[J]. Plant Ecology, 2012, 213:1221-1227.
[14]Usuah P E, Udom G N, Edem I D. Allelopathic effects of some weeds on the germination of selected seeds of crops grown in Akwaibom State, Nigeria[J]. World Journal of Agricultural Research, 2013, 1(4):59-64.
[15]孙宪芝, 郭先锋, 郑成淑, 等. 高温胁迫下外源钙对叶片光合机构与活性氧清除酶系统的影响[J]. 应用生态学报, 2008, 19(9):1983-1988.
[16]郑丽,冯玉龙.紫茎泽兰叶片化感作用对10种草本植物种子萌发和幼苗生长的影响[J].生态学报,2005,25(10):2782-2787.
[17]Vievk D, Vievk P, Radhey S. Differential antioxidative responses to cadmium in roots and leaves of pea(PisumsativumL.)[J]. Journal of Experimental Botany, 2001, 52(358):1101-1109.
[18]张美云,钱吉,郑师章.渗透胁迫下野生大豆游离脯氨酸和可溶性糖的变化[J].复旦学报(自然科学版),2001,40(5):558-561.
[19]Ladwig L M, Meiners N L, Pisula K A, et al. Conditional allelopathic potential of temperate lianas[J]. Plant Ecology, 2012, 213:1927-1935.
AllelopathiceffectsoftheaqueousextractsofEquisetumarvenseonthegrowthofpottedwheat
Jiao Hao1, Yue Zhonghui1, Sui Haixia1, Wang Huiyi1, Guo Libo1, Liu Baolin2
(1.CollegeofLifeScienceandTechnology,HarbinNormalUniversity/KeyLaboratoryofPlantBiology,CollegeofHeilongjiangProvince,Harbin150025,China; 2.SinograinNorthernAgriculturalCompanyLtd.,Nenjiang161400,China)
In order to investigate the allelopathic effects ofEquisetumarvenseLinn. on crops, we studied plant height, leaf length, leaf area, ratio of fresh to dry weight, and the content of malondialdehyde(MDA), water-soluble sugar(WSS), activity of catalase(CAT) and peroxidase(POD) in potted wheat varieties, including ‘LM26’, ‘KJ10’, ‘LM33’, ‘LF18’ and ‘GLN’, at different concentrations of the aqueous extracts fromE.arvenserhizomes by bioassay method. The results showed that the aqueous extracts ofE.arvenserhizomes stimulated the ratio of root to shoot, the content of WSS, and CAT and POD activities in wheat leaves. However, it inhibited the growth of leaf area, leaf length, ratio of fresh to dry weight. The stimulating and inhibitive effects ofE.arvenseincreased with increasing concentration of exudates. It was shown thatE.arvensehad allelopathic effects on wheat.
Equisetumarvense; wheat; allelopathy
2013-12-12
:2014-04-01
黑龙江省高校重点实验室开放课题(ZK1201203);黑龙江省高校科技创新团队研究计划-哈尔滨师范大学科技创新团队研究计划(KJTD-2011-2);哈尔滨师范大学国家级预研项目(12XYG-10)
Q 945,S451.1
:ADOI:10.3969/j.issn.0529-1542.2014.06.009
* 通信作者 E-mail:yuezhonghui@163.com

