枣疯病植原体TaqMan探针实时荧光定量PCR检测方法的建立
韩 剑, 罗 明*, 徐金虹, 王同仁, 张祥林
(1. 新疆农业大学农学院, 乌鲁木齐 830052; 2. 新疆阿瓦提县农技推广中心,阿瓦提 843200;3. 新疆出入境检验检疫局,乌鲁木齐 830063)
枣疯病植原体TaqMan探针实时荧光定量PCR检测方法的建立
韩 剑1, 罗 明1*, 徐金虹2, 王同仁2, 张祥林3
(1. 新疆农业大学农学院, 乌鲁木齐 830052; 2. 新疆阿瓦提县农技推广中心,阿瓦提 843200;3. 新疆出入境检验检疫局,乌鲁木齐 830063)
根据枣疯病植原体16S rDNA基因保守区域设计、合成特异性引物和TaqMan探针,以构建的重组质粒作为阳性标准品,建立并优化了对枣疯病植原体的TaqMan实时荧光定量PCR检测方法。对优化后的方法进行灵敏度、特异性及稳定性评价,制作了标准曲线。结果显示,制作的标准曲线有极好的线性关系,相关系数(r2)达到0.998,建立的实时荧光定量PCR检测方法能够特异性地检测枣疯病植原体,能检测到60拷贝的质粒DNA。本研究建立的实时荧光定量PCR检测方法灵敏度、特异性、重复性好,不仅能够实现对枣疯病植原体的快速检测,而且为实现从病原定量水平上对枣疯病病情分级奠定了基础。
枣疯病植原体; TaqMan探针; 实时荧光定量PCR; 检测
枣疯病(jujube witches’ broom, JWB)是由植原体引起的、在枣树生产中具毁灭性危害的病害[1]。枣疯病植原体主要通过人工嫁接、根蘖和叶蝉类昆虫介体等方式传播,病原寄生于植株维管束韧皮部内,树体一旦感病,终身带菌并随着苗木扩散和远距离传播,具有分布广、传播速度快、致死率高等特点。枣疯病在国内几乎遍布于各大枣树栽培区,局部地区暴发成灾,枣园濒临毁灭。每年因枣疯病而死的树高达千万株,直接经济损失高达数亿元,严重阻碍了红枣产业的发展[2-3]。枣疯病防治是世界性的难题,多数枣树品种对其敏感。尽管药剂处理、控制传病介体等方法具有一定减轻和延缓发病的作用,但无法根除[4]。要从根本上解决枣疯病的防治问题必须采取有效的预防措施,严格对苗木进行检疫检验和脱毒处理,采用健康苗木和接穗建立无病苗木繁育体系,从源头上杜绝病原,而建立和应用先进的病原检测技术是枣树无病苗木生产的核心所在。
随着分子生物学技术的快速发展,PCR技术已广泛应用于植原体的检测鉴定[5-7]。目前,根据植原体16S rDNA、核糖体蛋白质(rp)、延伸因子(tuf)等基因序列设计引物,通过常规PCR或巢式PCR扩增是检测植原体较常用的手段。但在实际应用过程中,PCR产物需经电泳、染色剂溴化乙锭染色后才能判断扩增结果,存在着操作步骤繁琐,易于造成交叉污染,降低检测灵敏度的问题。近年发展起来的TaqMan探针实时荧光PCR技术是在常规PCR反应体系中添加了一条标记了2个荧光基团的探针,即TaqMan探针。与常规PCR定性检测相比,该法具有更加灵敏、简便、高效、稳定和定量化等优点[8]。本研究应用TaqMan探针实时荧光定量PCR技术建立了针对枣疯病植原体高特异性检测方法,并应用于田间检测,验证了该方法的灵敏度及特异性,实现了从病原定量水平上对枣疯病病情的分级。
1 材料与方法
1.1 供试材料
2009年8月至2012年7月在新疆阿克苏、喀什等地区枣树栽培区调查,采集到表现为丛枝、小叶、黄化等症状的枣疯病疑似植株,样品保存于4 ℃冰箱和液氮中。同时采集健康植株枝叶作为对照。泡桐丛枝病植原体、葡萄金黄化植原体及翠菊黄化植原体由新疆出入境检验检疫局提供。
1.2 试剂及仪器
PGM-T载体、质粒小提试剂盒及RealMasterMix(Probe)购自天根生化科技有限公司。主要仪器:实时荧光PCR仪(Roche Lightcycle 2.0),ND-1 000核酸/蛋白检测仪(Nano Drop公司)。
1.3 枣树叶片总DNA提取
采用植物基因组提取试剂盒(Plant Genomic DNA Kit,TIANGEN)提取枣树叶片总DNA。
1.4 重组质粒的构建和定量
以提取的总DNA为模板,利用引物[9]R16mF2: 5′-CATGCAAGTCGAACGGA-3′,和R16mR1: 5′-CTTAACCCCAATCATCGA-3′扩增枣疯病植原体16S rDNA基因片段,扩增产物经回收、纯化,克隆于PGM-T载体上,提纯含枣疯病植原体16S rDNA的质粒作为质粒标准品,用核酸蛋白紫外分析仪测定A260,计算其质量浓度和拷贝数,-20 ℃保存备用。
1.5 实时荧光定量PCR检测方法的建立及优化
1.5.1 引物及探针设计
在GenBank中搜集已公布的植原体及有代表性细菌的16S rDNA核酸序列,利用Omiga软件对上述序列进行比较及一致性分析,找出枣疯病植原体与其他植原体的基因差异位点。用软件Beacon Designer 7.0筛选出一对引物JWB primer-F/JWB primer-R,引物对经在线序列同源性分析,确定为枣疯病植原体的特异性引物对,并在该引物对的扩增区域设定一条荧光TaqMan探针JWB-probe(表1)。引物和探针由北京鼎国昌盛生物技术有限责任公司合成,探针5′端标记报告荧光染料为6-carboxyfluorescein(FAM),3′端标记淬灭荧光染料为tetramethycarboxyrhodamine (TAMRA)。
表1实时荧光定量PCR的引物及探针序列
Table1SequenceofprimersandTaqManprobeforreal-timefluorescentquantitativePCR
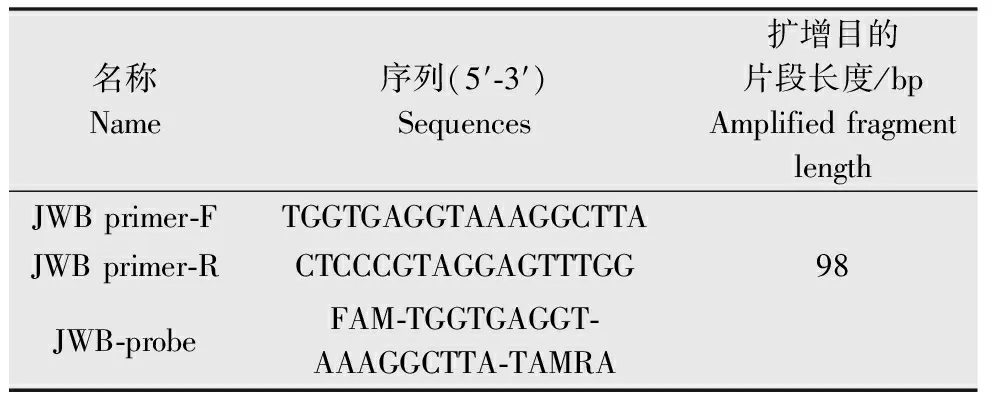
名称Name序列(5′⁃3′)Sequences扩增目的片段长度/bpAmplifiedfragmentlengthJWBprimer⁃FTGGTGAGGTAAAGGCTTAJWBprimer⁃RCTCCCGTAGGAGTTTGG98JWB⁃probeFAM⁃TGGTGAGGT⁃AAAGGCTTA⁃TAMRA
1.5.2 实时荧光定量PCR反应条件
反应体系(20 μL):2.5×realMasterMix 8.0 μL,上游引物JWB primer-F (10 μmol/L) 0.5 μL,下游引物JWB primer-R (10 μmol/L) 0.5 μL,探针JWB-probe(10 μmol/L) 0.5 μL,20×probe enhancer solution 1.0 μL,模板1.0 μL,ddH2O 8.5 μL。反应程序:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 30 s,68 ℃ 1 min,40个循环;68 ℃收集荧光信号。
1.5.3 实时荧光定量PCR反应体系引物对及探针浓度的优化
对反应体系中的引物、探针浓度分别进行优化。将引物对浓度从0.1~1.0 μmol/L以0.1 μmol/L依次递增,探针浓度从0.05~0.5 μmol/L以0.05 μmol/L依次递增,其他条件均不变,通过ΔRn与循环数关系的曲线图确定ΔRn值最大且Ct值最小的最佳引物浓度和探针浓度。
1.6 实时荧光定量PCR的灵敏度试验及标准曲线的建立
将构建的枣疯病植原体质粒进行10倍系列稀释,并以此作为标准阳性模板,利用优化得到的最佳反应体系进行实时荧光定量PCR检测。检测结束后通过ΔRn与循环数关系的曲线图确定TaqMan探针的检测灵敏度,并根据得到的动力学曲线,得出相应的标准曲线方程。
1.7 实时荧光定量PCR的特异性验证
分别提取枣疯病植原体(16SrⅤ组),葡萄金黄化植原体(16SrⅤ组),泡桐丛枝植原体(16SrⅠ组),翠菊黄化植原体(16SrⅠ组)以及田间采集及实验室保存的健康枣树基因组DNA作为模板,进行枣疯病植原体实时荧光定量PCR检测的特异性试验。
1.8 实时荧光定量PCR重复性试验
对3种不同浓度的标准质粒(反应初始体系中含6.09×104、6.09×105和6.09×106拷贝/μL)利用得到的优化反应体系重复检测3次。计算循环阈值(Ct)的平均值、标准差(SD)和变异系数(CV)来评价该方法的稳定性。变异系数(CV)=测定结果的标准差与其平均值的百分比。
1.9 田间样品的适用性检测
从新疆红枣产区采集不同表观症状、不同病级的枝条样品,采用本研究建立的实时荧光定量PCR体系进行检测,并利用建立的标准曲线对样品中的植原体含量定量分析。
2 结果与分析
2.1 实时荧光PCR体系优化
对反应体系中的引物、探针浓度进行筛选优化,以获得ΔRn值最大,Ct值最小的最佳扩增反应体系。
如图1所示,引物对浓度配比在0.1~1.0 μmol/L范围内,扩增曲线的ΔRn值先随引物浓度的升高而升高,当浓度为0.5 μmol/L时,可获得最大ΔRn值和较小的Ct值,之后ΔRn值随引物浓度升高而降低。最终确定最佳引物对浓度为0.5 μmol/L。
探针浓度试验结果表明(图2),随着探针浓度递增,ΔRn依次增加,在0.4 μmol/L时,ΔRn值达到最大,但是相对应的曲线不平滑。之后ΔRn值随着探针浓度的递增而降低,说明探针过量,无足够的PCR产物与探针结合。经过多次重复试验,并从经济节约的角度考虑,选择0.25 μmol/L为最佳反应用量。
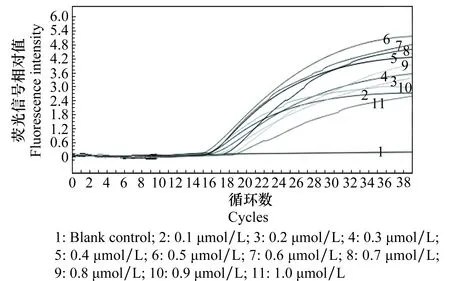
图1 引物对浓度优化
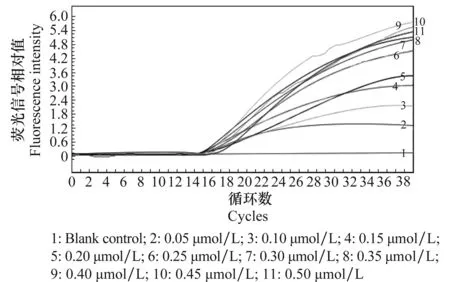
图2 探针浓度优化
2.2 灵敏度试验
以所构建的枣疯病植原体质粒标准品(浓度测定为280 ng/μL,对应为6.09×1010拷贝/μL)的10倍系列稀释液作为标准阳性模板进行实时荧光定量PCR和常规PCR检测。结果显示(图3):实时荧光PCR反应可检测模板浓度的下限为6.09×10 拷贝/μL(2.8 fg/μL)。
以标准阳性模板不同浓度的对数值为横坐标,循环数为纵坐标作图,得到标准曲线(图3)。结果显示,标准曲线的斜率为-3.354,扩增效率>90%,Ct值和质粒拷贝数的对数值之间具有良好的相关性(r2=0.998)。因此根据未知样品的Ct值和回归方程,即可对起始模板的拷贝数精确定量。
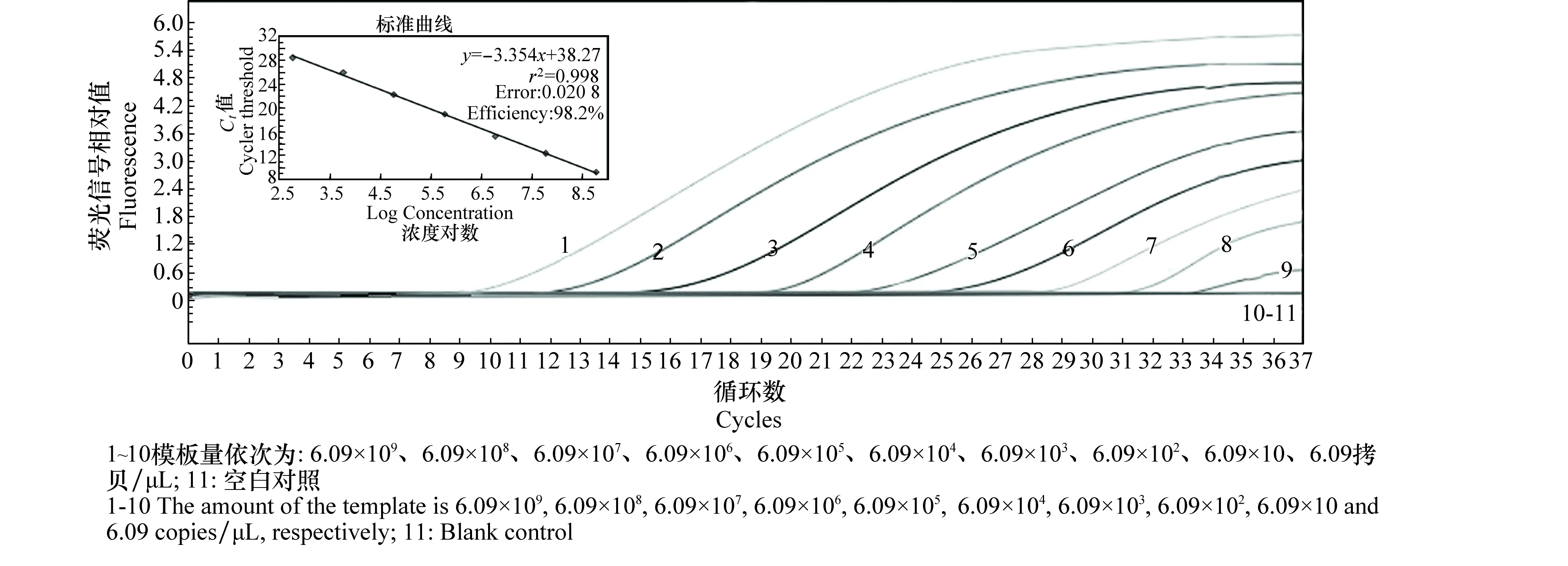
图3 实时荧光PCR灵敏度
2.3 特异性验证
以提取的相同浓度的枣疯病植原体、葡萄金黄化植原体、泡桐丛枝植原体,翠菊黄化植原体总DNA为模板,用本研究设计合成的引物(JWB primer-F/JWB primer-R)和探针(JWB-probe)进行实时荧光PCR检测验证其特异性。结果显示(图4),除枣疯病植原体DNA有荧光信号产生外,其余植原体均未收集到荧光信号。说明本检测体系所用的引物及探针直接针对枣疯病植原体检测,而与枣疯病植原体同属榆树黄化组(16SrⅤ组)的葡萄金黄化植原体,属于植原体翠菊黄化组(16SrⅠ组)的泡桐丛枝植原体、翠菊黄化植原体以及健康枣树均未检测到荧光信号增加,可见引物及探针具有很强的特异性。
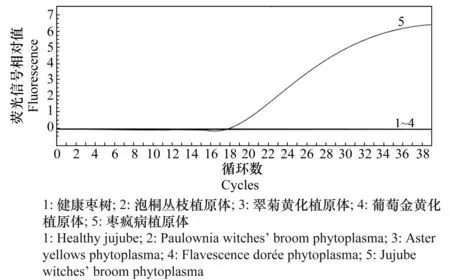
图4 实时荧光PCR特异性
2.4 实时荧光PCR的重复性
重复性试验结果显示(表2),各重复试验的Ct值误差均不到1个循环,且Ct值变异系数均小于5%。证明本研究建立的实时荧光PCR体系重复性好,从而保证了不同样品间检测结果的可靠性和稳定性。
表2实时荧光PCR的重复性检测
Table2Repetitiondetectionbythereal-timePCR
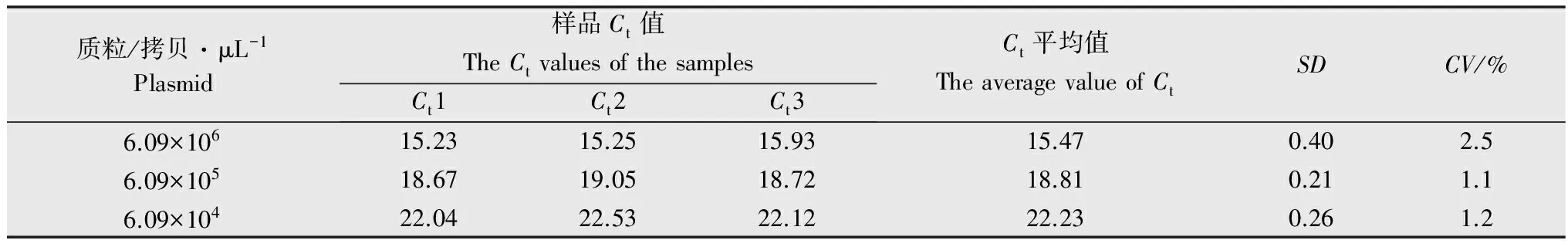
质粒/拷贝·μL-1Plasmid样品Ct值TheCtvaluesofthesamplesCt1Ct2Ct3Ct平均值TheaveragevalueofCtSDCV/%6.09×10615.2315.2515.9315.470.402.56.09×10518.6719.0518.7218.810.211.16.09×10422.0422.5322.1222.230.261.2
2.5 田间样品的适用性检测
对田间采集病株样品分别采用常规PCR和实时荧光定量PCR检测。常规PCR对发病症状为2级、3级病株的检测结果为阳性反应,无症状(0级)病株检测结果为阴性。而实时荧光定量PCR检测,病情为2级、3级以及无症状(0级)病株检测结果均为阳性反应,其Ct值依次为20.77、14.39、24.56。通过建立的枣疯病植原体荧光定量PCR标准曲线方程计算出病情级别为2级、3级的枣树枝叶中植原体16S rDNA片段拷贝数分别为1.66×105个/g 鲜重和 1.32×107个/g 鲜重,而无明显症状(0级)的枝叶中植原体16S rDNA片段拷贝数达到1.23×104个/g 鲜重。结果证明,实时荧光定量PCR检测提高了检测灵敏度,能检测出侵染初期处于隐症状态的样品中枣疯病植原体的存在。
3 讨论
植原体的分离培养至今尚未获得成功。由于植原体在植株体内含量低,又不像病毒易于提纯,检测难度大。长期以来,植原体的检测主要依靠生物学测定(表观症状、嫁接传病)、电镜观察、组织化学、血清学等方法[10-12],存在灵敏度低、特异性差、周期长和操作繁琐等不足,已不能满足现代生产的需要。最近十几年,随着分子生物学技术的快速发展,植原体检测技术才得到了重大突破。普通PCR、巢氏PCR和免疫捕获PCR等技术应用使植原体检测灵敏度有了显著提高。但这些方法过程繁杂,操作步骤多,效率低,而且需要PCR后处理,如琼脂糖凝胶电泳和溴化乙锭染色,不仅费时费力又易造成污染和假阳性,影响对结果的正确判断,降低了检测的灵敏度。本研究建立的枣疯病植原体TaqMan探针实时荧光PCR检测灵敏度达到60 拷贝/μL。整个过程采用完全闭管检测,根据扩增曲线直接判断结果,省去了对PCR产物电泳、染色等繁琐的步骤,避免了可能造成的PCR产物交叉污染。且能在1 h内完成过程,大大提高了检测效率。
廖晓兰等[13]首次将实时荧光PCR技术用于植原体的检测,设计并合成了植原体广谱荧光探针和针对椰子致死黄化组(16SrⅣ组)、苹果丛生组(16SrⅩ 组)和榆树黄化组(16SrⅤ组)植原体的组特异性荧光探针,成功地检测了9种植原体。侯立华等[14]设计合成了榆树黄化组(16SrⅤ组)探针对枣疯病植原体拷贝数进行了定量检测,灵敏度达到了85 拷贝/μL。已报道这些方法是针对植原体16SrⅤ组设计的引物和探针,用于检测植原体16SrⅤ组的成员,实现植原体组间的特异性检测。16SrⅤ组划分为3个亚组[15],包括榆树黄化(16SrⅤ-A)枣疯病(16SrⅤ-B)、葡萄金黄化(16SrⅤ-C)等多种重要的植原体。研究发现,16SrⅤ组内的植原体菌株间序列差异很小(<1.2%),要对不同亚组植原体进行区分和鉴定较为困难[16]。本研究在对植原体大量基因信息进行分析比较的基础上,设计了针对枣疯病植原体特异性的探针及引物。特异性检测结果表明,对本研究中从新疆获得的多个枣疯病菌株均可产生明显的增强荧光信号,而隶属于同组但不同亚组的葡萄金黄化植原体和不同组(16SrⅠ组)的泡桐丛枝植原体、翠菊黄化植原体均未检测到荧光信号增加,可见设计的探针及引物具有较好的特异性,提高了枣疯病植原体检测的针对性和检测效率。但由于植原体标样来源的限制,特异性检测供试的植原体种类较少,且只涉及植原体的2个组。因此,需进一步广泛收集菌株,扩大检测范围以进一步验证其特异性。
枣疯病为维管束传导的系统感染性病害。枣树感染植原体后,会引起树体一系列的生理代谢紊乱,病情由轻到重演变,其可控程度也由易到难[17-18]。因此,掌握枣疯病病情的发生、发展规律,根据病级,因树、因园、因地制宜采取分类治理措施,对于病害的综合防治具有重要意义。刘孟军等[19]依据症状特点,建立了从组织、病枝、病株、病园和病区等5个水平对枣疯病病情分级的标准。但其病情分级未反映不同病级植株体内病原累积状况。本研究应用建立的TaqMan探针实时荧光PCR方法,对不同症状病级的病样中植原体进行了精确定量,证明了该检测方法可从微观水平反映病原从初侵染到逐步积累,是对依据症状划分病级的补充,能更加客观、科学地反映病害发展进程。同时,通过检测发现枣园中无症带菌处于隐症状态病株普遍存在,经过1~2年期的潜伏逐渐表现症状。
近几年来,新疆红枣生产规模快速扩张和迅猛发展,仅南疆地区的枣树栽培面积就已近30万 hm2,成为我国最大的红枣生产基地。南疆地区绝大多数为新建枣园,通过直接调入苗木和以酸枣作砧木,引入接穗进行嫁接,并结合扦插、分株等无性繁殖方式解决苗木的供应问题,极易引起枣疯病的感染及传播。2009年,笔者首次发现并报道了枣疯病已在新疆南疆部分地区发生[20-21],目前尚属个别、零星、团簇状分布,但个别枣园局部发生严重,对蓬勃发展的红枣产业带来严重的隐患。因此,建立快速、准确的枣疯病植原体检测方法对于病害的早期诊断、口岸检疫、田间流行监测预报和指导病害的综合防治提供了良好的技术支撑。
[1]田国忠, 张志善, 李志清, 等. 我国不同地区枣疯病发生动态和主导因子分析[J]. 林业科学, 2002,38(2):83-91.
[2]范俊秀. 枣疯病和枣缩果病研究进展[J]. 山西林业,2009,37(6):37-39.
[3]Sun Xianchao, Mou Haiqing, Li Tingting, et al. Mixed infection of two groups (16SrI &V) phytoplasmas in one single jujube tree in China [J]. Journal of Phytopathology, 2013,161(9):661-665.
[4]刘孟军, 赵锦, 周俊义. 枣疯病[M]. 北京:中国农业出版社, 2010:137-154.
[5]介大委, 翟晓巧, 聂琳. 植原体检测和鉴定技术[J]. 河南林业科技, 2009,29(1):39-44.
[6]Lee I M, Hammond R W, Davis R E, et al. Universal amplification and analysis of mycoplasma like organisms[J]. Phytopathology, 1993,83:834-842.
[7]徐启聪, 田国忠, 王振亮, 等. 中国各地不同枣树品种上枣疯病植原体的PCR检测及分子变异分析[J]. 微生物学报, 2009,49(11):1510-1519.
[8]Heid C A, Stevens J, Livak K J, et al. Real-time quantitative PCR[J]. Genome Research, 1996,6:986-994.
[9]Lee I M, Davis R E, Gundersen-Rindal D E. Phytoplasma:phytopathogenic mollicutes[J]. Annual Review of Microbiology, 2000,54:221-255.
[10]金开璇, 汪跃, 张锐, 等. 山楂丛枝病类菌原体(MLO)的电镜观察[J]. 林业科学研究, 1992,5(3):365-366.
[11]金开璇, 田国忠, 汪跃. 组织化学技术快速检测泡桐丛枝病研究[J]. 植物病理学报, 1989,19(3):185-188.
[12]Khadhair A H, McClay A, Hwang S F, et a1. Aster yellows phytoplasma identified in scentless chamomile by microscopica examinations and molecular characterization [J]. Journal of Phytopathology, 1999,147(3):149-154.
[13]廖晓兰, 朱水芳, 陈红运, 等. 植原体TaqMan探针实时荧光PCR检测鉴定方法的建立[J]. 植物病理学报, 2002,32(4):361-367.
[14]侯立华, 黄新, 朱水芳. 枣疯病植原体实时荧光定量PCR检测方法的研究[J]. 生物技术通讯, 2010,21(1):70-72.
[15]廖晓兰, 朱水芳, 罗宽. 植原体的分类及分子生物学研究进展[J]. 植物检疫, 2002,16(3):167-172.
[16]Davis R E, Dally E L. Revised subgroup classification of group 16SrV phytoplasmas and placement of Flavescence dorée-associated phytoplasmas in two distinct subgroups [J]. Plant Disease, 2001,85:790-797.
[17]Lee Sanghun, Kim Chuleung, Cha Byeongjin. Migration and distribution of graft-inoculated jujube witches’-broom phytoplasma within aCantharanthusroseusplant[J]. Plant Pathology Journal, 2012,28(2):191-196.
[18]Liu X G, Liu M J, Ning Q, et a1. Reverse-cleft in vitro micrografting ofZiziphusjujubaMill. infected with jujube witches’ broom (JWB) [J]. Plant Cell, Tissue and Organ Culture, 2012,108(2):339-344.
[19]刘孟军, 赵锦, 周俊义. 枣疯病病情分级体系研究[J]. 河北农业大学学报, 2006,29(1):31-33.
[20]韩剑, 徐金虹, 王同仁, 等. 枣疯病植原体新疆分离物16SrDNA基因克隆与序列分析[J]. 西北农业学报, 2012,21(4):176-180.
[21]韩剑, 徐金虹, 王同仁, 等. 新疆枣疯病植原体tuf基因的克隆与序列分析[J]. 新疆农业科学, 2013,50(3):476-483.
Establishmentofreal-timefluorescentquantitativePCRmethodwithTaqManprobefordetectionofjujubewitches’broomphytoplasma
Han Jian1, Luo Ming1, Xu Jinhong2, Wang Tongren2, Zhang Xianglin3
(1.AgronomyCollege,XinjiangAgriculturalUniversity,Urumqi830052,China;2.AwatAgriculturalTechnologyExtensionCenter,Awat843200,China;3.XinjiangEntry-ExitInspectionandQuarantineBureau,Urumqi830063,China)
A set of primers and TaqMan probe specific for Jujube witches’ broom phytoplasma were designed according to the conserved region of 16S rDNA gene, and the recombinant plasmid was constructed as a standard control. A TaqMan real-time fluorescent PCR assay for quantitative detection of the pathogen was established and optimized. The evaluation assay indicated that a good linear correlation was demonstrated in the standard curve for the real-time fluorescent PCR assay, with the correlation coefficient (r2) of 0.998. The method was specific to jujube witches’ broom phytoplasma, and it can detect 60 copies/μL plasmid DNA. It not only provides a sensitive, specific and reproducible method for detection of jujube witches’ broom phytoplasma, but also lays the foundation for the grading system of the pathogen at quantitative level.
jujube witches’ broom phytoplasma; TaqMan probe; real-time fluorescent quantitative PCR; detection
2013-11-14
:2014-04-08
新疆维吾尔自治区高校科研计划项目(XJEDU2010S15);新疆维吾尔自治区自然科学基金(2010211A17);质检公益性行业科研专项(201310091)
S 41; Q939.34
:ADOI:10.3969/j.issn.0529-1542.2014.05.020
* 通信作者 E-mail:luomingxjau@sina.com

