绿僵菌Ma55抗多菌灵突变株的诱变及抑菌作用研究
齐永霞, 陈方新, 丁 婷
(安徽农业大学植物保护学院,合肥 230036)
绿僵菌Ma55抗多菌灵突变株的诱变及抑菌作用研究
齐永霞, 陈方新*, 丁 婷
(安徽农业大学植物保护学院,合肥 230036)
在室内条件下测定了供试绿僵菌对多菌灵的抗性。结果表明,供试菌株对多菌灵均表现为敏感,其中,Ma55菌株对多菌灵最敏感。采用分生孢子定向筛选的方法获得了金龟子绿僵菌抗多菌灵突变株,测定了抗性突变株对多菌灵的抗性差异。结果显示,在获得的抗性突变株中,MC-2的EC50最大,达到397.064 3 μg/mL,对多菌灵的抗性水平最高,抗性水平指数达到102.35。对Ma55抗多菌灵突变株的菌丝生长速率、产孢量及对棉花枯萎病菌和棉花红腐病菌的抑制效果的研究结果表明,抗性突变株的菌丝生长速率均比亲本菌株Ma55小,但产孢量均比Ma55大,其中,MC-2的产孢量最大,为5.12×106个/mL;MC-5次之,其产孢量为4.81×106个/mL,MC-8的产孢量在抗性突变株中最低。平板对峙培养结果显示,金龟子绿僵菌抗多菌灵突变株对棉花枯萎病菌和棉花红腐病菌菌丝生长的抑制作用均达到显著水平,其中,MC-2对棉花枯萎病菌、棉花红腐病菌菌丝生长的抑制作用最强,与亲本对照菌株Ma55差异不显著。
金龟子绿僵菌; 多菌灵; 抗性水平; 菌丝生长速率; 产孢量
绿僵菌[Metarhizium(Metsch.)Sorokin]是用来防治农林害虫最常见的致病真菌之一[1-2],特别是在防治土栖害虫方面有着独特的效果,其寄主昆虫广泛,达200种以上[3-6]。由于绿僵菌易于人工培养和商品化生产,有较好的贮藏性能,对环境较安全等优点,现在中国、美国、巴西、澳大利亚、墨西哥和日本等国均有绿僵菌商品制剂,主要用于防治沫蝉、蚊子、叶螨、蝗虫等[7-12]。在国内,用绿僵菌对天牛、梨星毛虫、菜青虫、蠹虫、蚊子等多种农林害虫进行了防治试验研究,均取得了良好的效果[13-16]。徐良雄等[17-18]从绿僵菌SC0924菌株发酵产物中分离获得多种化合物,发现其中多种酚酸类化合物对荔枝霜疫霉菌具有很好的抑菌活性。这说明绿僵菌不仅在农、林、卫生害虫防治上具有重要的作用,在植物病害的防治方面也具有潜在的应用价值。
自20世纪60年代以来,已有50多种绿僵菌制剂产品被研制出来并获得登记[19]。然而,目前生产上使用的制剂多为孢子活菌制剂,在施用过程中常受到真菌杀菌剂的干扰。以多菌灵为代表的苯并咪唑类杀菌剂是一类重要的化学杀菌剂,因其内吸性强、毒性低、杀菌谱广等特点,在田间得到广泛应用。因此,金龟子绿僵菌在田间应用时容易受到该类广谱性杀菌剂的干扰[20]。本研究在测定金龟子绿僵菌对多菌灵敏感性的基础上,通过分生孢子定向筛选的方法对Ma55菌株进行了抗药性诱变,得到抗多菌灵突变株8株,研究了抗性菌株在菌丝生长速率、产孢量、抗多菌灵稳定性及对棉花枯萎病菌和棉花红腐病菌的拮抗作用,对进一步研究金龟子绿僵菌在植物根际的定殖能力及丰富土传植物病害的生物防治资源具有重要的意义。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
金龟子绿僵菌[M.anisopliae(Metsch.)Sorokin](编号分别为Ma9、Ma10、Ma27和Ma55),由安徽农业大学微生物防治重点实验室保存;棉花枯萎病菌[Fusariumoxysporumf.sp.vasinfectum(Atk.) Snyder & Hansen]和棉花红腐病菌(F.moniliformeSheld.)由安徽农业大学植保学院植病教研室提供。
1.1.2 供试药剂
97%多菌灵(carbendazim)原药,江苏省江阴农药厂生产。先用灭菌蒸馏水配制成5 000 μg/mL的母液备用。
1.1.3 供试培养基
SDAY培养基[21]:蛋白胨10 g,葡萄糖40 g,酵母10 g,琼脂15 g,水1 000 mL,自然pH。
PDA培养基[22]:马铃薯200 g,葡萄糖20 g,琼脂15 g,水 1 000 mL,自然pH。
1.2 试验方法
1.2.1 金龟子绿僵菌对多菌灵的敏感性测定
用菌丝生长速率法测定金龟子绿僵菌对多菌灵的敏感性。将金龟子绿僵菌各供试菌株分别转接到SDAY培养基平板上活化,收集其分生孢子并配成一定浓度的分生孢子悬浮液,取200 μL分生孢子悬浮液均匀涂布于SDAY培养基平板上,放置于25 ℃的光照培养箱中培养3 d后,用直径6 mm的打孔器沿其菌落边缘打取菌碟,将菌碟分别移接到含多菌灵0.05、0.1、0.25、0.5、1、5、10.0和25 μg/mL的SDAY培养基平板上,以不加药剂的处理为空白对照,每个处理重复4次。试验重复3次。3 d后用十字交叉法逐日测量菌落直径,通过菌丝生长抑制几率值与多菌灵浓度对数之间的线性回归分析,计算各菌株对多菌灵的EC50值。按下列公式计算菌丝生长抑制率;
菌落直径(mm)=测量菌落直径平均值-6.0;
菌丝生长抑制率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100。
1.2.2 抗多菌灵突变株的定向筛选
参照文献[23]的方法,根据金龟子绿僵菌对多菌灵的敏感性测定结果,选择EC50最小的Ma55菌株作为试验用菌株,待Ma55菌株大量产孢后,配制Ma55分生孢子悬浮液。取100 μL Ma55分生孢子悬浮液均匀涂布在含多菌灵质量浓度为10 μg/mL的SDAY平板上,并用封口膜封口。1周后每隔2 d观察1次,14~21 d后可见含药平板上有单菌落出现,选取生长良好的单菌落,移至不含药的SDAY平板上,待其产孢后,制成孢子悬浮液,吸取100 μL孢子悬浮液均匀涂布在含下一高浓度多菌灵的SDAY平板上,依次类推。试验最后筛选出耐多菌灵200 μg/mL的突变体菌株,分别记为MC-1、MC-2、MC-3、MC-4、MC-5、MC-6、MC-7和MC-8。
1.2.3 抗多菌灵突变株的抗性水平测定
将8株突变株MC-1~MC-8,用直径6 mm的打孔器打取菌落边缘菌块,移接到含多菌灵浓度分别为1.00、2.00、5.00、10.00 和25.00 μg/mL的SDAY培养基上培养。以不加药剂的处理为对照,每处理4次重复。重复3次试验。1周后用十字交叉法测量各抗性突变株的菌落直径,并在此基础上通过菌丝生长抑制几率值与多菌灵浓度对数之间的线性回归分析,计算各抗性菌株的EC50。根据以下公式计算抗性水平:
抗性水平=抗性菌株的EC50/敏感菌株的EC50。
1.2.4 抗多菌灵突变株的菌丝生长速率测定
将8株抗多菌灵突变株和亲本敏感菌株Ma55活化后,用打孔器打取菌落边缘菌块,移接到SDAY平板上,每个处理重复3次,25 ℃恒温培养3 d后,逐日测量各菌株的菌落直径,并计算菌株的菌丝日均生长速率。菌丝日均生长速率计算公式为:
菌落直径(mm)=测量菌落直径平均值-6.0;
菌丝日均生长速率(mm/d)=菌落直径(mm)/生长时间(d)。
1.2.5 抗性突变株的产孢能力研究
待1.2.4中的菌落生长至第15天时,用0.05%的吐温-80水溶液洗下各菌株的分生孢子,并用血球计数板计数,每处理重复3次。
1.2.6 抗多菌灵突变株的稳定性研究
将8株抗多菌灵突变株和亲本敏感菌株Ma55继代培养12代后,再移接到含多菌灵200 μg/mL的SDAY培养基上培养,每处理重复3次,1周后测量各菌株的菌落直径,第15天时测量产孢量,根据菌落直径及产孢量初步了解抗多菌灵突变株对多菌灵抗性的遗传稳定性。
1.2.7 抗性突变株对棉花枯萎病菌和红腐病菌的拮抗作用
采用平板对峙培养法,将金龟子绿僵菌抗性突变株和亲本菌株Ma55转接到SDAY平板上活化后,用直径6 mm的打孔器沿其菌落边缘打取菌碟,将病原菌菌碟接种于PDA平板的中间,金龟子绿僵菌抗性突变株和Ma55菌株分别接种于PDA平板上相距病原菌菌碟约4 cm处,同时设只接种金龟子绿僵菌和病原菌的平板为对照,各处理重复3次,每天观察并记载金龟子绿僵菌和病原菌的菌落相向半径。按下列公式计算菌丝生长抑制率:
菌落半径(mm)=测量菌落半径平均值-3.0;
菌丝生长抑制率(%)=(对照菌落半径-处理菌落半径)/对照菌落半径×100。
1.2.8 统计分析
数据处理及分析软件采用DPS v7.05版和Excel 2007。
2 结果与分析
2.1 绿僵菌对多菌灵的敏感性差异
以金龟子绿僵菌Ma9、Ma10、Ma27和Ma55菌株为供试菌株,测定了金龟子绿僵菌对多菌灵的敏感性。方差分析结果(表1)表明,多菌灵对供试4株金龟子绿僵菌菌株的EC50差异显著,其中,Ma55菌株的EC50最小,对多菌灵的敏感性最强,其次是Ma27菌株,Ma10菌株的EC50最高,为4.051 2 μg/mL。此外,试验过程中还发现,在含有10 μg/mL多菌灵的SDAY培养基上,各供试菌株的生长非常微弱,在含25 μg/mL多菌灵的SDAY平板上,供试菌株完全被抑制。

表1 供试菌株对多菌灵的敏感性1)Table 1 Sensitivity of the strains ofM.anisopliae to carbendazim
1) 表中同列数据后不同的小写字母表示菌株之间差异显著,且达到95%的置信度(Duncan多重比较法),下表同。
The different lowercase letters in the same column show significant difference among strains at 95% confidence level using the Duncan’s multiple comparisons, same as in the following tables.
2.2 Ma55不同抗性突变株对多菌灵的抗性水平
测定了8株Ma55抗多菌灵突变株对多菌灵的抗性水平。结果显示(表2),在抗性突变株中,MC-2菌株的EC50最大,为397.064 3 μg/mL;其次是MC-8菌株,EC50为222.772 1 μg/mL;MC-4菌株的EC50最小,为149.544 0 μg/mL。计算了各抗性突变株对多菌灵的抗性水平,发现MC-2菌株的抗性水平最高,达到102.35,其次是MC-8菌株,MC-4菌株的抗性水平最低。
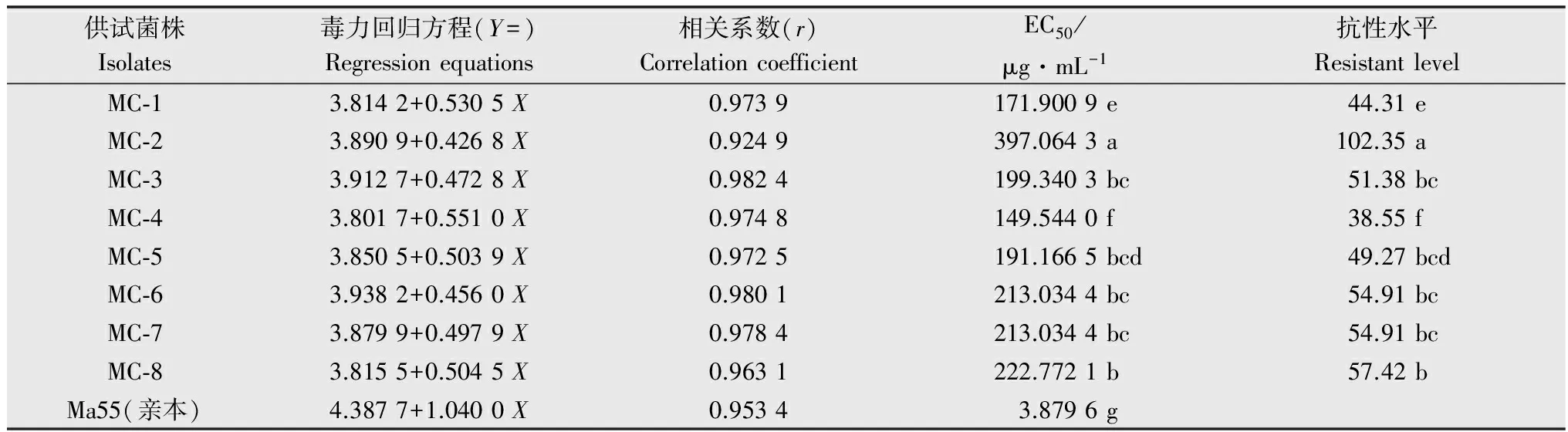
表2 Ma55抗多菌灵突变株对多菌灵的敏感性Table 2 Sensitivity of the carbendazim-resistant isolates of Ma55 to carbendazim
2.3 Ma55抗性突变株的菌丝生长速率
菌丝生长速率测定结果(表3)表明,定向筛选获得的8株Ma55抗多菌灵突变株的菌丝生长速率与亲本菌株Ma55存在显著性差异,亲本菌株Ma55的菌丝平均生长速率最大,达到1.57 mm/d; MC-8次之,达到1.37 mm/d,MC-2菌株的平均生长速率最小,为1.27 mm/d。

表3 Ma55不同抗性突变株的菌丝生长速率和产孢量Table 3 Mycelia growth rates and conidia productionof the carbendazim-resistant isolates of Ma55
2.4 Ma55抗性突变株的产孢能力
由表3可以看出,Ma55抗多菌灵突变株的分生孢子产生能力均比Ma55菌株强,但不同抗性突变株间的产孢量存在显著差异。在抗性突变株中,MC-2菌株的产孢量最大,其产孢量为5.12×106个/mL,其次是MC-5菌株,其产孢量为4.81×106个/mL,MC-8菌株的产孢量在抗性菌株中最低。
2.5 Ma55抗多菌灵突变株的抗药稳定性研究
将8株抗多菌灵突变株继代培养12代后,再移接到含多菌灵浓度为200 μg/mL的SDAY培养基上培养,Ma55抗多菌灵突变株均能正常生长和产孢。由表4可以看出,在抗性突变株中,除了MC-2菌株外,其他菌株第2代和第12代的菌落直径及产孢量在5 %的水平上差异性显著。结果显示MC-2菌株的抗药性较为持久和稳定。

表4 抗多菌灵菌株在含多菌灵200 μg/mL培养基上的菌落直径(7 d)1)Table 4 Colony diameters of carbendazim-resistant mutant strains on the medium containing 200 μg/mL of carbendazim
1) 同行数据后小写字母表示处理间的差异性(95%的置信度)(Duncan多重比较法)。
Data in the same row followed by the different lowercase letters are significantly different at 95% confidence level by Duncan’s multiple comparisons.
2.6 Ma55抗多菌灵突变株对棉花枯萎病菌和棉花红腐病菌的拮抗作用
平板对峙培养结果表明(表5),Ma55抗性突变株对供试的棉花枯萎病菌和棉花红腐病菌均具有较好的抑菌活性。由表5可以看出,8株抗多菌灵突变株对棉花枯萎病菌和棉花红腐病菌菌丝生长的抑制作用均达到显著水平,MC-2菌株对棉花枯萎病菌、棉花红腐病菌菌丝生长的抑制作用最强,与亲本对照菌株Ma55差异不显著;其次是MC-8菌株,MC-4菌株对两种供试植物病原真菌的抑制作用相对较差。

表5 Ma55抗多菌灵突变株对棉花红腐病菌和棉花枯萎病菌菌丝生长的抑制效果1)Table 5 Inhibitory rates of the carbendazim-resistantisolates of Ma55 against F.oxysporum f.sp.vasinfectum and F. moniliforme
1) 同列数据后小写字母表示处理间的差异性(95%的置信度)(Duncan多重比较法)。
The different lowercase letters in the same column show significant difference at 95% confidence level by Duncan’s multiple comparisons.
3 讨论
自20世纪60年代以来,人们逐渐认识到化学药剂对生态环境的破坏性以及残留污染对人类自身健康的影响,便开始努力发展有效的替代防治方法,以利植物保护的可持续发展[24]。生物防治由于克服了化学防治的上述弊端,一直受到人们的广泛关注,且研究和实践已证明其对部分有害生物的防治确实经济有效,因而越来越受到人们的重视。但在植物有害生物的综合治理过程中,经常会遇到需要同时或先后使用生物农药和化学杀虫剂、杀菌剂,以提高防效,降低作物产量和品质损失。
目前生产上应用绿僵菌等虫生真菌防治马尾松毛虫、玉米螟和水稻叶蝉等,均取得良好的防治效果。然而,该类虫生真菌主要以分生孢子作为害虫的感染源,在实际生产应用时常受到很多外界环境因素的影响,其中包括化学农药,许多化学杀虫剂与杀菌剂对虫生真菌会造成一定程度的负面影响,特别是杀菌剂的影响更为明显[25-27]。张英财等[28]测定了18种常用低毒化学农药对绿僵菌孢子萌发、菌丝生长及产孢量的影响,结果发现多菌灵、代森锰锌和甲基硫菌灵对绿僵菌的毒害作用极强,即使在低浓度下也完全抑制孢子萌发和菌丝生长。徐金柱等[29]研究了波尔多液、多菌灵、三唑酮、甲基硫菌灵等6种化学杀菌剂对金龟子绿僵菌Ma83孢子萌发的影响,结果表明,除保护剂波尔多液外,供试的其他几种杀菌剂对孢子萌发均具有极强的抑制作用,甲霜灵、百菌清和甲基硫菌灵对孢子萌发的抑制率在24 h时均达到100%。因此,人们在筛选强致病力杀虫真菌菌株的同时,还应开展其制剂与化学药剂相容性的研究,尽量提高虫生真菌制剂的田间防治效果。另外,开展化学农药与杀虫真菌相容性研究并不仅仅是为了保证菌剂在田间充分发挥杀虫作用,避免与不相容的化学农药接触,更为重要的是对开发菌药复配剂,提高病虫害的防治效果具有重要的指导意义。本研究在实验室条件下测定了金龟子绿僵菌不同菌株对多菌灵的敏感性,结果显示,多菌灵对供试的绿僵菌EC50分布范围是3.879 6~4.051 2 μg/mL,对多菌灵均表现为敏感,而多菌灵等苯并咪唑类杀菌剂作为一类广谱性杀菌剂在田间被广泛使用。因此,在田间有多菌灵存在的情况下,若绿僵菌与该类药剂直接接触,绿僵菌的生长必然会受到不同程度的干扰,从而进一步影响其对病虫害的防治效果。采用药剂定向诱导和筛选的方法对绿僵菌进行抗药性改良,筛选得到抗药性强的突变株对更好地发挥绿僵菌对农林病虫害的防治具有重要的意义。
[1]李春香, 安彦杰, 张淑红. 绿僵菌防治农林害虫研究进展[J]. 唐山师范学院学报,2006,28(5):4-6.
[2]金玉荣, 殷宏, 罗建勋. 生防绿僵菌研究进展[J]. 安徽农业科学,2009,37(5):2060-2062.
[3]单乐天, 冯明光. 不同寄主及地理来源的16株绿僵菌对桃蚜的毒力比较[J]. 微生物学报,2006,46(4):602-607.
[4]Shah F A, Prasad M, Butt T M. A novel method for the quantitative assessment of the percolation ofMetarhiziumanisopliaeconidia through horticultural growing media[J]. BioControl, 2007,52:889-893.
[5]Brooks A, Wall R. Horizontal transmission of fungal infection byMetarhiziumanisopliaein parasiticPsoroptesmites(Acari:Psoroptidae)[J]. Biological Control,2005,34:58-65.
[6]裘晖, 吴振强, 梁世中. 金龟子绿僵菌及其杀虫机理[J]. 农药,2004,43(8): 342-345.
[7]雷仲仁, 问锦曾. 绿僵菌治蝗研究进展[J]. 植物保护,2004,30(4): 14-17.
[8]Prior C, Carey M, Hraham Y J, et al. Development of a bioassay method for the selection of entomopathogenic fungi virulent to the desert locustSchistocercagregaria(Forakal)[J]. Journal of Applied Entomology,1995,11(9):567-575.
[9]金玉荣, 殷宏, 罗建勋. 生防绿僵菌研究进展[J]. 安徽农业科学,2009,37(5):2060-2062,2077.
[10]Sim K L, Perry D. Analysis of swainsonine and its early metabolic precursors in cultures ofMetarhiziumanisopliae[J]. Glycoconjugate Journal,1997,14:661-668.
[11]Chandler D, Davidson G, Jacobson R J. Laboratory and glasshouse evaluation of entomopathogenic fungi against the two-spotted spider mite,Tetranychusurticae(Acari:Tetranychidae), on tomato,Lycopersiconesculentum[J]. Biocontrol Science and Technology,2005,15(1):37-54.
[12]Kirkland B H, Cho E M, Keyhani N O. Differential susceptibility ofAmblyommamaculatumandAmblyommaamericanum(Acari:Ixodidea) to the entomopathogenic fungiBeauveriabassianaandMetarhiziumanisopliae[J]. Biological Control,2004,31:414-421.
[13]叶斌, 江英成, 林文清, 等. 金龟子绿僵菌对马尾松林节肢动物群落多样性的影响[J]. 福建农林大学学报(自然科学版), 2005,34(2):239-243.
[14]宋漳, 江英成. 绿僵菌防治第1代马尾松毛虫的研究[J]. 应用与环境生物学报, 2001,7(6):604-608.
[15]于凤泉, 田春晖, 李志强, 等. 绿僵菌对稻水象甲的田间防治效果研究[J]. 辽宁农业科学,2008(6):5-8.
[16]丁福章,张泽华,张礼生,等.绿僵菌对椰心叶甲的控制作用研究[J]. 西南农业大学学报(自然科学版), 2006,28(3):454-456.
[17]徐良雄, 冯娜, 薛璟花, 等. 绿僵菌SC0924酚酸类代谢产物及其抗荔枝霜疫霉活性[J]. 热带亚热带植物学报, 2008, 16(2):140-143.
[18]徐良雄, 冯娜, 薛璟花, 等. 绿僵菌SC0924含氮杂环类代谢产物及其抗荔枝霜疫霉活性[J]. 热带亚热带植物学报, 2010, 18(1):93-96.
[19]Defaria M R, Wraight S P. Mycoinsecticides and mycoacaricides:A comprehensive list with worldwide coverage and international classification of formulation types[J]. Biological Control, 2007, 43:237-256.
[20]詹儒林, 许天委, 黄俊生. 紫外光的照射与绿僵菌对多菌灵敏感性变化的关系[J]. 热带作物学报, 2006, 27(4):91-94.
[21]蒲蛰龙, 李增智. 昆虫真菌学[M]. 合肥:安徽科学技术出版社, 1996:554.
[22]方中达. 植病研究方法[M]. 北京:农业出版社, 1998.
[23]齐永霞, 陈方新, 李增智. 白僵菌抗多菌灵突变株的诱变及生物学特性研究[J]. 核农学报, 2012, 26(1):68-72.
[24]冯明光. 生物杀虫剂与新的农业科技革命[M]∥植物保护21世纪展望. 北京:中国科技出版社, 1998:21-24.
[25]Shah F A, Ansari M A, Watkins J, et al. Influence of commercial fungicides on the germination, growth and virulence of four species of entomopathogenic fungi[J]. Biocontrol Science and Technology, 2009, 8(7):743-753.
[26]Bruck D J. Impact of fungicides onMetarhiziumanisopliaein the rhizosphere, bulk soil andinvitro[J]. BioControl, 2009, 54:597-606.
[27]Samson P R, Milner R J, Sander E D, et al. Effect of fungicides and insecticides applied during planting of sugarcane on viability ofMetarhiziumanisopliaeand its efficacy against white grubs[J]. BioControl, 2005, 50:151-163.
[28]张英财, 农向群, 张泽华, 等. 18种化学农药与绿僵菌相容性研究[J]. 中国生物防治学报, 2012, 28(2):186-191.
[29]徐金柱, 秦长生, 李增智, 等. 六种化学杀菌剂对Ma83菌株孢子萌发的影响[J]. 中国森林病虫, 2006, 25(1):4-6.
Studiesoninductionandinhibitoryeffectsofcarbendazim-resistantmutantsofMetarhiziumanisopliae
Qi Yongxia, Chen Fangxin, Ding Ting
(CollegeofPlantProtection,AnhuiAgriculturalUniversity,Hefei230036,China)
The sensitivities ofMetarhiziumanisopliaeto carbendazim were determined by mycelia growth rate methodinvitro. The results showed that among the tested strains ofM.anisopliae, Ma55 was the most sensitive strain to carbendazim. The resistant levels of the carbendazim-resistant strains ofM.anisopliaewhich induced by conidia were determined. The results showed that the resistant level of MC-2 was the highest among the carbendazim-resistant strains. The value of EC50and the resistant level were 397.064 3 μg/mL and 102.35, respectively. The mycelia growth rate, conidia generation and inhibition effects onFusariumoxysporumf. sp.vasinfectumandF.moniliformeof the carbendazim-resistant strains were also studied. The results showed that the mycelium growth rate of each carbendazim-resistant strain was smaller than Ma55 strain(the parent strain), while the ability of conidia generation was stronger than that of Ma55. Among the carbendazim-resistant strains, the conidia generated by MC-2 strain were the most, MC-5 strain followed, and MC-8 strain was the last. The inhibitory effects of the carbendazim-resistant strains against the testedF.oxysporumf. sp.vasinfectumandF.moniliformewere significant by dual-cultured, and the inhibitory effects of MC-2 was the largest.
Metarhiziumanisopliae; carbendazim; resistance level; mycelia growth rate; sporulation
2013-12-02
:2014-04-01
安徽农业大学稳定和引进人才科研资助项目(2011);国家自然科学基金(11008382);安徽农业大学青年基金(2011-31)
S 476.12
:ADOI:10.3969/j.issn.0529-1542.2014.06.017
* 通信作者 E-mail:superpowercfx@163.com

