人源间变性大细胞淋巴瘤BALB/c小鼠建模的免疫学机制
牟东云, 陆 静, 张 燕 ,白雪芹, 邓 飞
(遵义医学院 病理学教研室, 贵州 遵义 563099)
目前肿瘤研究中常用的小鼠模型有自发和诱发肿瘤模型,移植性肿瘤模型和基因工程小鼠模型,其中移植性肿瘤模型应用最广,多采用同种肿瘤移植或免疫缺陷鼠的异种肿瘤移植,而人源肿瘤非免疫缺陷动物模型国内外均未见报道[1-2]。淋巴瘤是起源于淋巴造血系统的恶性肿瘤,与机体免疫微环境之间的关系异常密切,建立具有免疫功能的淋巴瘤动物模型十分必要。本课题组前期试验中[3],选择人源间变性大细胞淋巴瘤(anaplastic large cell lymphoma ,ALCL)细胞株Karpas-299为肿瘤来源,选择在免疫学领域广泛应用的具有正常免疫功能的近交系BALB/c小鼠为实验对象,通过环磷酰胺(Cytoxan,CTX)预处理,成功建立人源ALCL BALB/c小鼠模型。此次试验,我们在建立人源ALCL BALB/c小鼠肿瘤模型的基础上,进一步对其成瘤的免疫机制进行研究。
1 材料与方法
1.1 细胞和动物 人ALCL细胞株Karpas-299(4-5代)购自ACC-DSME公司。BALB/c小鼠40只,雌性,4~6周龄,体质量18g左右,购自北京华阜康生物科技有限公司,在恒温、恒湿、无特定病原体(SPF)环境中饲养。
1.2 主要试剂及仪器 环磷酰胺购自修正药业集团股份有限公司;抗人CD20、CD30、ALK、CD45RO单克隆抗体购自北京中杉公司;抗鼠CD3、CD4、CD8、CD19、CD20荧光抗体及相应同型对照购自eBiosciense公司;流式细胞仪及其配套的计算机软件数据处理系统为BD公司。
1.3 实验方法
1.3.1 肿瘤细胞的培养 Karpas-299细胞用含10%的胎牛血清的培养基培养于37 ℃ CO2培养箱中。
1.3.2 肿瘤模型建立 BALB/c小鼠40只,随机分为CTX对照组10只,肿瘤组30只,以250 mg/kg剂量的CTX腹腔注射预处理,3 d后,肿瘤组小鼠右腋下皮下注射Karpas-299细胞0.5 mL(1×107/mL),隔3d注射一次,共3次;CTX对照组同期注射等量生理盐水。每天定时观察,肿瘤组视成瘤情况分为成瘤组和未成瘤组,第24天(以注射CTX的时间计算)采血后脱颈处死成瘤组小鼠,取肿瘤行病理检查;未成瘤组采血后继续喂养。
1.3.3 肿瘤模型的鉴定 结合肿瘤组织HE染色形态学特点及免疫组化(immunohistochemical,IHC)表达情况综合诊断ALCL。免疫组化染色阳性判定:CD20胞膜或胞浆着色、CD30胞浆和胞膜着色、ALK胞浆和或胞核着色、CD45RO胞膜着色。
1.3.4 免疫指标检测方法 采用小鼠眼内眦静脉取血法或摘眼球取血法收集各BALB/c小鼠外周血,运用流式细胞术(直接免疫荧光染色法)检测其T、B淋巴细胞亚群的比例。

2 结果
2.1 BALB/c小鼠成瘤情况 CTX对照组注射CTX后精神萎靡,毛发蓬松,饮食量下降,两周后活动及饮食恢复至注射CTX前。肿瘤组BALB/c小鼠注射肿瘤后5d开始扪及包块,随着肿瘤增大,出现右上肢活动受限,肿瘤中心开始溃烂坏死。未成瘤小鼠注射部位见脱毛溃烂后逐渐痊愈,或见肿胀的包块又逐渐消失,至第24天,24只BALB/c小鼠成瘤(即成瘤组),6只未成瘤(即未成瘤组),成瘤率80%。成瘤组肿瘤组织镜下表现为细胞大或中等大小、胞浆丰富、核仁浅染、核分裂像常见,免疫组化瘤细胞表达ALK、CD30,不表达CD20及CD45RO,符合ALCL的组织学和免疫表型诊断标准(见图1)。未成瘤组小鼠均无瘤存活3个月后处死。
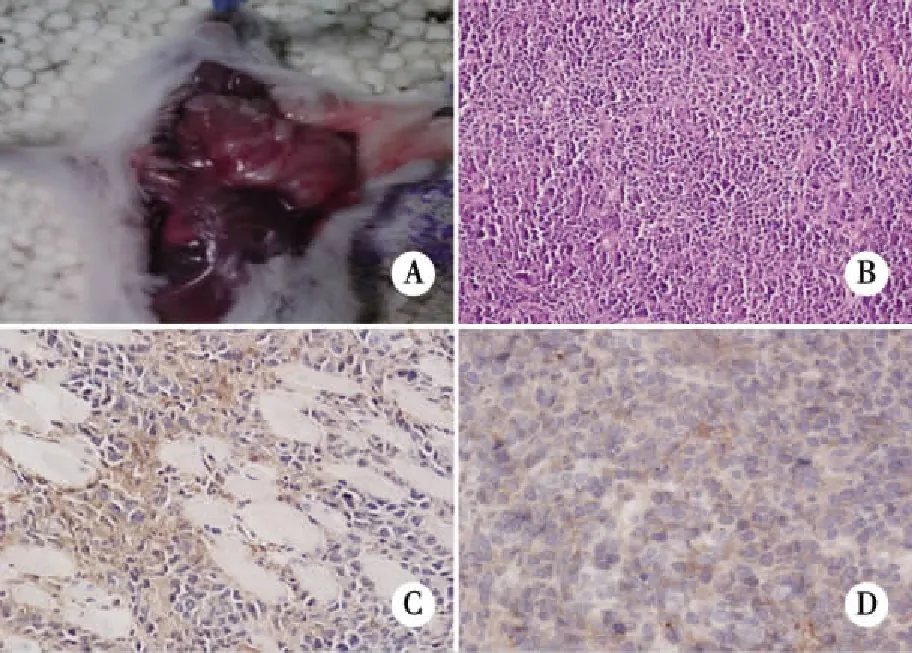
A:肿瘤大体解剖;B:HE×200倍;C:IHC ×400倍CD30+;D:IHC ×400倍ALK+。图1 BALB/c小鼠肿瘤组织
2.2 流式细胞术检测各组BALB/c小鼠外周血T、B淋巴细胞亚群比例 第24天,收集各组小鼠外周血行流式细胞术检测其T、B淋巴细胞亚群比例。结果显示:成瘤组与CTX对照组相比,CD3+、CD8+、CD19+细胞比例明显降低(P<0.05);未成瘤组与CTX对照组相比,CD8+、CD19+细胞比例降低,CD20+细胞比例升高(P<0.05);未成瘤组与成瘤组相比,CD3+、CD4+、CD8+、CD20+细胞比例更高(P<0.05)。由此可见,成瘤组CD3+、CD8+细胞比例下降与CTX对照组和未成瘤组相比均有意义(P<0.05),未成瘤组CD20+细胞比例升高与CTX对照组和成瘤组相比均有意义(P<0.05)(见表1)。


组别CD3(%)CD4(%)CD8(%)CD19(%)CD20(%)CTX组25.94±1.0716.36±3.733.97±0.899.21±0.211.83±0.21成瘤组3.83±2.12*2.03±0.920.41±0.23*1.24±1.21*5.27±1.71未成瘤组37.10±21.31&29.42±19.45&1.95±0.48*&0.49±0.18*33.12±15.07*&F16.71110.72853.6250.88019.351P0.0010.0070.0000.0000.001
*P<0.05,与CTX组比较 ;&P<0.05,与成瘤组比较。
2.3 连续监测CTX对BALB/c小鼠外周血T、B淋巴细胞亚群的影响 为了探讨CTX所致免疫变化对肿瘤的生长有何影响,本实验连续检测了注射CTX后BALB/c小鼠的免疫变化。CTX对照组第3天,BALB/c小鼠CD3+细胞比例高于注射CTX前(P<0.05),CD19+细胞比例低于注射CTX前(P<0.05);第10天,所测所有免疫参数值均低于注射CTX前,其中CD8+、CD19+、CD20+细胞比例下降有统计意义(P<0.05);第17天和第24天,CD8+、CD19+和CD20+细胞比例仍低于注射CTX前(P<0.05),但较第10天有逐渐回升趋势(P>0.05)(见表2、图2)。


时间(d)CD3(%)CD4(%)CD8(%)CD19(%)CD20(%)CTX之前32.59±12.3612.72±6.6010.84±2.6826.17±5.305.92±2.40CTX 366.47±14.75*31.46±15.899.74±0.792.16±1.27*9.85±2.28CTX 1014.19±1.633.74±0.281.26±0.78*5.51±0.70*2.92±0.03*CTX 1720.94±0.3717.76±0.596.14±0.28*9.03±0.13*2.66±0.85*CTX 2425.94±1.0716.36±3.733.97±0.89*9.21±0.21*1.83±0.21*F10.3742.98316.23429.2028.680P0.0050.0990.0010.0000.008
*P<0.05,与注射CTX之前比较。

图2 注射CTX后BALB/c小鼠外周血T、B淋巴细胞亚群的变化趋势
3 讨论
淋巴瘤是起源于淋巴造血系统的恶性肿瘤,与人体免疫系统之间的关系异常密切,建立具有免疫功能的淋巴瘤动物模型将更真实的模拟淋巴瘤发生发展的自然过程。实验证据表明BALB/c小鼠的异种移植由于机体强烈的免疫排斥不会成瘤[4],CTX是造血干细胞移植预处理的经典用药,是造血干细胞移植预处理的经典用药,具有明显的免疫抑制作用[5],因此,本实验在建模前对BALB/c小鼠进行了CTX预处理。通过对CTX对照组外周
血T、B淋巴细胞亚群检测发现,肿瘤接种后的第一周,机体经历了严重的免疫抑制过程,这一周正好是成瘤的关键时期,其成瘤机制与CTX所致机体免疫抑制不无关系。有报道称大剂量CTX可诱导动物机体免疫耐受性,使其对多种特异性抗原在一段时间内无应答反应[6]。CTX对照组第17天和第24天的数据显示CTX所致的机体免疫抑制开始恢复,但成瘤组肿瘤依然生长迅速,说明恢复的免疫对肿瘤的生长已不能发挥关键作用,肿瘤诱导BALB/c小鼠免疫耐受或已形成。
T细胞免疫被认为在抗肿瘤免疫中居中心地位[7]。一项实验数据[8]表明恶性淋巴瘤患者CD3+、CD4+T 细胞比值较对照组下降,CD8+T 细胞较对照组升高。而本实验数据显示,成瘤组除CD20+B细胞轻度升高外,其余免疫指标全部下降,尤其是CD3+、CD8+细胞比例下降明显,这可能和ALCL进展快,所测时间点不同,肿瘤类型不同等有关。Nelson BH[9]的实验认为反应性的B细胞(CD20+B细胞)可能是肿瘤浸润CD8+T细胞产生长久,强效抗肿瘤免疫反应的重要条件。本实验未成瘤组CD20+细胞比例升高,CD20+B细胞在抗肿瘤免疫方面或许发挥着重要作用。
本次试验仅检测了ALCL模型成瘤过程中特异性免疫细胞的总体变化,认为ALCL成瘤过程与机体免疫抑制有关,并可能诱导机体产生肿瘤免疫耐受,ALCL迅速增殖可能与CD3+、CD8+细胞明显减少有关。改善ALCL免疫抑制微环境,打破ALCL免疫耐受,提升CD8+细胞数或可成为ALCL免疫治疗研究的方向。
[参考文献]
[1] 王硕,苏杭,袁经权,等. 实验小鼠在癌症研究中的应用及其进展[J]. 中国比较医学杂志,2011,21(9):63-67.
[2] Ruggeri B A, Camp F,Miknyoczki S. Animal models of disease: pre-clinical animal models of cancer and their applications and utility in drug discovery[J]. Biochem Pharmacol, 2014,87(1):150-161.
[3] 白雪芹. 间变性大细胞淋巴瘤BALB/c小鼠肿瘤模型的建立和鉴定[D]. 遵义:遵义医学院, 2013.
[4] 张志培,赵佐庆,张盈华,等. 免疫缺陷小鼠肿瘤模型的建立及其肿瘤相关免疫机制的探讨[J]. 世界华人消化杂志,2002,10(4):376-380.
[5] 王聪,王一腾,魏鑫. 环磷酰胺的临床应用现状[J]. 临床和实验医学杂志,2008,7(8):179.
[6] 王瑜,田晶,李科,等. 免疫抑制小鼠肾包膜下胃癌移植瘤模型的建立及微血管观察[J]. 第四军医大学学报,2004,25(6):571-573.
[7] 孙君重, 肖文华, 于力, 等. CD4+T淋巴细胞功能研究新进展[J]. 中国实验血液学杂志, 2010, 18(2): 544-548.
[8] 邹煦, 常炳庆, 黄新春, 等. 恶性淋巴瘤患者外周血 T 淋巴细胞亚群变化的讨论[J]. 癌症进展, 2012, 10(4): 396-398.
[9] Nelson B H. CD20+B cells: the other tumor-infiltrating lymphocytes[J]. J Immunol,2010,185(9):4977-4982.

