瓦勒变性坐骨神经段对大鼠BMSCs向SCs分化的影响*
赵富生, 武 庚, 武 杨, 金秀东, 张际绯, 李月珍△
(1牡丹江医学院, 2牡丹江医学院红旗医院,黑龙江 牡丹江 157011)
外周神经损伤修复和神经残端支配区功能重建一直是临床面对的难题。周围神经损伤后其远端神经纤维全长及近端长度不等的髓鞘和轴突发生瓦勒变性,随后,施万细胞(Schwanns cells, SCs) 呈现幼稚化而重新获得分裂增殖能力,参与清除轴突溃变碎片,并在基底膜管内形成Bunger带,形成新的髓鞘。此外,SCs 还分泌神经生长因子(neural growth factor, NGF) 等多种活性物质,引导轴突再生,促进神经功能的恢复[1-2]。研究表明,分离培养瓦勒变性大鼠坐骨神经的SCs并原位移植于半横切脊髓中,SCs在损伤局部可形成细胞桥接区,引导轴突再生,促进脊髓功能恢复[3-4]。但自体SCs来源有限,异体SCs移植存在免疫排斥反应,限制了SCs的临床应用。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是一类具有多向分化潜能的成体干细胞,具有很强的自我更新能力。在体外不同细胞因子或特定环境诱导下,BMSCs可分化为骨细胞、软骨细胞、脂肪细胞、肌腱细胞、肌肉细胞、神经细胞和星形胶质细胞等多种细胞[5-6]。外周神经瓦勒变性后可分泌多种生长因子,其活性可持续2~3周,能否为BMSCs体外分化提供适宜的神经微环境目前尚不清楚。为此,本实验将瓦勒变性坐骨神经段与大鼠 BMSCs联合培养,探讨变性坐骨神经段所形成的体外微环境与诱导BMSCs向SCs分化的关系,为临床应用BMSCs治疗外周神经损伤提供理论依据。
材 料 与 方 法
1 动物和材料
SPF级1月龄SD大鼠50只,雌雄不限,体重90~120 g,由哈尔滨医科大学实验动物中心提供[合格证号为SCXK(黑)2012-010]。
胰蛋白酶、H-DMEM、FBS(Gibco);BMSCs 培养液(广州赛业生物科技有限公司);CD29、CD44和CD90 兔抗大鼠单克隆抗体(Prarmingen);兔抗大鼠S-100多克隆抗体(上海麦莎生物有限公司);PKH26 细胞连接试剂盒、DAPI(Sigma);ELISA 试剂盒(Uscnlife);FITC标记的山羊抗兔 IgG(北京中杉金桥生物技术有限公司);TaKaRa One Step SYB® PrimeScript® RT-PCR Kit ( Perfect Real Time)试剂盒(大连宝生物工程有限公司);Transwell(聚碳酸酯膜,孔径 3.0 μm,Corning)。
2 方法
2.1BMSCs 的培养及鉴定 取体重为(100±5)g的SD大鼠乙醚吸入麻醉后脱颈处死,置75%乙醇中浸泡约5 min,无菌条件下分离出股骨和胫骨,在无血清DMEM培养液中,除净长骨表面软组织。乙醇浸泡l min后,用无血清DMEM培养液洗去乙醇。剪除两端骨密质暴露骨髓腔,用10 mL BMSCs 培养液冲洗骨髓腔,收集骨髓冲洗液,200 目无菌筛网过滤,以1×109/L细胞密度接种于50 mL培养瓶中,在5% CO2、饱和湿度、37 ℃培养箱中进行原代培养,3 d后更换新鲜培养液,去除未贴壁细胞。以后每隔3 d换液,并观察细胞生长情况。待原代培养细胞铺满整个培养瓶底面积的80%时,用0.25%胰酶-0.02%EDTA消化贴壁细胞,按l∶2比例进行传代培养,记作第1代(P1),选取生长均一的第3代(P3)BMSCs进行后续实验。取P3 BMSCs行免疫荧光染色检测 CD29、CD44和CD90 表达。
2.2瓦勒变性坐骨神经段制备及实验分组 取40只SD大鼠,戊巴比妥钠(40 mg/kg)腹腔注射麻醉,无菌条件下暴露左侧坐骨神经,于坐骨切迹远侧5 mm处切断坐骨神经,以5/0 尼龙线结扎两断端,并将近端神经断端埋植于股二头肌中,防止两断端粘连,然后逐层缝合肌肉,浅筋膜和皮肤,肌注青霉素1×104U,连续3 d。术后第7天,重新暴露大鼠术侧坐骨神经和对侧正常坐骨神经,分别切取10 mm近端变性坐骨神经和10 mm对侧正常坐骨神经,体式显微镜下剥离神经外膜,剪成1 mm小段,在Transwell双层培养体系内与BMSCs 进行双层联合培养。实验分为3组:将瓦勒变性坐骨神经段与BMSCs在Transwell 内进行双层联合培养(A组)——收集P3 BMSCs进行PKH26 标记,用10%FBS-BMSCs培养液调细胞浓度为1×107cells/L,取2 mL加入下室,补10%FBS-BMSCs培养液至2.5 mL,将瓦勒变性坐骨神经段置Transwell上层,加1 mL 10% FBS-BMSCs培养液,37 ℃、5% CO2孵育箱中培养; 将正常坐骨神经段与BMSCs在Transwell 内联合培养,方法同上(B组);BMSCs单独培养,培养基为10% FBS-BMSCs培养液(C组)。
2.3BMSCs 总RNA提取 联合培养第0、1、4、7、11、14天,取各组BMSCs,加Trizol液1 mL/well,吹打后收集到无RNA酶的EP管中,振荡室温放置5 min;加0.2 mL氯仿,剧烈振荡15 s,室温放置5 min,4 ℃、12 000 r/min离心15 min;吸取上清,置于新的无RNA酶的EP 管,加等体积异丙醇,涡旋混匀,室温放置10 min,4 ℃、12 000 r/min 离10 min;留沉淀,加1 mL 75% 乙醇,颠倒数次,4 ℃、7 500 r/min 离心5 min;去上清,快速离心后吸干乙醇,室温下敞盖放置3 min,加20 μL DEPC水溶解,检测RNA的 浓度、纯度和质量。
2.4BMSCs形态学观察 倒置相差显微镜下观察联合培养后各组 BMSCs 形态变化。联合培养第7天,用免疫荧光染色鉴定BMSCs分化。取各组BMSCs,PBS 洗涤3次,每次5 min;4% 多聚甲醛固定30 min,PBS 洗涤3次,每次5 min;加1% Triton X-100,37 ℃孵育10 min,PBS洗涤3次,每次5 min;山羊血清封闭60 min;加兔抗大鼠S-100(1∶200)多克隆抗体 4 ℃过夜,PBS 洗涤3次,每次5 min;加 FITC标记的山羊抗兔IgG,37 ℃孵育60 min,PBS洗涤3次,每次5 min;DAPI(5 mg/L)核染色,荧光显微镜观察BMSCs分化情况。随机取10个非重叠视野计数阳性细胞,计算阳性表达率。
2.5BMSCs生长曲线的测定 联合培养第0、1、4、7、11、14天,取各组BMSCs,去除培养液,PBS 洗涤3次,用0.25%胰蛋白酶消化后制成单细胞悬液,以细胞计数板进行细胞计数,计算平均值,以细胞数为纵坐标,时间为横坐标绘制BMSCs生长曲线。
2.6ELISA 法检测NGF的含量 联合培养第0、1、4、7、11、14天,分别收集各组6个培养孔中培养液1 mL 装于EP 管中,1 000 r/min 离心5 min,取上清液装于另一EP 管中,置-20 ℃冰箱保存。按照 ELISA试剂盒操作步骤,检测培养液上清中NGF含量。
2.7S-100 mRNA表达的检测 按照One Step SYBR PrimeScript® RT-PCR Kit (Perfect Real Time)试剂盒说明程序检测联合培养第0、1、4、7、11、14 d各组BMSCs S-100 mRNA表达。Real-time RT-PCR反应体系为50 μL:包括2×One Step SYBR® RT-PCR Buffer Ⅲ 25 μL,TaKaRa ExTaq® HS 1 μL,PrimeScript® RT Enzyme Mix Ⅱ 1 μL,上游引物1 μL,下游引物1 μL,ROX Reference DyeⅡ 1 μL,RNA 4 μL,ddH2O 16 μL,每个样品设置3个复孔。反应条件:42 ℃ 5 min,95 ℃ 10 s,1个循环;95 ℃ 5 s,60 ℃ 30 s,40个循环,于7500 Fast Real-Time PCR 仪上进行基因扩增,扩增完毕后进行熔解曲线分析。基因表达变化倍数采用2-ΔΔCt法进行比较,管家基因β-actin作为内参照。引物设计和合成利用Premier 5.0软件设计,由生工生物工程(上海)股份有限公司合成。引物序列如下:S-100上游引物为5’-GTCCACACCCAGTCCTCTCTGGAG-3’,下游引物为5’-CCGGAGGCTCCTGGTCACCTTTTG-3’;β-actin上游引物为5’-GAGAGGGAAATCGTGCGTGAC-3’,下游引物为5’-TGTTGGCATAGAGGTCTTTACGG-3’。
3 统计学处理
采用SPSS 13.0 统计软件处理,组间比较运用单因素方差分析,数据以均数±标准差(mean±SD)表示。以P<0.05为差异有统计学意义。
结 果
1 BMSCs培养及鉴定
BMSCs原代培养第3天,细胞呈不规则形或多角形,贴壁生长;培养第7天,BMSCs 数量显著增多,细胞呈长梭形均匀分布。传代后BMSCs 生长更加迅速,细胞体积较原代大,形态趋于一致,呈束状或漩涡状排列。免疫荧光鉴定BMSCs呈CD44、CD29和CD90 表达阳性,见图1。

Figure 1. Identification of rat BMSCs by immunofluorescence staining (×200).
2 BMSCs与坐骨神经段联合培养的相关检测
2.1BMSCs的形态学观察 联合培养第1天,各组BMSCs大部分贴壁,呈梭形或多角形。联合培养第3 d,A组部分BMSCs形态开始变化,原宽大的BMSCs变小变圆。联合培养第7天,A 组大部分BMSCs 胞体回缩,呈圆形或锥形,两端伸出突起,形态类似SCs细胞。B、C组仅有小部分BMSCs形态发生类似改变,这表明瓦勒变性坐骨神经段可有效促进BMSCs向SCs样细胞分化,见图2。
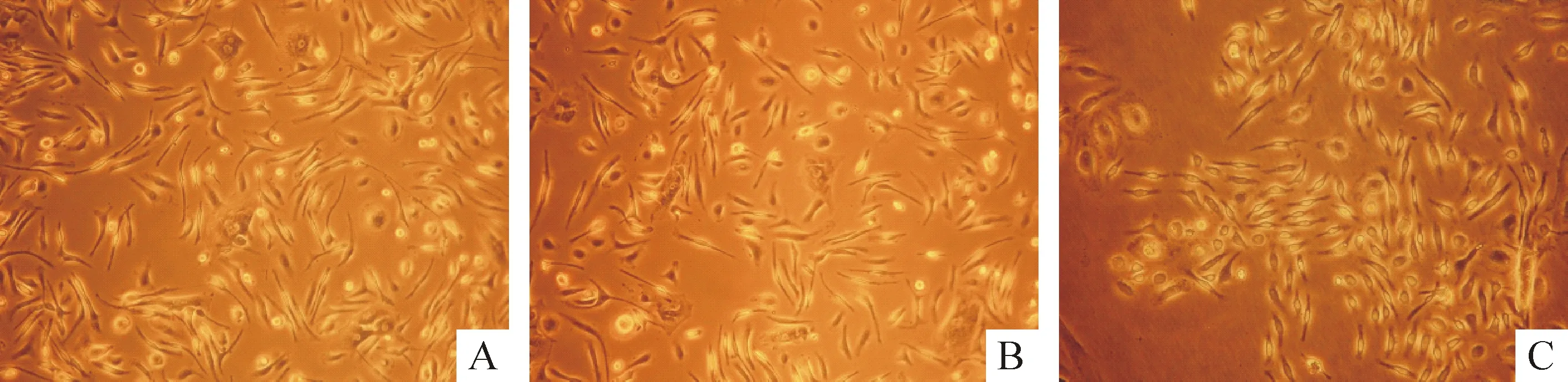
Figure 2. Morphological observation of BMSCs in each group at 7 d after co-culture (×100).A: group A;B: group B;C: group C.
2.2BMSCs的分化鉴定 联合培养第7天,荧光显微镜下可见,A 组大部分BMSCs呈绿色荧光,细胞呈双极形、多极形或锥形,形态类似SCs细胞;PKH26 标记的BMSCs均呈红色荧光,S-100 表达阳性的BMSCs 呈红色、绿色叠加的桔色荧光。B组少部分BMSCs 呈红色、绿色叠加的桔色荧光,C组极少数BMSCs 呈红色、绿色叠加的桔色荧光,见图3。A 组BMSCs 的S-100阳性表达率为31.1%±2.9%,B组和C组BMSCs 的S-100阳性表达率分别为16.2%±1.7% 和0.42%±0.07%,组间比较差异均有统计学意义(P<0.05)。该结果表明,来源于瓦勒变性坐骨神经的神经段能有效诱导BMSCs表达SCs标记蛋白S-100。

Figure 3. Differentiation of BMSCs detected by immunofluorescence staining at 7 d after co-culture (×100). A: group A; B: group B; C: group C.
2.3BMSCs的生长曲线 各组BMSCs生长曲线均近似“S”形,见图4。联合培养第0、1、2、3天各组BMSCs生长缓慢,第6~9天进入对数生长期,第11天达到最高峰,此后各组细胞增殖变缓,进入平台期。A组BMSCs增殖速度明显快于B、C组,B组BMSCs增殖速度快于C组,组间比较差异均有统计学意义(P<0.05),由此可见瓦勒变性坐骨神经段明显促进BMSCs增殖。
2.4NGF含量的检测 ELISA 法检测发现,A组培养液上清中NGF含量于联合培养后逐渐增多,呈时间依赖性,于联合培养第7天达高峰,随后呈下降趋势。B、C 组NGF含量随时间延长有所增加,但显著低于A组。联合培养第4、7、11、14天,A 组NGF含量明显高于B、C 组,同时,B组高于C组,各组间比较差异均有统计学意义(P<0.05),见表1。
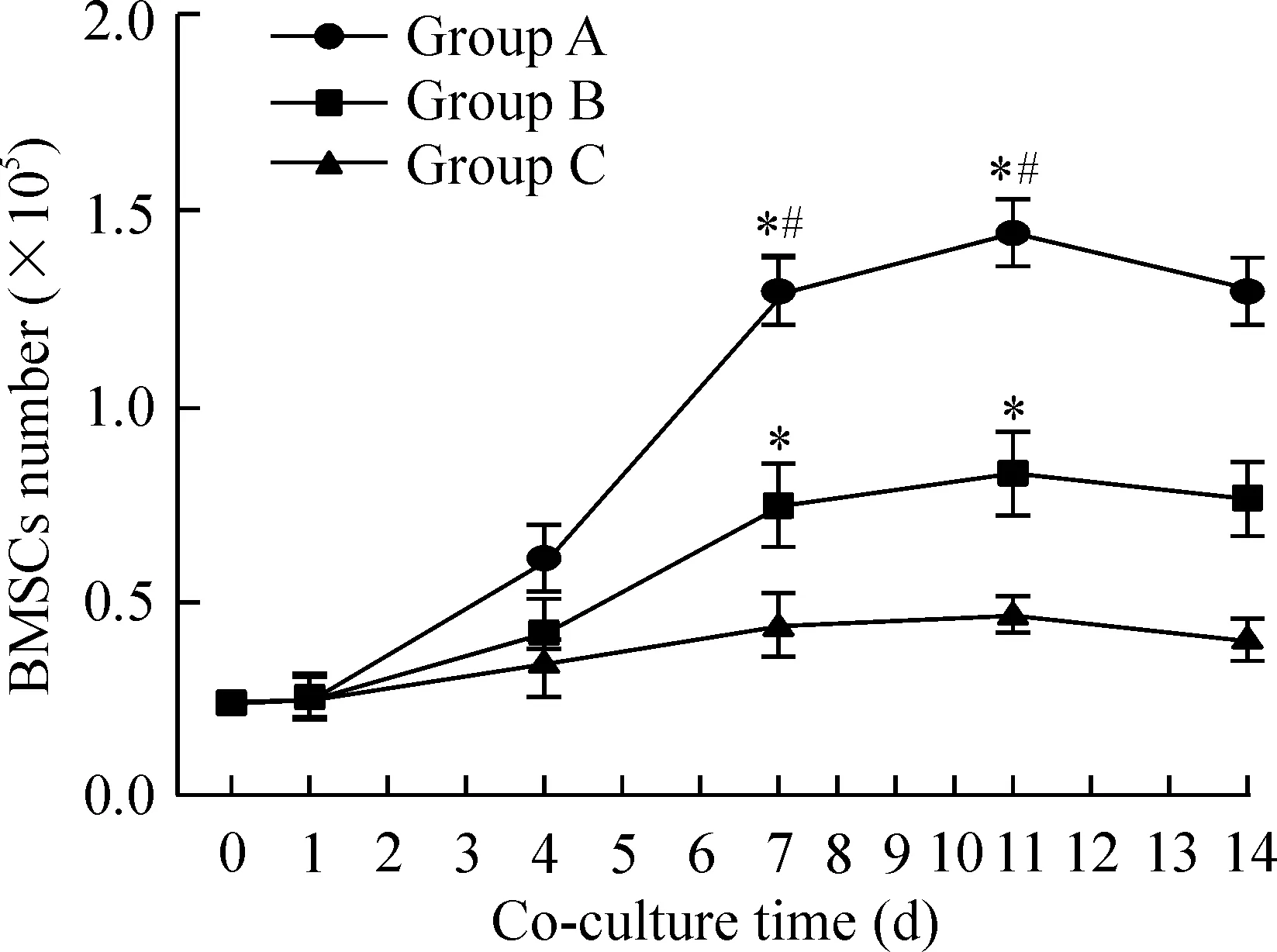
Figure 4. Growth curve of BMSCs in each group at different time points after co-culture. Mean±SD. n=3. *P<0.05 vs group C; #P<0.05 vs group B.

表1 联合培养不同时点各组养液上清的NGF含量
2.5S-100 mRNA表达的检测 联合培养第0、1天,各组BMSCs中S-100 mRNA表达无明显差异;联合培养第4、7、11、14天,A组 BMSCs 中S-100 mRNA表达显著高于B、C组,B组亦高于C组,各组间比较差异均有统计学意义(P<0.05),见图5。这表明瓦勒变性坐骨神经段在较短的时间内即可刺激BMSCs中S-100 mRNA表达增加。
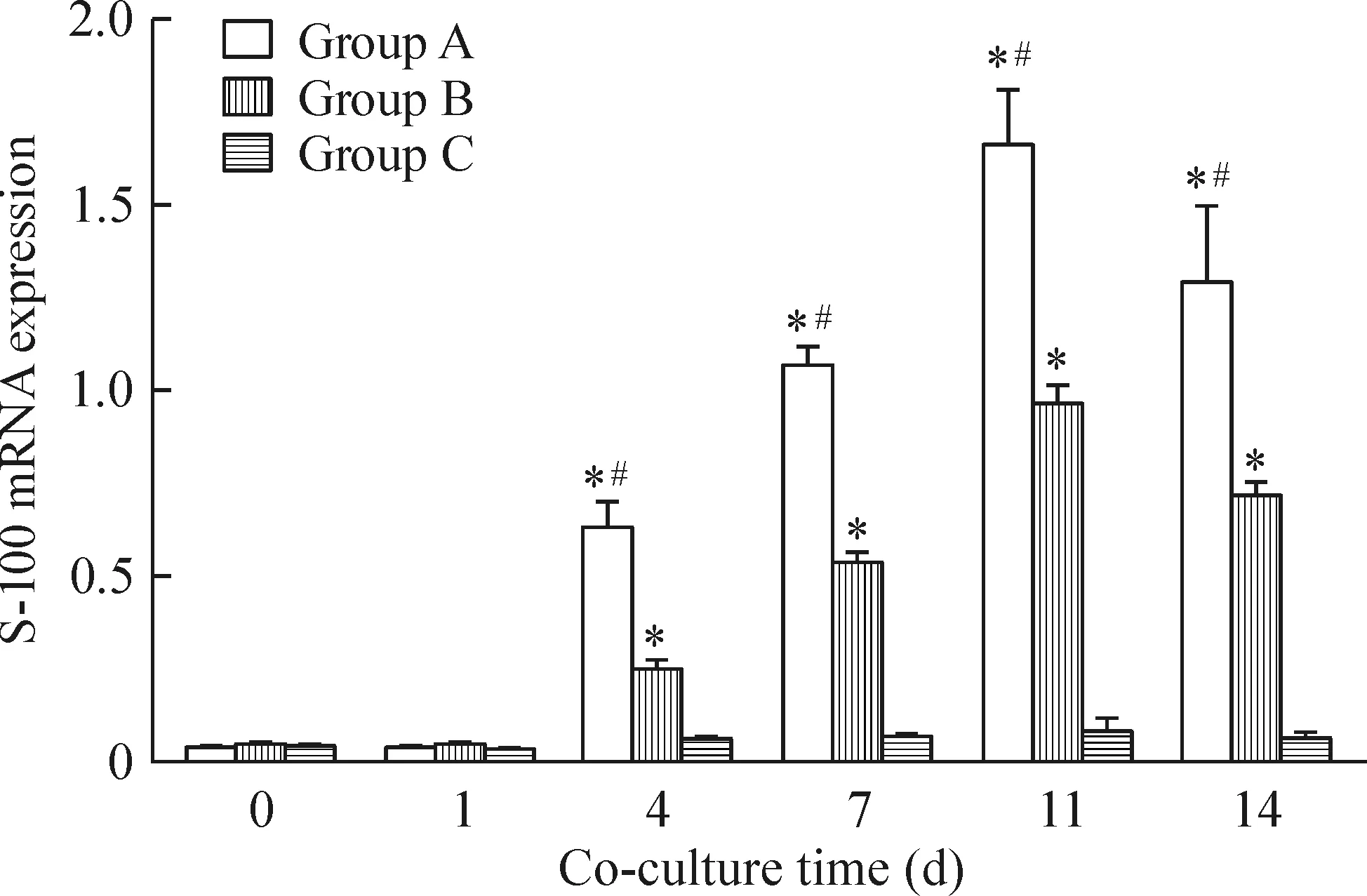
Figure 5. S-100 mRNA expression of BMSCs at different time points after co-culture. Mean±SD. n=3. *P<0.05 vs group C; #P<0.05 vs group B.
讨 论
1850年,Waller[7]最早报道了周围神经损伤后,损伤远端的神经纤维全长及近端长度不等的髓鞘和轴突崩解破坏,即瓦勒变性。瓦勒变性过程中,SCs 呈现幼稚化而重新获得分裂增殖能力,参与清除轴突溃变碎片,并在基底膜管内形成Bunger带,形成新的髓鞘;同时SCs 还分泌多种神经生长因子和表面黏附分子引导再生轴突延伸,促进轴突再髓鞘化过程。因此,SCs在神经纤维损伤修复过程中,发挥着极为重要的作用[8-10]。但SCs属于外周神经终末细胞,体外培养增殖速度缓慢,临床中难以获取足量SCs[11]。此外,SCs具有抗原性,异种移植会发生免疫排斥反应,因而极大地限制了SCs的临床应用。为此,本研究设计了瓦勒变性大鼠坐骨神经段与BMSCs共培养体系,探讨变性坐骨神经段形成的体外神经微环境能否诱导BMSCs 向SCs分化,并观察在分化过程中BMSCs形态、分泌功能的变化,旨在为临床应用BMSCs治疗外周神经损伤提供实验依据。
BMSCs为一种成体干细胞,具有很强的自我更新及多向分化潜能。研究发现[12-13],BMSCs 在体外不同细胞因子或特定诱导环境作用下可分化为骨细胞、软骨细胞、脂肪细胞、肌腱细胞、肌肉细胞和神经细胞等多种细胞。此外,BMSCs 来源丰富、易于获取、可自体移植,有效避免了排斥反应及伦理争议[14-15],因此近年来BMSCs成为组织工程理想的种子细胞。Babe等[16]研究发现,利用化学复合物(丁羟基茴香醚、氢化可的松、福斯高林、胰岛素、KCl、维甲酸)和细胞因子(EGF、HGF、VEGF)作为刺激因素均可在体外诱导BMSCs向神经元样细胞分化,但分化比例有所不同。夏长所等[17]建立了以富含血小板血浆为基础的诱导BMSCs分化为SCs的培养体系,诱导9~11 d 后,发现BMSCs分化为SCs样细胞。我们前期研究发现,SCs 与BMSCs培养体系中BMSCs在SCs形成的体外微环境诱导作用下可分化为神经元和少突胶质细胞[18]。但该培养体系由于从坐骨神经分离、培养SCs时程较长,需大约3~4周才能获取高纯度SCs,从而导致临床中错过了应用BMSCs治疗外周神经损伤的最佳时机。因此,本研究采用瓦勒变性坐骨神经段与BMSCs联合培养,有效地缩短了获取种子细胞的周期,为临床外周神经损伤的治疗赢得了宝贵时间。该体系将变性坐骨神经段与PKH26标记的BMSCs联合培养于同一双层小室中,坐骨神经段位于小室上层,下层接种BMSCs,中间有微孔网膜相隔,神经段分泌的生物活性物质可以通过网孔作用于BMSCs。Torres等[19]研究发现,取成年大鼠坐骨神经切成长约2 mm的神经段,在199完全培养基中培养1、4、7、14 d后制备坐骨神经条件培养液。用该培养液作用体外培养的大鼠视网膜细胞72 h,可有效促进视网膜细胞的存活、增殖和分化,并增加视网膜细胞的黏附能力。本研究室前期研究结果也表明[3-4],切断大鼠坐骨神经使其在体内预变性,然后通过改变培养液血清浓度和神经段移植的方法,约3周即可从变性坐骨神经段分离培养出高纯度SCs。这些研究表明,瓦勒变性坐骨神经段在体外培养2~3周仍具有活性,可影响BMSCs的分化。PKH26 是一种带有长脂肪族末端的红色荧光染料,可与BMSCs膜上的脂类区域稳定结合,不会从已标记细胞向未标记细胞转移,并且随着细胞分裂,标记物也几乎等份地分配给2个子细胞[20]。因此,可通过标记的红色荧光来确定分化细胞的来源和计算细胞分化率。
为确定BMSCs 在瓦勒变性坐骨神经段的诱导作用下能否分化为SCs,以及BMSCs在分化过程中表达SCs标志物S-100 的情况,本研究通过免疫组化和real-time PCR检测BMSCs在分化过程中S-100蛋白及mRNA的变化情况。S-100是一种由多基因编码的分子量为9~13 kD的钙离子结合蛋白,由S-100A和S-100B亚基组成3种形式:S-100AA、S-100BB和S-100AB,以同源或异源二聚体的形式发挥作用。其中S-100BB以高浓度特异地存在于中枢神经系统的胶质细胞和周围神经系统的SCs以及它们的肿瘤中,常被用作SCs的标志物[21-23]。S-100蛋白参与各种钙离子依赖性的细胞内的调节过程,例如蛋白磷酸化、细胞增殖以及细胞分化等过程[24]。在外周神经系统中,S-100蛋白主要分布在成熟SCs的细胞质内和细胞膜上,对轴突再生具有刺激和诱导作用[25]。本研究结果显示,联合培养过程中BMSCs形态发生明显变化,联合培养第7天,A 组可见大部BMSCs分胞体回缩,两端伸出突起,形态类似SCs,而B组仅有小部分BMSCs 形态发生类似改变,C 组BMSCs 形态几乎没有发生变化。在联合培养第7天,采用免疫荧光双标技术对BMSCs 进行S-100鉴定。结果显示,A 组BMSCs向SCs分化率明显高于B组和C 组。为进一步明确联合培养后不同时点BMSCs分化情况,研究中检测了各组BMSCs中S-100 mRNA表达情况。结果示,A组BMSCs中S-100 mRNA表达水平显著高于B组和C组,与免疫荧光鉴定结果相一致,提示瓦勒变性坐骨神经段形成的体外微环境可持续有效地促进BMSCs向SCs分化。为探讨瓦勒变性坐骨神经段对BMSCs分泌功能的影响,我们选择了NGF作为研究对象,在联合培养不同时点对细胞培养液上清中NGF进行检测。NGF是神经营养因子家族中最早发现的神经生长调节因子,对胚胎发育以及对神经嵴起源的神经元功能的维持具有重要作用[26-27]。作为神经系统中最重要的生物活性物质之一,NGF具有促进神经元分化和迁移、修复受损神经组织细胞、保护轴突和髓鞘炎性损坏的作用[28-30]。有文献报道,NGF mRNA在神经受损后迅速增高,可持续高表达l~2周[31]。外周神经损伤后NGF主要来源于局部增殖的SCs[32]。Yuan等[33]和Yaghoobi等[34]研究发现,BMSCs在诱导分化后可表达一定量的NGF,并参与了BMSCs分化及其表型的维持过程,但NGF分泌量随BMSCs传代次数增加有所降低。本研究室前期研究结果表明,大鼠坐骨神经在未受到损伤情况下,神经段培养液上清中NGF含量很低,提示SCs合成NGF蛋白量很少。然而,在瓦勒变性坐骨神经段培养液中NGF含量明显升高,为正常坐骨神经段的2.0倍,且可持续2~3周。因此,本研究通过检测NGF含量,间接观察瓦勒变性坐骨神经段在BMSCs向SCs分化中的作用。ELISA 检测结果示,A组培养液上清中NGF含量在联合培养后第4天明显高于B、C组。可能由于BMSCs在分化过程中,源于BMSCs的SCs分泌大量NGF,同时也以反馈方式促进BMSCs分裂与增殖,分泌更多NGF,从而导致NGF含量增加。
综上所述,瓦勒变性坐骨神经段形成的体外微环境可有效促进BMSCs向SCs样细胞分化,在分化过程中变性坐骨神经段分泌的多种生物活性物质可能参与调控BMSCs的分化。有研究表明,外周神经瓦勒变性过程中可合成、分泌多种神经营养因子,包括NGF、脑源性神经营养因子、神经营养素、睫状神经营养因子、碱性成纤维细胞生长因子和轴突生长诱导因子等[31,35]。这些因子的受体存在BMSCs 细胞膜上,与其结合后将信号转导至细胞质或细胞核,对BMSCs分化起调节作用[36]。此外,变性坐骨神经段还可产生细胞外基质及细胞外黏附因子[37]。这些蛋白分子也可能介导变性神经段与BMSCs间的相互作用,诱导BMSCs 向SCs分化。但源于BMSCs的SCs样细胞是否具有正常的生理功能尚待进一步深入研究。
[参 考 文 献]
[1] Shimizu S, Kitada M, Ishikawa H, et al. Peripheral nerve regeneration by theinvitrodifferentiated-human bone marrow stromal cells with Schwann cell property[J]. Biochem Biophys Res Commun, 2007, 359(4):915-920.
[2] Perez M, Benitez SU, Cartarozzi LP, et al. Neuroprotection and reduction of glial reaction by cannabidiol treatment after sciatic nerve transection in neonatal rats[J]. Eur J Neurosci, 2013, 38(10):3424-3434.
[3] Zhang J, Zhao F, Wu G, et al. Functional and histological improvement of the injured spinal cord following transplantation of Schwann cells transfected withNRG1 gene[J]. J Anat Rec (Hoboken), 2010, 293(11):1933-1946.
[4] Zhang JF, Zhao FS, Wu G, et al. Therapeutic effect of co-transplantation of neuregulin 1-transfected Schwann cells and bone marrow stromal cells on spinal cord hemisection syndrome[J]. Neurosci Lett, 2011, 497(2):128-133.
[5] Neuhuber B, Gallo G, Howard L, et al. Reevaluation ofinvitrodifferentiation protocols for bone marrow stromal cells: disruption of actin cytoskeleton induces rapid morphological changes and mimics neuronal phenotype[J]. J Neurosci Res, 2004, 77(2):192-204.
[6] Huang J, Zhao L, Xing L, et al. MicroRNA-204 regulates Runx2 protein expression and mesenchymal progenitor cell differentiation[J]. Stem Cell, 2010, 28(2):357-364.
[7] Waller A. Experiments on the section of the glossopharyngeal and hypoglossal nerves of the frog, and observations of the alterations produced thereby in the structure of their primitive fibres[J]. Phil Trans R Soc Lond, 1850, 140:423-429.
[8] Piirsoo M, Kaljas A, Tamm K, et al. Expression of NGF and GDNF family members and their receptors during peripheral nerve development and differentiation of Schwann cellsinvitro[J]. Neurosci Lett, 2010, 469(1):135-140.
[9] Ma Z, Wang J, Song F, et al. Critical period of axoglial signaling between neuregulin-1 and BDNF required for early Schwann cell survival and differentiation[J]. J Neurosci, 2011, 31(26):9630-9640.
[10] Tao HY, He B, Liu SQ, et al. Effect of carboxymethylated chitosan on the biosynthesis of NGF and activation of the Wnt/β-catenin signaling pathway in the proliferation of Schwann cells[J]. Eur J Pharmacol, 2013, 702(1-3):85-92.
[11] Caddick J, Kingham PJ, Gardiner NJ, et al. Phenotypic and functional characteristics of mesenchymal stem cells differentiated along a Schwann cell lineage[J]. Glia, 2006, 54(8):840-849.
[12] Long X, Olszewski M, Huang W, et al. Neural cell differentiationinvitrofrom adult human bone marrow mesenchymal stem cells[J]. Stem Cells Dev, 2005, 14(1):65-69.
[13] 尹素娟,张荣华,朱晓峰,等. rhTGF-β1对SD大鼠MSCs骨向分化的影响及机制研究[J]. 中国病理生理杂志, 2014,30(3):460-466.
[14] Bianco P, Riminucci M, Gronthos S, et al. Bone marrow stromal stem cells: nature, biology, and potential applications[J]. Stem Cell, 2001, 19(3):180-192.
[15] Coyne TM, Marcus AJ, Woodbury D, et al. Marrow stromal cells transplanted to the adult brain are rejected by an inflammatory response and transfer donor labels to host neurons and glia[J]. Stem Cell, 2006, 24(11):2483-2492.
[16] Babe KS, Park JB, Kim HS, et al. Neuron-like differen-tiation of bone marrow-derived mesenchymal stem cells[J]. J Yonsei Med, 2011, 52(3):401-412.
[17] 夏长所, 陈玉华, 孙 康, 等. PRP在BMSCs向SC体外分化中的作用[J].中国修复重建外科杂志, 2009, 23(8):997-1001.
[18] 赵富生,武 庚,武 杨,等. 雪旺细胞对不同年龄大鼠 BMSCs分化的影响[J]. 中国修复重建外科杂志, 2011, 25(2):160-165.
[19] Torres PM, Guilarducci CV, Franco AS, et al. Sciatic conditioned medium increases survival, proliferation and differentiation of retinal cells in culture[J]. Int J Dev Neurosci, 2002, 20(1):11-20.
[20] 穆丽雅, 韩明子, 祁金锋. 门静脉和尾静脉注入小鼠骨髓干细胞向肝脏迁移的比较[J]. 世界华人消化杂志, 2006, 14(14):1408-1411.
[21] Conrad AH, Albrecht M, Pettit-Scott M, et al. Embryonic corneal Schwann cells express some Schwann cell marker mRNAs, but no mature Schwann cell marker proteins [J]. Invest Ophthalmol Vis Sci, 2009,50(9):4173-4184.
[22] Finzsch M, Schreiner S, Kichko T, et al. Sox10 is required for Schwann cell identity and progression beyond the immature Schwann cell stage [J]. J Cell Biol, 2010,189(4):701-712.
[23] Bhatheja K, Field J. Schwann cells: origins and role in axonal maintenance and regeneration [J]. Int J Biochem Cell Biol, 2006,38(12):1995-1999.
[24] Donato R. Functional roles of S100 proteins, calcium-binding proteins of the EF-hand type [J]. Biochim Biophys Acta,1999,1450(3):191-231.
[25] Spreca A, Rambotti MG, Rende M, et al. Immunocytochemical localization of S-100b protein in degenerating and regenerating rat sciatic nerves[J]. J Histochem Cytochem,1989, 37(4):441-446.
[26] Maisonpierre PC, Belluscio L, Friedman B, et al. NT-3, BDNF, and NGF in the developing rat nervous system: parallel as well as reciprocal patterns of expression[J]. Neuron, 1990, 5(4):501-509.
[27] Lindsay RM. Nerve growth factors (NGF, BDNF) enhance axonal regeneration but are not required for survival of adult sensory neurons[J]. J Neurosci, 1988, 8(7):2394-2405.
[28] Colafrancesco V, Villoslada P. Targeting NGF pathway for developing neuroprotective therapies for multiple sclerosis and other neurological diseases[J]. Arch Ital Biol, 2011,149(2):183-192.
[29] Ding J, Cheng Y, Gao S, et al. Effects of nerve growth factor and Noggin-modified bone marrow stromal cells on stroke in rats[J]. J Neurosci Res, 2011, 89(2):222-230.
[30] 毕 涌,洪 娟,林晓滨,等. 人β-NGF基因修饰的骨髓间充质干细胞对帕金森病大鼠行为学的影响[J]. 中国病理生理杂志, 2014, 30(3): 473-478.
[31] Yao D, Li M, Shen D, et al. Expression changes and bioinformatic analysis of Wallerian degeneration after scia-tic nerve injury in rat[J]. Neurosci Bull, 2013, 29(3):321-332.
[32] Shakhbazau A, Kawasoe J, Hoyng SA, et al . Early regenerative effects of NGF-transduced Schwann cells in peripheral nerve repair[J]. Mol Cell Neurosci, 2012, 50(1):103-112.
[33] Yuan J, Huang G, Xiao Z, et al. Overexpression of β-NGF promotes differentiation of bone marrow mesenchymal stem cells into neurons through regulation of AKT and MAPK pathway[J]. Mol Cell Biochem, 2013, 383(1-2):201-211.
[34] Yaghoobi MM, Mahani MT. NGF and BDNF expression drop off in neurally differentiated bone marrow stromal stem cells[J]. Brain Res, 2008, 1203:26-31.
[35] Shakhbazau A, Kawasoe J, Hoyng SA, et al. Early rege-nerative effects of NGF-transduced Schwann cells in peri-pheral nerve repair[J]. Mol Cell Neurosci, 2012, 50(1):103-112.
[36] Terenghi G. Peripheral nerve regeneration and neurotrophic factors[J]. J Anat, 1999, 194(Pt 1):1-14.
[37] Wang DY, Huang YC, Chiang H, et al. Microcontact printing of laminin on oxygen plasma activated substrates for the alignment and growth of Schwann cells[J]. J Biomed Mater Res B Appl Biomater, 2007, 80(2):447-453.

