低温胁迫下椰心叶甲啮小蜂正反向消减cDNA文库的构建及其序列分析
吕宝乾, 万 婕, 李艺琼, 金启安, 彭正强
温海波中国热带农业科学院环境与植物保护研究所; 农业部热带农林有害生物入侵监测与控制重点开放实验室,农业部儋州农业环境科学观测实验站,海南 儋州 571737
椰心叶甲啮小蜂Tetrastichusbrontispae(Ferriere)是入侵害虫椰心叶甲Brontispalongissima(Gestro)的重要蛹寄生蜂,自2004年从中国台湾引入大陆后,在防治椰心叶甲危害上取得了阶段性成果。椰心叶甲发生区所处纬度较低,主要包括海南全省,广东、广西和云南省区的部分地区。这些地区1月份平均气温仍有10 ℃,在冬季,受南下冷空气影响,会有接近0 ℃的短时极端低温天气。因此,椰心叶甲啮小蜂耐低温胁迫能力将决定该寄生蜂是否能在低温环境下建立种群并发挥控害效能。为保护机体免受寒害损伤,昆虫体内会发生一系列的应急性代谢变化。郭东峰(2013)曾对椰心叶甲啮小蜂耐寒性做了相关研究,初步明确其抗寒系统为海藻糖—甘油—脂肪—糖原。为了从分子生物学角度解释椰心叶甲啮小蜂低温胁迫的内在响应机制,本研究利用抑制消减杂交(suppression subtractive hybridization,SSH)技术筛选椰心叶甲啮小蜂耐寒相关基因。
抑制消减杂交技术是一门被广泛应用于细胞分化、发育、衰老等领域,旨在分离不同组织间或个体发育的不同阶段以及因外界因子作用而导致差异表达基因的技术(张锴, 2010),由Diatchenkoetal.(1996)首次提出,该技术操作简便、稳定可靠、灵敏性高,因此在动植物研究中,具有十分广阔的应用前景。郭新红和姜孝成(2001)利用SSH证实了甘露醇处理后的梭梭Halonxylonammodendron(Men.) Bge.幼苗中有3个特异表达或表达增强的基因;Wang & Rowley(1998)利用SSH分离得到水稻OryzasativaL.经硝酸盐胁迫下诱导的基因;王衍海等(2006)采用SSH从日本吸血虫SchistosomajaponicumKatsurada雌虫体内筛选出了6个表达水平明显高于雄虫的基因;梁利群等(2006)采用SSH明确了鲤鱼CyprinuscarpioL.脑组织里13个低温下特异表达的未知基因;季相华(2008)利用SSH分离并鉴定了稻水象甲LissorhoptrusoryzophilusKuschel夏季滞育的相关基因;陈浩等(2012)利用SSH分离和鉴定了梨小食心虫Grapholithamolesta(Busck) 滞育的相关基因等。本试验利用抑制杂交消减技术研究了低温处理(0 ℃下处理24 h)后椰心叶甲啮小蜂体内差异基因的表达情况,分离并获得与椰心叶甲啮小蜂耐寒相关基因,为揭示其耐寒性机理提供重要线索。
1 材料与方法
1.1 材料
1.1.1 供试昆虫 椰心叶甲啮小蜂由中国热带农业科学院环境与植物保护研究所椰心叶甲天敌饲养室提供,以椰心叶甲蛹为寄主进行繁殖,正常饲养条件下(25 ℃,RH=75%±10%,L∶D=12∶12)饲养的试虫为对照组,0 ℃下处理24 h的试虫为处理组。
1.1.2 试验试剂 TRIZOL RNA抽提试剂(INVIROGEN厂),DNTP三磷酸脱氧核苷(大连宝生物工程有限公司),Taq酶(KAPA),TBE缓冲液(华大科技),10×Loading buffer(华大科技),DNA Marker(华大科技),QIAGEN ⅡGel Extraction Kit Qiagen(QIAGEN公司),PMD-18T载体(大连宝生物工程有限公司),SSH试剂盒(CLONTECH公司),其他常规生化试剂均为国产分析纯试剂。
1.2 试验方法
1.2.1 总RNA抽提 按照TRIZOL试剂盒说明书分别提取处理组与对照组试虫总RNA,用NANO DROP分光光度计测浓度并定量后,组建2个总RNA库,将总RNA适当稀释,取1 μL用NANO FROP测浓度并定量。
1.2.2 抑制消减杂交 以处理组作tester,对照组作driver进行正向杂交,富集处理组高表达的转录本;以对照组作tester,处理组作driver进行反向杂交,富集对照组高表达的转录本。按照PCR-SelectTM cDNA Subtration kit说明,分别合成cDNA第一链与双链cDNA并纯化。将所有tester cDNA酶切后分为2份,分别与接头l(Adaptor l)与2R(Adaptor 2R)连接,制成tester cDNA 1和tester cDNA 2,16 ℃过夜处理后,分别与driver cDNA在68 ℃下进行第1次杂交,8 h后,向第1次消减杂交的混合体系中加入过量变性driver进行第2次杂交,68 ℃过夜处理。杂交产物经稀释后取1 μL进行PCR扩增,反应体系除杂交产物外还包括:5 μL H2O,35.5 μL MgCl2(KAPA),5 μL 10×buffer(KAPA),1 μL dNTP(10 mmol/each),1 μL Primer l (up 50 pmol·μL-1),1 μL Primer l (down 50 pmol·μL-1)和0.5 μLTaq(5 U·μL-1),总体积50 μL。将第1次PCR产物稀释后取1 μL,加入与第1次PCR扩增相同的其他反应体系,进行第2次PCR扩增,反应总体积50 μL。
1.2.3 消减cDNA文库的构建及插入片段的初步鉴定 将正反向消减杂交产物利用QIAGEN ⅡGel Extraction Kit Qiagen胶回收试剂盒(QIAGEN公司)分别过柱纯化,与PMD-18T载体连接,完成正反向消减cDNA文库的构建。转化大肠杆菌Escherichiacoli感受态细胞DH5a,涂布在含有90 mm AMP的LB平板中,37 ℃过夜培养。挑选转化了的单菌落,1 mL LB培养基培养过夜,取20 μL菌液离心后作为模板,加入与前2次PCR扩增相同的其他反应体系进行PCR鉴定。
1.2.4 部分EST(expression sequence tag)片段序列分析 随机挑选500个阳性克隆进行测序。所测序列与Genbank(http:∥www.ncbi.nlm.gov)中的序列进行比对,并进行同源性检索和分析。
2 结果与分析
2.1 总RNA的提取、双链cDNA的合成及选择性扩增
高纯度和完整的总RNA是构建cDNA文库的前提条件。本试验中提取的处理组与对照组总RNA电泳结果如图1所示,28S、18S 2条带清晰可见,表明提取的RNA完整性好。处理组与对照组样品的A260 nm/A280 nm分别为1.81和1.88,二者均介于1.8~2.0之间,符合建库要求。
2.2 椰心叶甲啮小蜂cDNA的2次差减杂交和2次抑制性PCR
2次消减杂交后的PCR结果如图2所示。由于第1次PCR扩增条带不明显,故进行第2次PCR检测,第2次PCR产物电泳下产生了连续的条带,且大小片段介于200~700 bp,说明检测子中的差异表达基因得到了有效富集与扩增。
2.3 抑制消减cDNA文库的构建
取110 μL转化菌涂于平板,库1与库2分别得到498与524个白色克隆,克隆饱满清晰。随机选取24个阳性克隆培养,取菌液进行PCR检测。如图3所示,95%以上的阳性克隆cDNA插入片段大小在200~700 bp之间,且都能检测到明显条带。
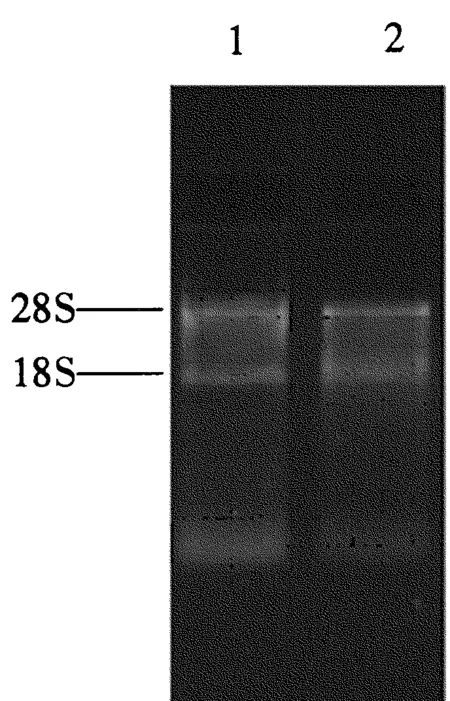
图1 处理组与对照组试虫总RNA检测Fig.1 Total RNA of T.brontispae from control and treatment group 1: 处理组; 2: 对照组。1: Treatment group; 2: Control group.
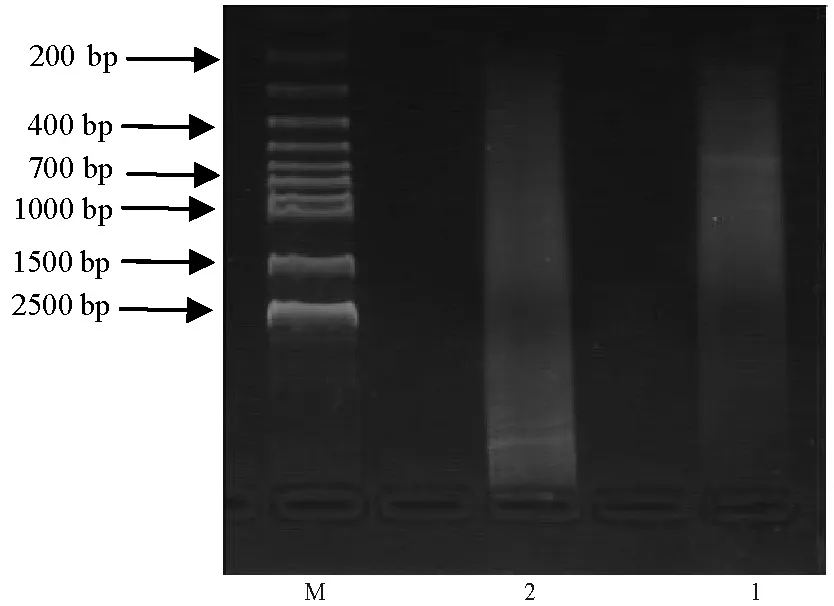
图2 正反文库抑制差减杂后第2次PCR扩增产物电泳图Fig.2 Electrophoresis of products before and after SSHM: DNA marker; 1: 以处理组为tester,对照组为driver,经过SSH过程的PCR产物; 2: 以对照组为driver,处理组为tester,经过SSH过程的PCR产物。M: DNA marker; 1: PCR products using treatment group as tester, control group as driver; 2: PCR products using control group as tester, treatment group as driver.
2.4 EST片段的测序和同源性分析
在PCR鉴定为阳性克隆的正向文库中挑选224个菌落,从反向文库中挑选119个菌落测序,分别获得40与4个高质量ESTs。正向文库检测的序列是在诱导条件下表达量上调的基因,反向文库检测的序列是在诱导条件下表达量下调的基因。将这些ESTs通过Genbank进行序列比对分析(Blastx)。结果表明,与抗寒相关的EST表达不仅涉及不同物种,其中包括植物、动物及微生物(表1),表1主要列举了同源性高达80%以上昆虫种类的功能基因,这些功能基因的来源也很广泛,主要包括新陈代谢、信号传导、转录调控、细胞结构功能、氨基酸和蛋白质的合成、以及某些未知的功能基因,并列出了可能与啮小蜂耐寒机制有关联的候选基因。
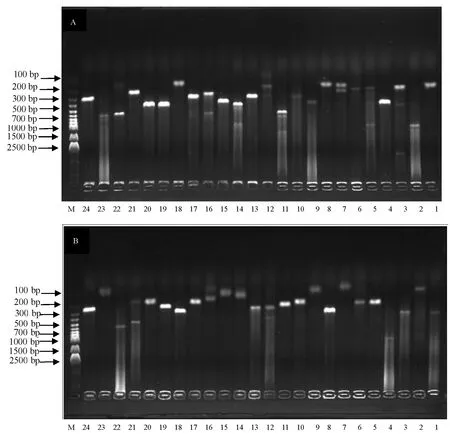
图3 正反文库部分阳性克隆插入片段大小的检测Fig.3 Identification of inserted cDNA fragments from forward and reverse suppression cDNA librariesA: 正向文库; B: 反向文库; M: DNA marker; 1~24: 从正反向文库中随机挑取的24个克隆阳性。A: Forward suppression cDNA library; B: Reverse suppression cDNA library; M: DNA marker; 1~24: The 24 randomly picked clones from the suppression cDNA libraries.
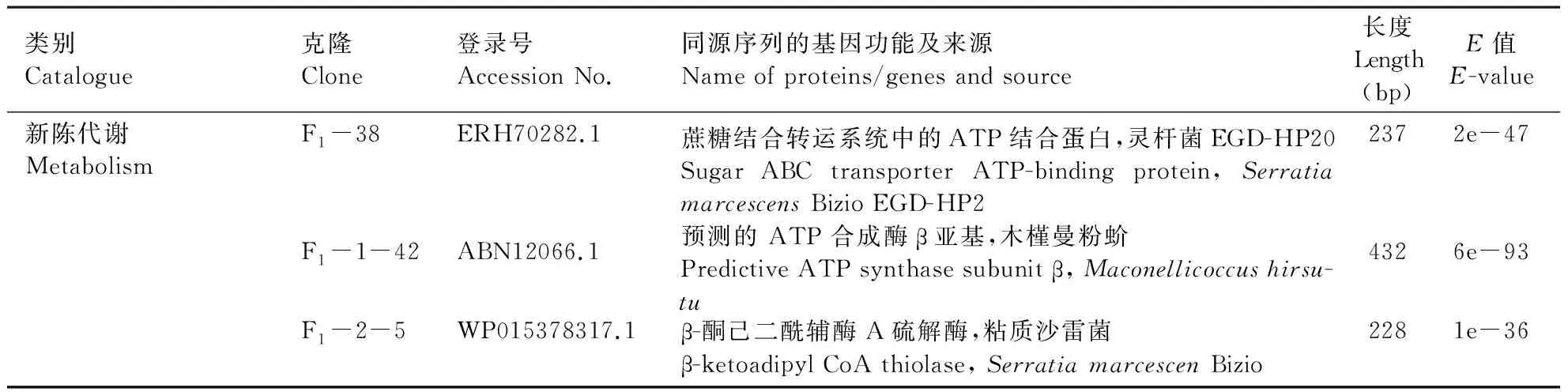
类别Catalogue克隆Clone登录号Accession No.同源序列的基因功能及来源Name of proteins/genes and source长度Length(bp)E值E-value新陈代谢MetabolismF1-38ERH70282.1蔗糖结合转运系统中的ATP结合蛋白,灵杆菌EGD-HP20Sugar ABC transporter ATP-binding protein, Serratia marcescens Bizio EGD-HP22372e-47F1-1-42ABN12066.1预测的 ATP 合成酶β亚基,木槿曼粉蚧Predictive ATP synthase subunit β, Maconellicoccus hirsu-tu4326e-93F1-2-5WP015378317.1β-酮己二酰辅酶A硫解酶,粘质沙雷菌β-ketoadipyl CoA thiolase, Serratia marcescen Bizio2281e-36
续表1
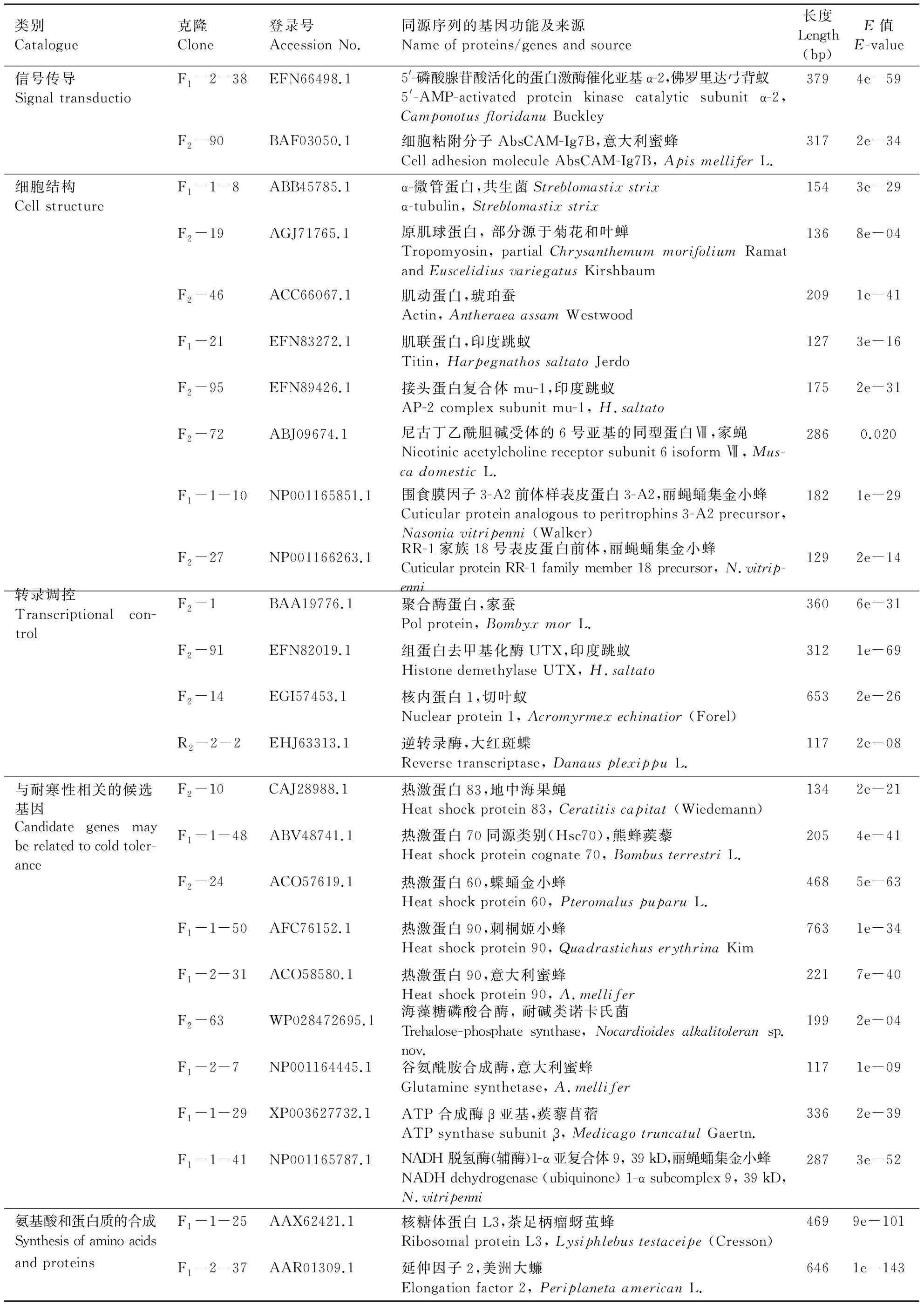
类别Catalogue克隆Clone登录号Accession No.同源序列的基因功能及来源Name of proteins/genes and source长度Length(bp)E值E-value信号传导Signal transductioF1-2-38EFN66498.15'-磷酸腺苷酸活化的蛋白激酶催化亚基α-2 ,佛罗里达弓背蚁5'-AMP-activated protein kinase catalytic subunit α-2, Camponotus floridanu Buckley3794e-59F2-90BAF03050.1细胞粘附分子AbsCAM-Ig7B,意大利蜜蜂Cell adhesion molecule AbsCAM-Ig7B, Apis mellifer L.3172e-34细胞结构Cell structureF1-1-8ABB45785.1α-微管蛋白,共生菌Streblomastix strixα-tubulin, Streblomastix strix1543e-29F2-19AGJ71765.1原肌球蛋白, 部分源于菊花和叶蝉Tropomyosin, partial Chrysanthemum morifolium Ramat and Euscelidius variegatus Kirshbaum1368e-04F2-46ACC66067.1肌动蛋白,琥珀蚕Actin, Antheraea assam Westwood2091e-41F1-21EFN83272.1肌联蛋白,印度跳蚁Titin, Harpegnathos saltato Jerdo1273e-16F2-95EFN89426.1接头蛋白复合体mu-1,印度跳蚁AP-2 complex subunit mu-1, H.saltato1752e-31F2-72ABJ09674.1尼古丁乙酰胆碱受体的6号亚基的同型蛋白Ⅶ,家蝇Nicotinic acetylcholine receptor subunit 6 isoform Ⅶ, Mus-ca domestic L.2860.020F1-1-10NP001165851.1围食膜因子3-A2前体样表皮蛋白3-A2,丽蝇蛹集金小蜂Cuticular protein analogous to peritrophins 3-A2 precursor, Nasonia vitripenni (Walker)1821e-29F2-27NP001166263.1RR-1家族18号表皮蛋白前体,丽蝇蛹集金小蜂Cuticular protein RR-1 family member 18 precursor, N.vitrip-enni1292e-14转录调控Transcriptional con-trolF2-1BAA19776.1聚合酶蛋白,家蚕Pol protein, Bombyx mor L.3606e-31F2-91EFN82019.1组蛋白去甲基化酶UTX,印度跳蚁Histone demethylase UTX, H.saltato3121e-69F2-14EGI57453.1核内蛋白1,切叶蚁Nuclear protein 1, Acromyrmex echinatior (Forel)6532e-26R2-2-2EHJ63313.1逆转录酶,大红斑蝶Reverse transcriptase, Danaus plexippu L.1172e-08与耐寒性相关的候选基因F2-10CAJ28988.1热激蛋白83,地中海果蝇Heat shock protein 83, Ceratitis capitat (Wiedemann)1342e-21Candidate genes may be related to cold toler-anceF1-1-48ABV48741.1热激蛋白70同源类别(Hsc70),熊蜂蒺藜Heat shock protein cognate 70, Bombus terrestri L.2054e-41F2-24ACO57619.1热激蛋白60,蝶蛹金小蜂Heat shock protein 60, Pteromalus puparu L.4685e-63F1-1-50AFC76152.1热激蛋白90,刺桐姬小蜂Heat shock protein 90, Quadrastichus erythrina Kim7631e-34F1-2-31ACO58580.1热激蛋白90,意大利蜜蜂Heat shock protein 90, A.mellifer2217e-40F2-63WP028472695.1海藻糖磷酸合酶, 耐碱类诺卡氏菌Trehalose-phosphate synthase, Nocardioides alkalitoleran sp.nov.1992e-04F1-2-7NP001164445.1谷氨酰胺合成酶,意大利蜜蜂Glutamine synthetase, A.mellifer1171e-09F1-1-29XP003627732.1ATP 合成酶β亚基,蒺藜苜蓿ATP synthase subunit β, Medicago truncatul Gaertn.3362e-39F1-1-41NP001165787.1NADH 脱氢酶(辅酶)1-α亚复合体9, 39 kD,丽蝇蛹集金小蜂NADH dehydrogenase (ubiquinone) 1-α subcomplex 9, 39 kD, N.vitripenni2873e-52氨基酸和蛋白质的合成Synthesis of amino acids F1-1-25AAX62421.1核糖体蛋白L3,茶足柄瘤蚜茧蜂Ribosomal protein L3, Lysiphlebus testaceipe (Cresson)4699e-101and proteinsF1-2-37AAR01309.1延伸因子2,美洲大蠊Elongation factor 2, Periplaneta american L.6461e-143
续表1
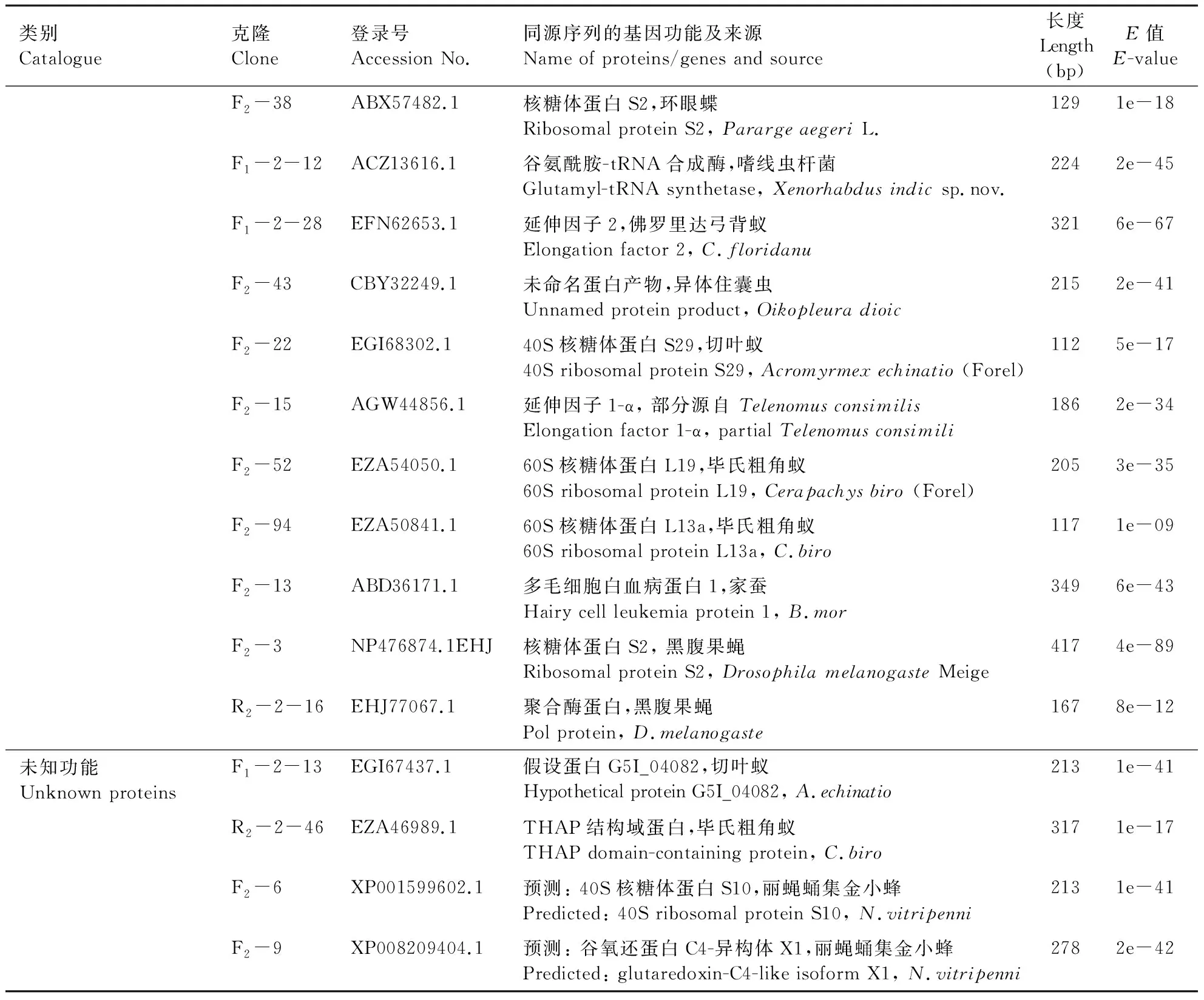
类别Catalogue克隆Clone登录号Accession No.同源序列的基因功能及来源Name of proteins/genes and source长度Length(bp)E值E-valueF2-38ABX57482.1核糖体蛋白S2,环眼蝶Ribosomal protein S2, Pararge aegeri L.1291e-18F1-2-12ACZ13616.1谷氨酰胺-tRNA合成酶,嗜线虫杆菌Glutamyl-tRNA synthetase, Xenorhabdus indic sp.nov.2242e-45F1-2-28EFN62653.1延伸因子2,佛罗里达弓背蚁Elongation factor 2, C.floridanu3216e-67F2-43CBY32249.1未命名蛋白产物,异体住囊虫Unnamed protein product, Oikopleura dioic2152e-41F2-22EGI68302.140S核糖体蛋白S29,切叶蚁40S ribosomal protein S29, Acromyrmex echinatio (Forel)1125e-17F2-15AGW44856.1延伸因子1-α, 部分源自 Telenomus consimilisElongation factor 1-α, partial Telenomus consimili1862e-34F2-52EZA54050.160S核糖体蛋白L19,毕氏粗角蚁60S ribosomal protein L19, Cerapachys biro (Forel)2053e-35F2-94EZA50841.160S核糖体蛋白L13a,毕氏粗角蚁60S ribosomal protein L13a, C.biro1171e-09F2-13ABD36171.1多毛细胞白血病蛋白1,家蚕Hairy cell leukemia protein 1, B.mor3496e-43F2-3NP476874.1EHJ核糖体蛋白S2, 黑腹果蝇Ribosomal protein S2, Drosophila melanogaste Meige4174e-89R2-2-16EHJ77067.1聚合酶蛋白,黑腹果蝇Pol protein, D.melanogaste1678e-12未知功能Unknown proteinsF1-2-13EGI67437.1假设蛋白G5I_04082,切叶蚁Hypothetical protein G5I_04082, A.echinatio2131e-41R2-2-46EZA46989.1THAP结构域蛋白,毕氏粗角蚁THAP domain-containing protein, C.biro3171e-17F2-6XP001599602.1预测: 40S核糖体蛋白S10,丽蝇蛹集金小蜂Predicted: 40S ribosomal protein S10, N.vitripenni2131e-41F2-9XP008209404.1预测: 谷氧还蛋白C4-异构体X1,丽蝇蛹集金小蜂Predicted: glutaredoxin-C4-like isoform X1, N.vitripenni2782e-42
F: 正向文库EST; R: 反向文库EST。
F: EST sequences of forward suppression library; R: EST sequences of reverse suppression library.
3 讨论
大多数亚热带、热带昆虫,由于较少经历0 ℃及以下低温,冬季来临时,低温在其体内易造成“不结冰冷伤害”(nonfreezing cold injury, NFCI)。为建立新的代谢过程以维持正常的生命活动,昆虫体内会发生一系列的生理变化。本试验对椰心叶甲啮小蜂低温耐寒相关的SSH-cDNA正反向文库EST序列进行功能分类,结果表明,差异表达的基因主要与新陈代谢、信号传导、转录调控、细胞结构功能、氨基酸和蛋白质的合成等生理过程有关,从中筛选出与啮小蜂耐寒性相关基因共5类。①Hsp家族蛋白,包括Hsp60、Hsc70(Hsp70的另一表现型)、Hsp83和Hsp90。其中,Hsp90蛋白能快速保护细胞对抗内外源性应激原的刺激,增强细胞的修复功能及提高细胞对应激的耐受程度(李娟等, 2008);Hsp70在细胞应激反应中扮演着重要的分子伴侣角色,且在低温暴露条件下与变性蛋白质的复性过程相关(Feder & Hofmann, 1999; Sinclairetal., 2007);Hsp83在昆虫卵巢发育期间起重要的保护作用,Xuetal.(2010)发现,Hsp83的表达若受到抑制,赤拟谷盗TriboliumcastaneumHerbst雌虫就无法产出成熟的卵细胞;Hsp60与能量代谢过程中酶和蛋白质的组装有关,在胁迫环境下,Hsp60的增加会使受损的蛋白质复性并恢复其生物活性(Chengetal., 1989; Martinetal., 1992)。②海藻糖磷酸合酶(trehalose-phosphate synthase,Tps),虽未直接报道在诺卡氏菌上与其耐寒性相关,但海藻糖是昆虫在面临高低温、干燥、氧化等外界胁迫环境时体内普遍诱导的一种具保护作用的二糖,有昆虫“血糖”之称(Thompson, 2003),Tps可诱导海藻糖的形成(Chung, 2008),而海藻糖正是椰心叶甲啮小蜂耐寒系统的主要物质之一(郭东峰, 2013)。③谷氨酰胺合成酶(glutamine synthetase),虽未报道在意大利蜜蜂体内与其耐寒性直接相关,但谷氨酰胺合成酶与麻蝇SarcophagacrassipalpisMacquart耐寒性相关(Michaud & Denlinger, 2007);④ATP合酶β亚基(ATP synthase subunit β),与竹节虫属Micrarchus耐寒性状的表达相关(Dunningetal., 2014)。⑤NADH脱氢酶,与水稻耐寒性状的表达相关(Yanetal., 2006)。
本文对进一步研究椰心叶甲啮小蜂抗寒性状的表达具有一定的参考价值,对揭示该蜂耐寒机制的探索打下一定的基础,但就本试验获得的所有EST序列及其实际功能,还需进一步验证。
陈浩, 杨杰, 成卫宁, 仵均祥. 2012.梨小食心虫滞育与非滞育幼虫抑制性消减文库的构建与分析. 西北农林科技大学学报:自然科学版, 40(9): 90-95, 102.
郭东峰. 2013. 低温胁迫对椰心叶甲啮小蜂种群影响及机理. 海口: 海南大学.
郭新红, 姜孝成. 2001. 用抑制差减杂交法分离和克隆梭梭幼苗受渗透胁迫诱导相关基因的 cDNA片段. 植物生理学报, 27(5): 401-406.
季相华. 2008. 稻水象甲夏季滞育相关基因的分离与鉴定 .杭州: 浙江大学.
李娟, 杨惠, 周元国. 2008. 热激蛋白 90 与热激应答. 生命的化学, 28(3): 299-301.
梁利群, 李绍戊, 常玉梅, 高俊生, 孙效文, 雷清泉. 2006. 抑制消减杂交技术在鲤鱼抗寒研究中的应用. 中国水产科学, 13(2): 193-199.
王衍海, 彭鸿娟, 陈晓光, 沈树满. 2006. 日本血吸虫消减雌性成虫cDNA 文库的建立及其特异表达基因的筛选. 中国寄生虫学与寄生虫病杂志, 24(1): 45-50.
张锴. 2010. 受松材线虫侵染的马尾松抑制消减文库构建与表达谱分析. 北京: 中国林业科学研究院.
Cheng M Y, Hartl F U, Martin J, Pollock R A, Kalousek F, Neupert W, Hallberg E M, Hallberg R L, Horwich A L. 1989. Mitochondrial heat-shock protein hsp60 is essential for assembly of proteins imported intoyeast mitochondria.Nature, 337: 585-674.
Chung J S. 2008. A trehalose 6-phosphate synthase gene of the hemocytes of the blue crab,Callinectessapidus: cloning, the expression, its enzyme activity and relationship to hemolymph trehalose levels.SalineSystems, 4: 18.
Diatchenko L, Lau Y F, Campbell A P, Chenchik A, Moqadam F, Huang B, Lukyanov S, Lukyanov K, Gurskaya N, Sverdlov E D and Siebert P D. 1996. Suppression subtractive hybridization: a method forgenerating differentially regulated or tissue-specific cDNA probes and libraries.ProceedingsoftheNationalAcademyofSciences, 93: 6025-6030.
Dunning L T, Dennis A B, Sinclair B J, Newcomb R D and Buckley T R. 2014. Divergent transcriptional responses to low temperature among populations of alpine and lowland species of New Zealand stick insects (Micrarchus).MolecularEcology, 23: 2712-2726.
Feder M E and Hofmann G E. 1999. Heat-shock proteins, molecular chaperones, and the stress response: evolutionary and ecological physiology.AnnualReviewofPhysiology, 61: 243-282.
Martin J, Horwich A L and Hartl F U. 1992. Prevention of protein denaturation under heat stress by the chaperonin Hsp60.Science, 258: 995-998.
Michaud M R and Denlinger D L. 2007. Shifts in the carbohydrate, polyol, and amino acid pools during rapid cold-hardening and diapause-associated cold-hardening in flesh flies (Sarcophagacrassipalpis): a metabolomic comparison.JournalofComparativePhysiologyB, 177: 753-763.
Sinclair B J, Gibbs A G and Roberts S P. 2007. Gene transcription during exposure to, and recovery from, cold and desiccation stress inDrosophilamelanogaster.InsectMolecularBiology, 16: 435-443.
Thompson S N. 2003. Trehalose-the insect ‘blood’ sugar.AdvancesinInsectPhysiology, 31: 205-285.
Wang S M and Rowley J D. 1998. A strategy for genome-wide gene analysis: integrated procedure for gene identification.ProceedingsoftheNationalAcademyofSciences, 95: 11909-11914.
Xu J, Tan A and Palli S R. 2010. The function of nuclear receptors in regulation of female reproduction and embryogenesis in the red flour beetle,Triboliumcastaneum.JournalofInsectPhysiology, 56: 1471-1480.
Yan S P, Zhang Q Y, Tang Z C, Su W A and Sun W N. Comparative proteomic analysis provides new insights into chilling stress responses in rice.Molecular&CellularProteomics, 5: 484-496.

