hMSCs的成骨定向分化及与PLGA/TCP的相容性*
王飞 王妍 程律莎 谢木源 张丽君† 梁世中††
(1.华南理工大学 生物科学与工程学院,广东 广州 510006;2.深圳职业技术学院 应用化学与生物技术学院,广东 深圳518055;3.广东药学院 生命科学与生物制药学院,广东 广州 510006)
疾病或创伤造成的骨缺损在临床上十分常见,近年来,利用组织工程骨修复骨缺损的研究方兴未艾[1-5].聚乳酸-羟基乙酸/磷酸三钙(Polylactic Glycolic Acid/Tricalcium Phosphate,PLGA/TCP)材料适应快速成型制造,具有优良的力学性能和化学稳定性,其在生物体内的降解产物乳酸可参与到新陈代谢中,最终生成二氧化碳和水排出体外,且其多孔的结构可提供很大的表面积/体积比,适合应用于骨组织工程[6-7].
人骨髓间充质干细胞(Human Marrow Mesenchymal Stem Cells,hMSCs)由于获取途径较为便捷,扩增表型稳定,同时避免了医学伦理争议,因而成为理想的组织工程骨种子细胞,用于向成骨细胞方向诱导以构建组织工程骨.Tali 等[8]采用hMSCs 构建软骨,体外接种生物活性材料并植入裸鼠体内,成软骨效果理想.黄永辉等[9]采用hMSCs 和纳米晶胶原骨构建组织工程骨,体外培养后成骨现象良好.Kim 等[10]构建了hMSCs 和预先矿化的丝支架结合的组织工程骨并进行体外培养,结果显示hMSCs在丝支架上增殖和成骨分化的效果明显.
文中着重研究hMSCs 的成骨定向分化能力及与PLGA/TCP 的生物相容性,为后续利用hMSCs 和PLGA/TCP 构建组织工程骨以应用于动物试验和临床实验提供理论及实验依据.
1 材料与方法
1.1 实验材料
1.1.1 细胞株
第5 代的hMSCs 细胞株购自赛业(广州)生物科技有限公司.在37 ℃下于5%(体积分数)CO2培养箱中孵育至细胞铺满瓶底时,用0.25%(质量分数)的胰蛋白酶消化传代,于每4 天换液,每7 天传代,至第8 代用于实验.
1.1.2 主要试剂及仪器
主要试剂如下:低糖DMEM(Dulbecco's Modified Eagle Medium)、高糖DMEM、胎牛血清、胰蛋白酶、L-谷氨酸和双抗均购自Gibco 公司,抗坏血酸、β-甘油磷酸钠和地塞米松均购自Sigma 公司,四甲基偶氮唑盐(MTT)比色法检测试剂盒购自上海碧云天生物技术有限公司,VON KASSA 染色试剂盒、核固红复染试剂盒和碱性磷酸酶(ALP)酶活性检测试剂盒均购自上海杰美基因医药科技有限公司.
主要仪器如下:Hera Cell 240 型细胞培养箱,美国热电公司生产;Olympus CKX41 型倒置相差显微成像系统,日本奥林巴斯公司生产;苏净安泰BHC-1000ⅡA2 型生物安全柜,江苏苏净集团有限公司生产;Eppendorf 5810 R 型台式离心机,德国艾本德公司生产;Spectramax M5e 型多功能酶标仪,美国Molecular Devices 公司生产;Quanta 450 型扫描电镜,美国FEI 公司生产.
1.1.3 hMSCs 的完全和成骨分化培养基
hMSCs 的完全培养基包括如下成分:低糖DMEM 88%,胎牛血清10%,L-谷氨酸1%,青/链霉素1%.以上成分含量均为体积分数.
hMSCs 的成骨分化培养基包括如下成分:高糖DMEM 86.5%,胎牛血清10%,L-谷氨酸1%,青/链霉素1%,10 mmol/L 抗坏血酸0.5%,1 mol/L β-甘油磷酸钠1%,1mmol/L 地塞米松0.01%.以上成分含量均为体积分数.
1.1.4 PLGA/TCP 的预处理
PLGA/TCP 由清华大学机械工程系提供,材料通过Ⅰ型胶原进行处理以利于细胞的附着生长.在无菌环境下将材料切割成4 mm ×4 mm ×2 mm 的小块.提前准备好灭菌的平皿,将切割好的材料放入平皿中,紫外线照射30 min;然后将材料转入灭菌的烧杯,用75%酒精完全浸没材料,浸泡30 min 灭菌并提高材料的亲水性.吸出酒精,用磷酸盐缓冲溶液(PBS)清洗3 次后浸泡过夜,以尽可能除去残存的乙醇.
接种细胞前将材料在培养基中浸泡24 h,取出后以无菌滤纸吸干水分.
1.2 实验及统计方法
1.2.1 hMSCs 在平面上的接种和换液
取对数生长期的第8 代hMSCs,以完全培养基重悬,调整细胞浓度至1 ×105个/mL.6 孔板每孔接种200 μL 细胞悬液,补充培养基至3 mL.细胞分为对照组和成骨组,4 天时用完全培养基和成骨分化培养基对应换液,之后每3 天换液.
1.2.2 hMSCs 在平面上成骨分化的VON KASSA染色检测
hMSCs 接种于6 孔板21 天后,小心抽去孔里的培养基,加入清理液清洗,用固定液固定10 min 后清洗2 次,染色1 h,再用清理液孵育2 min,平衡液孵育5 min,继续用清理液孵育2 min,核固红复染后于倒置显微镜下观察拍照,每组3 个复孔.
1.2.3 hMSCs 在平面上成骨分化的ALP 酶活性检测
hMSCs 接种于6 孔板后的第3、6、9、12、15、18和21 天,分别取一块6 孔板,吸尽液体,用清理液冲洗和0.25%胰蛋白酶消化,用吸管轻轻吹打数次,再加入含血清培养基终止消化,离心收集细胞,加入300 μL 裂解液,4 ℃下孵育30 min,13000 r/min 下离心5 min,移取上清,进行蛋白定量检测后,取5 μL上清加入220 μL 缓冲液和25 μL ALP 反应液,在酶联免疫检测仪上以405 nm 波长测定各孔0 和5 min的光密度(OD)值,每组3 个复孔,结果进行统计学分析.
1.2.4 hMSCs 在PLGA/TCP 上的接种和换液
取对数生长期的第8 代hMSCs,以完全培养基重悬,调整细胞浓度至1 ×104个/mL.
将经过预处理的PLGA/TCP 置于96 孔板中,用1 mL 的注射器取100 μL 细胞悬液逐滴地滴加到材料表面并下渗,3 min 后将材料翻转,以同样的方式滴加到另一面,静置15 min 后置于CO2培养箱中培养,每3 天换液,进行成骨分化的材料/细胞复合物在接种后4 天用成骨分化培养基换液.
1.2.5 hMSCs 在PLGA/TCP 上增殖和成骨分化的电镜检测
hMSCs 接种于PLGA/TCP 1、3、5、7 天后,分别取1 块材料,用PBS 清洗以去除未贴壁的细胞,再经3%戊二醛固定,乙醇系列脱水,临界点干燥,喷金,用扫描电镜观察hMSCs 在PLGA/TCP 上的黏附增殖情况.
材料/细胞复合物用成骨分化培养基换液7 天后,取1 块材料,用扫描电镜观察hMSCs 在PLGA/TCP 上的成骨分化情况.
1.2.6 hMSCs 在PLGA/TCP 上增殖的MTT 检测
hMSCs 接种于PLGA/TCP 1、3、5、7 天后,分别取一块96 孔板,每孔加入5 g/L 的MTT 溶液10 μL,继续置于培养箱内培养4 h,每孔再加入100 μL 的Formanzan 溶解液,在培养箱内再继续孵育4h,直至在普通光学显微镜下观察发现Formanzan 全部溶解.在酶联免疫检测仪上以570nm 波长测定各孔的OD 值,每组6 个复孔,以hMSCs 直接接种于孔板底部作为对照,结果进行统计学分析.以上实验重复2 次.
1.2.7 hMSCs 在PLGA/TCP 上成骨分化的ALP 酶活性检测
材料/细胞复合物用成骨分化培养基换液1、3、5、7 天后,分别取一块96 孔板,吸尽液体,用清理液冲洗和0.25%胰蛋白酶消化,并用吸管轻轻吹打数次,再加入含血清培养液终止消化,离心收集细胞,加入100 μL 裂解液,4 ℃下孵育30 min,13000 r/min 下离心5 min,移取上清,进行蛋白定量检测后,取5 μL上清加入220 μL 缓冲液和25 μL ALP 反应液,每组6个复孔,以hMSCs 直接接种于孔板底部作为对照,结果进行统计学分析.以上实验重复2 次.
1.2.8 统计方法
采用SPSS19.0 统计软件对实验数据进行统计学分析,数据以“算术平均值±标准差”的形式表示,进行t 检验,若P <0.05 则认为差异有统计学意义.
2 结果与讨论
2.1 hMSCs 的成骨定向分化结果
2.1.1 hMSCs 在平面上成骨分化的VON KASSA染色结果
VON KASSA 染色结果(见图1)显示:对照组细胞增殖呈长梭形成纤维细胞样,细胞排列密集,呈漩涡状,未发现细胞的重叠及钙结节的形成;成骨组细胞逐渐集中,呈铺路石状,随着诱导时间的延长,局部细胞呈重叠生长,逐渐堆积,矿盐沉积,形成多个黑色的钙结节.

图1 6 孔板上hMSCs 成骨分化的VON KASSA 染色结果Fig.1 VON KASSA photos of osteogenic differentiation of hMSCs on 6-well plate
2.1.2 成骨分化标志物的ALP 酶活性检测结果
ALP 酶活性是细胞成骨分化水平的重要标志,ALP 酶活性检测结果(见图2)显示:成骨组在换用成骨分化培养基后3 天已与对照组有显著性差异(P <0.01);分化初期ALP 酶活性随时间不断增高,12 天后达到最高值,15 天后略有下降,之后进入一个平台期;对照组细胞随时间延长其ALP 酶活性也略有上升,但增幅明显小于成骨组.

图2 hMSCs 在6 孔板上成骨分化的ALP 酶活性检测Fig.2 ALP test results of osteogenic differentiation of hMSCs on 6-well plate
2.2 hMSCs 与PLGA/TCP 的相容性结果
2.2.1 hMSCs 在PLGA/TCP 上增殖的检测结果
电镜下观察到:未接种细胞的空白材料其多孔结构非常明显,孔与孔之间结构致密,见图3(a);接种(增殖)后1 天,细胞呈梭形附着在材料上,见图3(b);接种后3 天,细胞表面生长大量微绒毛,表明细胞状态良好,细胞间彼此相连,见图3(c);接种后5 天,细胞数量明显增加,细胞外基质开始形成薄层均匀分布在材料上,基质层上可见小球状颗粒,见图3(d);接种后7 天,细胞已长入支架孔中,细胞间有大量微丝相连,见图3(e).

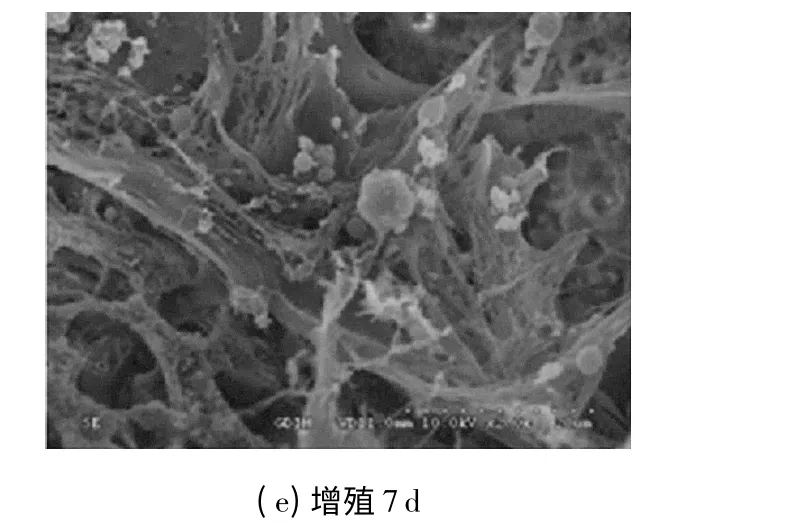
图3 hMSCs 在PLGA/TCP 上增殖的扫描电镜照片Fig.3 SEM photos of hMSCs proliferation on PLGA/TCP
MTT 检测结果(见表1)显示:与平面培养相对照,hMSCs 在PLGA/TCP 上的增殖速度较快,增殖效果更为明显.增殖1 和3 天,材料上hMSCs 和平面对照组的增殖速度较为接近,两者的OD 值没有显著性差异(P>0.05);增殖5 和7 天,材料上hMSCs的增殖速度明显高于平面对照组,两者的OD 值有显著性差异(P <0.01).分析认为,平面对照hMSCs在3~5 天之间处于对数生长期,随后在7 d 进入生长相对缓慢的平台期,而在材料上生长的hMSCs 在7 d 仍然具有较高的增殖速度,究其原因,应与PLGA/TCP的多孔结构具有很大的表面积/体积比,使得细胞有更多的空间可以粘附和生长有关.

表1 hMSCs 在PLGA/TCP 材料上增殖的MTT 检测结果1)Table 1 MTT test results of hMSCs proliferati on on PLGA/TCP
2.2.2 hMSCs 在PLGA/TCP 上的成骨分化效果
扫描电镜下观察到,用成骨分化培养基换液7天后,细胞基质层已覆盖材料表面积的60%以上,隐约可见钙结节,见图4.
ALP 酶活性检测结果显示,在PLGA/TCP 上成骨分化的hMSCs,其ALP 酶活性要高于平面对照组,这意味着材料能促进细胞的成骨分化.分化第1 天,材料和平面对照组的ALP 酶活性较为接近,两者没有显著性差异(P>0.05);分化第3 天,材料上hMSCs 的ALP 酶活性已高于平面对照组,两者有显著性差异(P <0.05),到第5 和第7 天,两者差异更为显著(P <0.01),见图5.

图4 hMSCs 在PLGA/TCP 上成骨分化7d 的扫描电镜照片Fig.4 SEM photo of osteogenic differentiation of hMSCs on PLGA/TCP for 7 days

图5 hMSCs 在材料和平面对照上的成骨分化趋势比较Fig.5 Comparison of osteogenic differentiation between hMSCson PLGA/TCP and the control
3 结语
目前,骨组织工程的研究主要集中在以下4 个方面:种子细胞,支架材料,骨生长因子和临床应用[11-12].文中从支架材料和种子细胞两个方面着手,重点考察了hMSCs 作为种子细胞与PLGA/TCP结合的生物相容性.
文中研究表明,hMSCs 作为种子细胞具有很强的成骨分化能力,接种于平面上的hMSCs 在成骨分化21 天时已经具有典型的骨细胞形态,钙结节明显,ALP 酶活性则明显高于空白对照组,前12 天大幅上升,随后逐渐进入平台期.
接种于PLGA/TCP 上的hMSCs 展现了与材料良好的生物相容性.电镜结果显示,细胞充分利用了材料的多孔特性,在材料上的增殖和分化有别于平面对照组,且其增殖能力明显好于平面对照组.MTT 检测显示,在接种初期,两者比较接近,5 天后平面对照组的细胞受到接触抑制而转入生长缓慢的平台期,而材料上生长的细胞仍具有较高的增殖速度,这表明PLGA/TCP 较大的表面积/体积比能支持更多的细胞生长.同样,在PLGA/TCP 上进行成骨分化的细胞,其分化效果也高于平面对照组,ALP 酶活性检测显示,分化初期两者具有相同的ALP 酶活性,3 天时立体培养组的ALP 酶活性逐渐超越对照组,5 天时开始有更显著的差异.
通过验证PLGA/TCP 与种子细胞hMSCs 的良好的生物相容性,文中研究为两者结合生成组织工程骨并进行动物体内实验奠定了良好的基础.
[1]Zhou Y,Chen F,Ho S T,et al.Combined marrow stromal cell-sheet techniques and high-strength biodegradable composite scaffolds for engineered functional bone grafts[J].Biomaterials,2007,28(5):814-824.
[2]Xu C X,Su P Q,Chen X F,et al.Biocompatibility and osteogenesis of biomimetic bioglass-collagen-phosphatidylserine composite scaffolds for bone tissue engineering[J].Biomaterials,2011,32(4):1051-1058.
[3]Alireza M,Sahar A,Chider C,et al.Co-encapsulation of anti-BMP2 monoclonal antibody and mesenchymal stem cells in alginate microspheres for bone tissue engineering[J].Biomaterials,2013,34(28):6572-6579.
[4]陈永锋,王林,张扬,等.以β-磷酸三钙为支架组织工程骨在兔脊柱后外侧融合中的作用研究[J].生物骨科材料与临床研究,2012,9(1):8-12.Chen Yongfeng,Wang Lin,Zhang Yang,et al.Effects of tissue engineering bone constructed by β-tricalcium phosphate scaffold on rabbits posterolateral spinal fusion[J].Orthopaedic Biomechanics Materials and Clinical Study,2012,9(1):8-12.
[5]王迎军,杜昶,赵娜如,等.仿生人工骨修复材料研究[J].华南理工大学学报:自然科学版,2012,40(10):51-58.Wang Ying-jun,Du Chang,Zhao Na-ru,et al.Biomimetic artificial bone repair materials a review [J].Journal of South China University of Technology:Natural Science Edition,2012,40(10):51-58.
[6]费小琛,颜永年,熊卓,等.骨组织工程PLGA/TCP 复合材料的性能研究[J].材料导报,2003,17(12):76-79.Fei Xiaochen,Yan Yongnian,Xiong Zhuo,et al.A study of properties of PLGA/TCP composite for bone tissue engineering scaffolds[J].Materials Review,2003,17(12):76-79.
[7]贾帅军,孟国林,刘建,等.胶原修饰快速成形PLGA/TCP 人工骨支架体外生物相容性研究[J].科学技术与工程,2009,9(12):3207-3211.Jia Shuai-jun,Meng Guo-lin,Liu Jian,et al.Biocompati-bility of rapid promotyping PLGA/TCP tissue engineered bone scaffolds coated with collagen in vitro[J].Science Technology and Engineering,2009,9(12):3207-3211.
[8]Tali R,Yael K I,Emil R,et al.Chondrogenesis of hMSC in affinity-bound TGF-beta scaffolds [J].Biomaterials,2012,33(3):751-761.
[9]黄永辉,夏青,沈铁城,等.人骨髓间充质干细胞接种纳米晶胶原骨构建组织工程骨[J].生物骨科材料与临床研究,2008,5(1):1-3.Huang Yonghui,Xia Qing,Shen Tiecheng,et al.Tissueengineered bone constructed by seeding human messenchymal stem cells on nano-hydroxyapatite/collagen[J].Opaedic Biomechanics Materials and Clinical Study,2008,5(1):1-3.
[10]Kim H J,Kim U J,Kim H S,et al.Bone tissue engineering with premineralized silk scaffolds[J].Bone,2008,42(6):1226-1234.
[11]Wang L,Huang Y L,Pan K F,et al.Osteogenic responses to different concentrations/ratios of BMP-2 and bFGF in bone formation[J].Science,2010,38(1):77-87.
[12]左思力,龚跃昆.骨髓间充质干细胞及细胞因子在股骨头坏死治疗中的应用与展望[J].中国组织工程研究,2012,16(14):2621-2624.Zuo Si-li,Gong Yue-kun.Application and prospects of bone marrow mesenchymal stem cells and cytokines in the treatment of femoral head necrosis [J].Chinese Journal of Tissue Engineering Research,2012,16(14):2621-2624.

