煅烧温度对纳米SnO2光催化降解亚甲基蓝的影响
马 瑞, 万 霞, 铁绍龙
(华南师范大学化学与环境学院,广州 510006)
随着世界人口的不断增加,环境污染日益加剧,一些新的、高效、环保的污染处理方法的研究受到重视,如:在众多处理方法中,使用TiO2、ZnO、SnO2等半导体金属氧化物[1-3]作为光催化剂来降解有机污染物,其降解产物为CO2、H2O、无机离子等小分子[4],解决了二次污染问题. 由于SnO2带隙约为3.6 eV,需使用紫外光源照射才能有效地激发光化学反应,同时其光催化降解效率也明显低于TiO2. 因此研究者通过掺杂离子或与其他半导体组成复合光催化剂来提高其降解效率或者实现可见光照射下的降解反应[5-8]. 由于单一催化剂的性质决定了其在复合催化剂中的表现,而催化剂的合成方法不同以及后处理方法都会强烈地影响其性质,从而影响其催化效率. 因此研究后处理温度对纳米SnO2样品性质以及光催化降解亚甲基蓝(MB)性能的影响具有必要性,可为合成高效的光催化剂提供有价值的研究结果.
本文采用直接沉淀法,使用锡盐(SnCl4)与氢氧化钠(NaOH)在约90 ℃下反应,直接获得了纳米级的SnO2,再经不同温度煅烧后处理得到不同粒径大小的SnO2样品. 采用X射线粉末衍射仪(XRD)、扫描电子显微镜(SEM)、紫外可见分光光度计(UV)等仪器对其性质进行表征,并以亚甲基蓝作为目标降解物,研究其在紫外光(=254 nm)照射下的催化降解行为. 分析催化剂性质对降解反应的影响,并初步讨论了其降解机理.
1 实验部分
1.1 试剂和仪器
试剂:四氯化锡(SnCl4·5H2O, AR,上海国药化学试剂厂)、氢氧化钠和盐酸(AR,天津市大茂化学试剂厂)、亚甲基蓝(≥98.5%,天津市天新精细化工开发中心).
仪器:紫外灯(PHILIPS,HP125R,125 W,=253.7 nm)、DF101S集热式磁力搅拌器(巩义市矛华仪器有限公司)、多功能搅拌器(SRJK-4-13)、高温箱式电阻炉(北京市永光明医疗仪器厂,220 V,4 kW)、SK2200HP超声波清洗器(上海科导超声仪器有限公司,电源电压:220 V,工作频率:53 kHz,功率:100 W).
1.2 纳米SnO2的合成
通过直接沉淀法采用SnCl4与NaOH合成得到纳米SnO2. 将4.66 g SnCl4·5H2O溶于100 mL 2 mol/L的盐酸中得到溶液A,另将10 g NaOH溶于100 mL水中得到溶液B. 将800 mL水加入容积为1 L的三颈烧瓶中,在水浴中加热到92 ℃,将溶液A和B同时慢慢地滴入三颈瓶中,并不断搅拌. 溶液滴加完后,用盐酸或NaOH溶液调节pH=6,继续保温1 h. 然后将三颈瓶置于60 ℃恒温水浴中陈化18 h后,减压过滤分离出沉淀,用去离子水洗净沉淀数次,最后放入60 ℃烘箱干燥24 h,得到纳米SnO2产品,用H000表示. 取H000样品,分别在200、400、600、800和1 000 ℃下煅烧3 h,得到了相应的H200、H400、H600、H800和H1000样品.
1.3 SnO2催化降解亚甲基蓝
因SnO2的带隙能量Eg为3.6 eV,选用254 nm的紫外光作为照射光源(辐照光能量必须高于或等于SnO2的Eg). 经空白试验证明,在紫外光辐照下,亚甲基蓝不分解. 称取0.05 g SnO2样品,加入少量水,先在黑暗中置于超声仪中超声分散0.5 h,制成悬浮液. 然后加入亚甲基蓝(MB)溶液,最终使总体积为50 mL,亚甲基蓝浓度为40 mg/L,SnO2含量为1.0 g/L,pH为6.5. 将盛有该悬浮液的烧杯置于恒温水浴中,控制温度为30±0.2 ℃,采用磁力搅拌,置于紫外灯(125 W,=253.7 nm)照射下进行降解(保持灯垂直于液面上,距离为16 cm). 反应一定时间后用注射器取出约2 mL反应液,采用直径为0.45 μm的水系过滤膜分离除去SnO2,按一定比例稀释后在紫外可见分光光度计上测定滤液在max=665 nm处(MB的最大吸收波长)的吸光度值At, 由下面公式计算亚甲基蓝的降解率:
式中:C0和Ct分别表示MB在初始和反应时间t时的浓度,A0和At分别表示初始和反应时间t时MB在=665 nm处的吸光度值.
1.4 样品的分析测试
采用德国 Carl Zeiss Ultra 55 型场发射扫描电子显微镜(SEM)观测SnO2样品的形貌和粒径大小;用丹东TD-3000型X射线衍射仪(XRD)对样品的物相和晶体结构进行表征;用日本岛津UV-1700型紫外可见分光光度计测定亚甲基蓝溶液在可见区的吸收;使用美国Perkin Elmer的TGA7热重分析仪测定样品的TG曲线(气氛为氮气,升温速度为10 ℃/min,升温范围为30~800 ℃). 使用日本岛津IR-prespige-21型傅立叶变换红外光谱仪进行样品的红外分析. 采用美国ASAP2020型比表面分析仪对样品进行BET比表面积分析.
2 结果与讨论
2.1 纳米SnO2的性质表征
图1是H000和经1 000 ℃烧结处理后得到的H1000样品的SEM图. 结果显示,由SnCl4和NaOH共沉淀反应获得的纳米SnO2为球型颗粒,平均粒径约10 nm. 随着烧结温度的升高,SnO2纳米颗粒的粒径也在增大,在1 000 ℃处理后平均粒径增加到30 nm. 同时其BET表面积也从H000样品的124.1 m2/g大幅减小到H1000的14.2 m2/g.

图1 SnO2样品的SEM
图2给出了不同处理温度的SnO2样品的XRD谱,结果显示,所有样品各衍射峰的位置及相对强弱与标准SnO2(JCPDS No. 88-0287)的完全吻合,证明由SnCl4与NaOH在高温(92 ℃)下反应直接获得了SnO2. 未经烧结的H000样品衍射峰强度低,半高宽较大,说明得到的SnO2粒径小,晶化程度较差. 随着烧结温度的增加,衍射峰强度逐渐增强,半高宽逐渐变窄,说明SnO2的晶化程度越来越高,粒径依次增大. 利用Scherrer公式估算SnO2样品的平均粒径(表1).其结果与SEM得到的平均粒径比较略微偏小.

图2 不同温度烧结SnO2样品的XRD谱
不同温度烧结制备的SnO2样品红外光谱如图3所示,未经高温处理的样品在1 770~3 690 cm-1波数范围内出现一个宽而强的OH振动吸收峰,说明SnO2样品表面吸附了大量的OH,经200 ℃处理后,OH含量略有减少. 随着处理温度升高,OH含量依次减少. 达到800 ℃后,表面吸附的OH含量已基本为0,这时3 400 cm-1处的吸收峰为样品干燥不够彻底,其中少量水分子中的羟基振动吸收产生.

表1 SnO2样品的特征参数和MB光照1 h的降解率
*dXRD由Scherrer公式估算获得
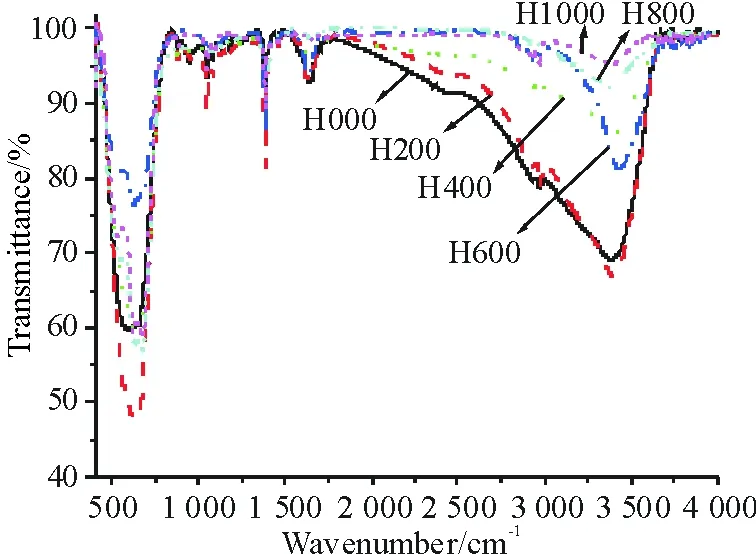
图3 不同温度烧结SnO2样品的红外光谱
2.2 纳米SnO2光催化降解亚甲基蓝
2.2.1 纳米SnO2光催化降解亚甲基蓝的动力学 研究[9-10]证明, TiO2、ZnO、SnO2等的半导体型光催化剂在紫外或可见光照射下,降解有机染料的反应是在催化剂表面进行的,且为一级反应,即满足Langmuir-Hinshelwood(L-H)模型[11], 其方程式为:
(1)
式中,r为催化降解反应速率;C为反应物的质量-体积浓度,mg/L;k为表面反应的速率常数,mg/(L·min);K为L-H表观吸附平衡常数,L/mg.
当反应物浓度较低时,K·C≤1, 由式(1)可以演变出下列几式:
(2)
(3)
(4)
式中:kap,称为拟一级降解反应的速率常数(min-1),C0为降解物的初始浓度(mg/L),Ct为t时刻降解物的浓度(mg/L),t为降解反应时间(min).
根据式(3),以ln(C0/Ct)对时间t作图,若呈直线,说明反应为拟一级反应,其直线的斜率即为降解反应的速率常数kap(min-1). 如果以1/kap对C0作图,呈现直线关系,即满足式(4),证明Langmuir-Hinshelwood吸附模型适用于该有机物的降解反应.
图4是不同初始MB浓度条件下,ln(C0/Ct)与反应时间t的关系图. 结果显示,在t低于120 min范围内,时间(t)与ln(C0/Ct)均满足直线关系,说明降解MB的反应为拟一级反应. 当MB初始浓度分别为28、35、40、45、50 mg/L时,其对应的速率常数分别为0.032 4、0.027 3、0.023 2、0.021 2、0.016 2 min-1,依次减小. 以1/kap对MB的初始浓度作图(图5). 在MB初始浓度小于等于45 mg/L的范围内,1/kap与C0呈直线关系,说明SnO2降解MB的反应满足Langmuir-Hinshelwood模型,即有机物先吸附于催化剂SnO2表面,然后与活性中心反应,达到降解的目的.
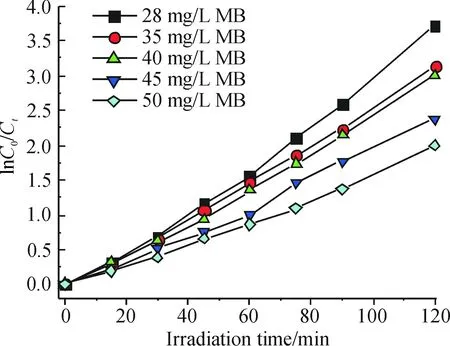
图4 MB初始浓度对光催化降解MB反应的影响

图5 1/kap与MB的初始浓度的关系图
2.2.2 处理温度对SnO2样品降解MB的影响
图6是经不同温度处理后的SnO2样品在UV光照射下降解亚甲基蓝,其lnC0/Ct与t的关系图. 降解效率顺序为:H200>H000>H400>H600>H800>H1000. H200具有最大的速率常数(0.029 3 min-1),这是因为由水溶液中直接合成得到纳米SnO2样品,因沉淀速度快,内部及表面存在较多的缺陷,其中的一些会成为灭活中心而消耗掉部分光反应产生的活性粒子,导致降解率下降. 经200 ℃处理后,样品晶化程度增加,这些灭活中心会减少,同时因温度不高,其比表面积只是略微减小(表1),样品表面吸附的OH数仍然较多(图3),另外较好的结晶度可以降低光激发的电子与孔穴复合的几率[12],这些因素都导致其降解效率高于未处理的H000样品. 当处理温度超过200 ℃后,随着温度的升高,SnO2的粒径增大,比表面明显减小,样品表面吸附的OH数减小,导致体系中产生的羟自由基数目减少,所以MB的降解效率也就依次减小. 因此,处理温度不同,导致SnO2催化剂的性质发生变化. 随着处理温度的增加,催化剂的晶化程度增加,粒径增大,比表面减小,内部和表面缺陷数目减少,表面吸附的OH或H2O的数目减少. 而这些性质的改变均导致催化剂的降解效率减弱. 但低温处理样品却有利于提高降解率,在此条件下,催化剂的性质改变不是很大,而晶化程度的提高大大地减少了快速结晶产生的缺陷灭活中心,导致催化剂的降解效率增强.

图6 不同处理温度的SnO2样品光照下降解MB的比较
2.3 SnO2降解MB的机理


图7 SnO2降解有机物的机理
3 结论
通过SnCl4与NaOH在92 ℃下直接沉淀反应,一步获得了纳米级的SnO2催化剂,经不同温度处理获得了性质不同的SnO2样品. 研究结果表明,经200 ℃处理的样品其降解MB的降解率最高. 这是因为低温处理的样品晶化程度增加,体系中的缺陷灭活中心减少,有利于提高体系中羟自由基的含量,从而降解率增大. SnO2降解MB的反应为拟一级反应,符合Langmuir-Hinshelwood模型. 在UV/SnO2降解亚甲基蓝的体系中,OH·为主要的活性体,它与MB结合最终导致其分解为CO2、H2O和无机酸根离子.
参考文献:
[1] Konstantinou I K, Albanis T A. TiO2-assisted photocatalytic degradation of azo dyes in aqueous solution: Kinetic and mechanistic investigations a review[J]. Applied Catalysis B: Environmental, 2004, 49:1-14.
[2] 陈珊珊, 万霞, 铁绍龙. 超声协同作用下亚微米掺铝氧化锌催化降解亚甲基蓝的研究[J]. 华南师范大学学报:自然科学版, 2012, 44(1):76-81.
Chen S S, Wan X, Tie S L. Ultrasound assisted degradation of methylene blue by fenton/Co2+system in the presence of Zn(Al)O[J]. Journal of South China Normal University, 2012, 44(1):76-81.
[3] Malpass G R P, Miwa D W, Machado S A S, et al. SnO2-based materials for pesticide degradation[J]. Journal of Hazardous Materials, 2010, 180:145-151.
[4] Matthew R W. Photo-oxidation of organic material in aqueous suspensions of titanium dioxide[J]. Water Research, 1986, 20:569-578.
[5] Wang C, Xu B Q, Wang X M, et al. Preparation and photocatalytic activity of ZnO/TiO2/SnO2mixture[J]. Journal of Solid State Chemistry, 2005, 178:3500-3506.
[6] Yin K, Shao M W, Zhang Z S, et al. A single-source precursor route to Ag/SnO2heterogeneous nanomaterials and its photo-catalysis in degradation of Conco Red[J]. Materials Research Bulletin, 2012, 47: 3704-3708.
[7] Zhang T, Xia H L, Xiao D C, et al. Photocatalytic degradation of acid blue over Fe2O3-SnO2nanocomposite oxide photocatalyst under irridiation of simulated sunlight[J]. Chemical Industry and Engineering Progress, 2007, 26(1):47-50.
[8] Xia H L, Zhuang H S, Zhang T, et al. Photocatalytic degradation of Acid Blue 62 over CuO-SnO2nanocomposite photocatalyst under simulated sunlight[J]. Journal of Environmental Sciences, 2007, 19: 1141-1145.
[9] Sauer T, Cesconeto G, Jose H J, et al. Kinetics of photocatalytic degradation of reactive dyes in a TiO2slurry reactor[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2002, 149: 147-154.
[10] Height M J, Pratsinis S E, Mekasuwandumrong O, et al. Ag-ZnO catalysts for UV-photo degradation of methylene blue[J]. Applied Catalysis B: Environmental, 2006, 63: 305-312.
[11] Jian C H, Ollos D F, Rulkens W H, et al. Kinetics processes of photocatalytic mineralizaytion of alcohols on metalized titanium dioxide[J]. Water Research, 1999, 33(5): 1173-1180.
[12] 李俊华, 傅慧静, 傅立新, 等. 金属离子掺杂TiO2薄膜的制备及其光催化降解甲苯的性能[J]. 催化学报, 2005, 26(6): 503-507.
Li J H, Fu H J, Fu L X, et al.Preparation of metallic mon-doped TiO2thin films and their photocatalytic performance for toluene degradation[J]. Chinese Journal of Catalysis, 2005, 26(6): 503-507.
[13] Talehian N, Nilforoushan M R. Comparative study of the structural, optical, and photocatalytic properties of semiconductor metal oxides toward degradation of methylene blue[J]. Thin Solid Films, 2010, 518:2210-2215.
[14] 袁梦,万霞,铁绍龙. 纳米NiO光催化剂性质对降解亚甲基蓝染料的影响[J]. 华南师范大学学报:自然科学版,2013, 45(1):62-67.
Yuan Meng, Wan Xia, Tie Shaolong. Effects of Catalyst Characters on the Photocatalytic Activities of NiO Nanoparticles in the Degradation of Methylene Blue[J]. Journal of South China Normal University, 2013,45(1):62-66.

