(±)-Lespeflorins A3的全合成*
冯 尧,杨金会,郭冬冬,左武标,陈兵兵,谢一民
(宁夏大学 天然气转化国家重点实验室培育基地,宁夏 银川 750021)
·快递论文·
(±)-Lespeflorins A3的全合成*
冯 尧,杨金会,郭冬冬,左武标,陈兵兵,谢一民
(宁夏大学 天然气转化国家重点实验室培育基地,宁夏 银川 750021)
以2,4-二羟基苯乙酮为原料,经C-异戊烯基化和酚羟基保护制得中间体2-羟基-4-甲氧甲氧基-3,5-二异戊烯基苯乙酮(4)。以对羟基苯甲醛为原料,经C-异戊烯基化和催化环化制得中间体2,2-二甲基-5-甲酰基-2H-1-苯并吡喃(7);4和7经羟醛缩合反应得2′-羟基-3′,5′-二异戊烯基-4′-甲氧甲氧基-4,5-(2,2-二甲基-苯并吡喃)-查尔酮(8);8经分子内的迈克尔加成反应得6,8-二异戊烯基-7-甲氧甲氧基-4′,5′(2,2-二甲基-苯并吡喃)-二氢黄酮(9);在对甲苯磺酸的催化下,9脱去保护基,首次完成了天然异戊烯基黄烷酮(±)-Lespeflorins A3的全合成。其中8和9为新化合物,其结构经1H NMR,IR和EI-MS表征。
Lespeflorins A3;黄烷酮;异戊烯基黄烷酮;全合成
黄烷酮化合物大部分具有广泛的生理和药理活性[1-4]。Lespeflorins A3(Chart 1)是Maya Mori-Hongo等[5]从Lespedeza floribuda中分离出的一种双异戊烯基黄烷酮,因具有抑制黑色素合成的作用,对治疗皮肤病有潜在功效[5]。目前Lespeflorins A3的全合成还未见文献报道,因此对其进行全合成研究不仅具有重要的理论意义,而且具有潜在的治疗皮肤病的药用前景。
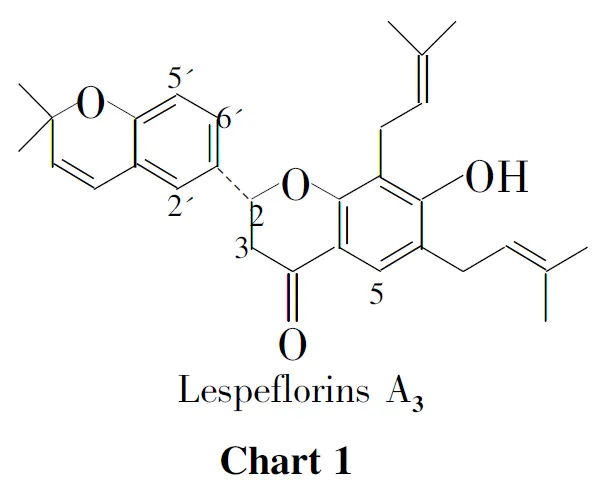
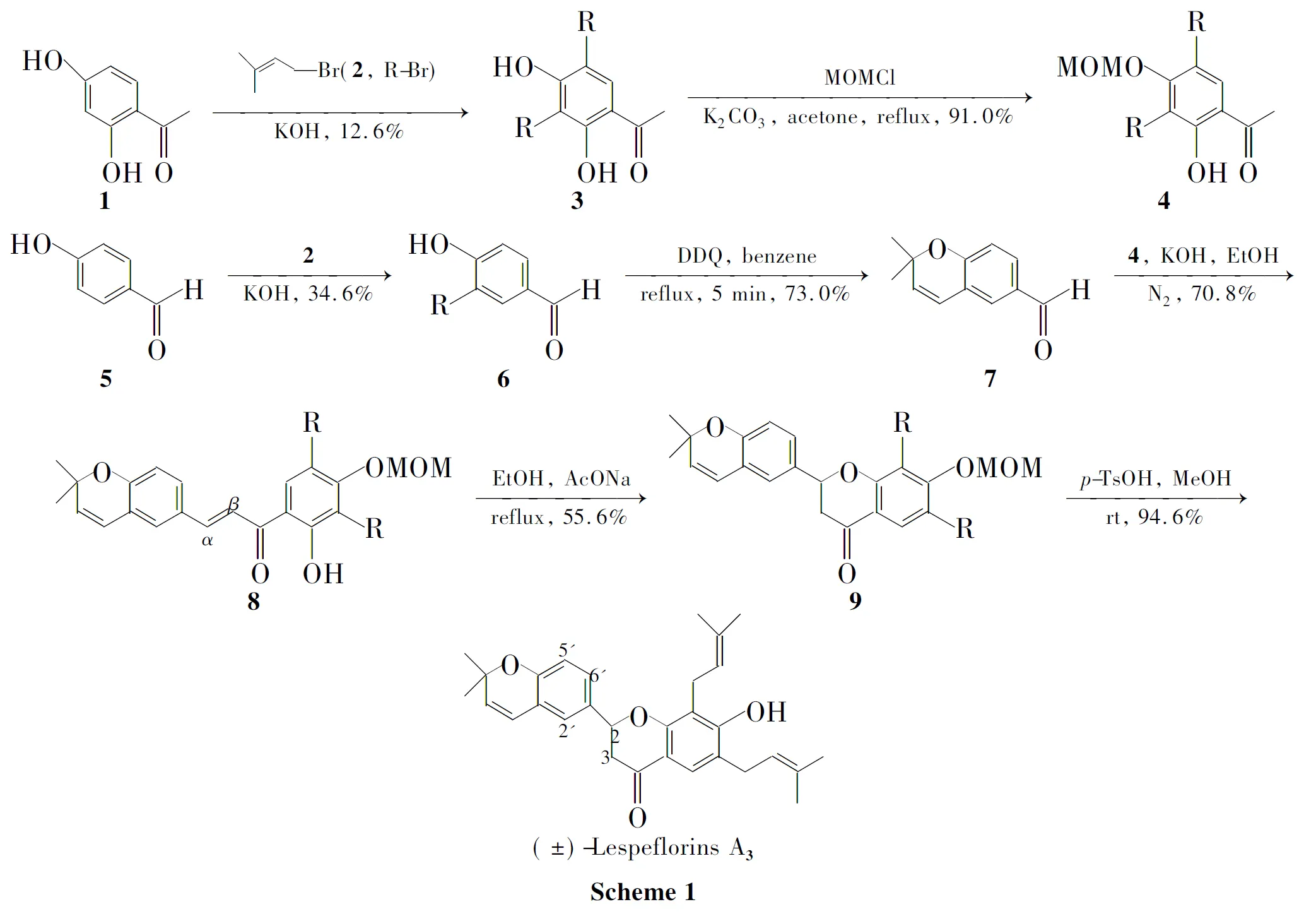
本课题组长期从事异烯基类黄烷酮的研究[6-9],在此基础上,本文以2,4-二羟基苯乙酮(1)为原料,经C-异戊烯基化和酚羟基保护制得中间体2-羟基-4-甲氧甲氧基-3,5-二异戊烯基苯乙酮(4)。以对羟基苯甲醛(5)为原料,经C-异戊烯基化和催化环化制得中间体2,2-二甲基-5-甲酰基-2H-1-苯并吡喃(7); 4和7经羟醛缩合反应得2′-羟基-3′,5′-二异戊烯基-4′-甲氧甲氧基-4,5-(2,2-二甲基-苯并吡喃)-查尔酮(8);8经分子内的迈克尔加成反应得6,8-二异戊烯基-7-甲氧甲氧基-4′,5′(2,2-二甲基-苯并吡喃)-二氢黄酮(9);在对甲苯磺酸的催化下,9脱去保护基,首次完成了天然异戊烯基黄烷酮(±)-Lespeflorins A3的全合成(Scheme 1)。其中8和9为新化合物,其结构经1H NMR,IR和EI-MS表征。
1 实验部分
1.1 仪器与试剂
Bruker AM-400MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);FT-IR-8430S型红外光谱仪(KBr压片);Bruker maXis UHR-TOFQ型质谱仪。
异戊烯基溴(2)[12],3-异戊烯基-4-羟基-苯甲醛(6)[7]和2,2-二甲基-5-甲酰基-2H-1-苯并吡喃(7)[7]按文献方法合成;200目~300目和GF254硅胶,青岛海洋化工厂;其余所用试剂均为分析纯。
1.2 合成
(1)2,4-二羟基-3,5-二异戊烯基苯乙酮(3)的合成[10]
在反应瓶中加入KOH 1.12g(20mmol)的水(20mL)溶液,冷却至0℃,搅拌下加入1760mg(5.0mmol);缓慢滴加22.1mL(20mmol),滴毕,于0℃反应1h;于室温避光反应14h(TLC跟踪)。用3mol·L-1盐酸调至pH<3,用乙酸乙酯(3×30mL)萃取,合并有机相,依次用水和饱和食盐水洗涤,无水硫酸钠干燥。减压蒸除溶剂后经硅胶柱层析[洗脱剂:A=V(石油醚)∶V(乙酸乙酯)=10∶1]纯化得黄色油状物,用石油醚低温重结晶得白色固体3182mg,产率12.6%[9];1H NMRδ:12.93(s,1H,OH),7.34(s,1H,ArH),6.20(s,1H,OH),5.26(m,2H,CH2=),3.43,3.28(d,J=8.0Hz,2H,CH2),2.54(s,3H,CH3CO),1.83,1.78,1.76,1.75(s,each 3H,CH3)。
(2)4的合成
在反应瓶中加入3637.4mg(1.92mmol)和干燥丙酮15mL,搅拌使其溶解;剧烈搅拌下加入无水碳酸钾386.4mg(2.80mmol),滴加氯甲基甲基醚(MOMCl)224mg(2.80mmol),回流反应45min(TLC跟踪)。冷却至室温,减压蒸除溶剂,剩余物用水溶解后用乙酸乙酯(3×30mL)萃取,合并有机相,依次用水和饱和食盐水洗涤,无水硫酸钠干燥。减压蒸除溶剂后经硅胶柱层析(洗脱剂:A=8∶1)纯化得黄色晶体4580.2mg,产率91.0%;1H NMRδ:12.61(s,1H,OH),7.40(s,1H,ArH),5.28,5.20(m,each 1H,CH2=),5.00(s,2H,OCH2O),3.60(s,3H,OCH3),3.39,3.34(d,J=6.80Hz,each 2H,CH2),2.57(s,3H,CH3CO),1.77,1.72,1.68,1.68(s,each 3H,CH3)。
(3)8的合成[11]
在反应瓶中加入4447.6mg(1.35mmol),7225mg(1.20mmol)和乙醇5mL,搅拌使其溶解;冰水浴冷却至0℃,缓慢滴加混合溶液[氢氧化钾(3.91g)+水(3.7mL)+乙醇(5.6mL)],氮气保护下于0℃反应1h;自然升至室温,反应24h(TLC跟踪)。倒入冰水中,用3mol·L-1盐酸调至pH<3,用二氯甲烷(3×20mL)萃取,合并有机相,依次用水和饱和食盐水洗涤,无水硫酸钠干燥,减压蒸除溶剂后经硅胶柱层析(洗脱剂:A=32∶1)纯化得黄色油状物8428mg,产率70.8%;1H NMRδ:13.35(s,1H,OH),7.82(d,J=8.0Hz,1H,ArH),7.81(d,J=15.2Hz,1H,β-H),7.59(s,1H,ArH),7.43(d,J=15.6Hz,1H,α-H),7.42(dd,J=8.0Hz,2.0Hz,1H,ArH),7.261(d,J=5.2Hz,1H,ArH),6.81(d,J=8.4Hz,1H,ArH),6.35(d,J=9.6Hz,1H,CH=),5.68(d,J=10Hz,1H,CH=),5.32,5.25(m,each 1H,CH=),5.23(s,2H,OCH2O),3.61(s,3H,OCH3),3.42,3.38(d,J=6.4Hz,7.2Hz,2H,CH2),1.79,1.77,1.75,1.45(s,each 3H,CH3);IRν:2294,2927,1632,1560,1485,1364,1264,1127,577cm-1;HR-MSm/z:Calcd for C32H38O5{[M+H]+}503.27920,found 503.27905。
(4)9的合成
在反应瓶中加入8120.5mg(0.24mmol)和无水乙醇5.0mL,搅拌使其溶解;加入无水醋酸钠400mg(4.80mmol)和水5滴,回流反应25h(TLC跟踪)。冷却至室温,加少量水,用乙酸乙酯(3×20mL)萃取,合并有机相,依次用水和饱和食盐水洗涤,无水硫酸钠干燥,减压蒸除溶剂后经硅胶柱层析(洗脱剂:A=32∶1)纯化得淡黄色油状物967mg,产率55.6%;1H NMRδ:7.6(s,1H,ArH),7.17(dd,J=8.4Hz,1H,2′-H),7.05(d,J=2.4Hz,1H,ArH),6.80(d,J=8.4Hz,1H,ArH),6.32(d,J=9.6Hz,1H,CH2=),5.66(d,J=10Hz,1H,CH2=),5.33(dd,J=13.2Hz,3.2Hz,1H,2-H),5.28,5.18(m,each 1H,CH2=),5.01(s,2H,OCH2O),3.60(s,3H,OCH3),3.38,3.35(d,J=6.8Hz,7.2Hz,each 2H,CH2=),3.00(dd,J=16.8Hz,17.2Hz,1H,H3ax),2.83(dd,J=16.8Hz,16.8Hz,1H,H3eq),1.75,1.71,1.67,1.61,1.45,1.43(s,each 3H,CH3);IRν:2973,2923,1685,1600,1490,1443,1261,1154cm-1;HR-MSm/z:Calcd for C32H38O5{[M+H]+}503.27920,found 503.27899。
(5)(±)-Lespeflorins A3的合成
在反应瓶中加入967.0mg(0.13mmol)和甲醇5mL,搅拌使其溶解;加入对甲基苯磺酸(p-TsOH)38.0mg(0.20mmol),搅拌下于室温反应至终点(TLC跟踪)。加少量水,用乙酸乙酯(3×20mL)萃取,合并有机相,依次用水和饱和食盐水洗涤,无水硫酸钠干燥,减压蒸除溶剂后经硅胶柱层析(洗脱剂:A=10∶1)纯化得白色固体(±)-Lespeflorins A357mg,产率94.6%;1H NMRδ:7.60(s,1H,ArH),7.18(dd,J=8.4Hz,8.4Hz,1H,2′-H),7.05(d,J=2.0Hz,1H,ArH),6.80(d,J=8.4Hz,1H,ArH),6.33(d,J=9.6Hz,1H,ArH),6.14(s,1H,OH),5.65(d,J=10Hz,1H,CH2=),5.32(dd,J=13.1Hz,1H,2-H),5.29,5.22(m,each 1H,CH2=),3.40,3.30(d,J=7.2Hz,each 2H,OCH2O),2.98(dd,J=16.8Hz,13.2Hz,1H,H3ax),2.82(dd,J=16.8Hz,3.2Hz,1H,H3eq),1.79,1.77(s,each 3H,CH3),1.73,1.44(s,each 6H,CH3);IRν:3361,2975,2923,1711,1683,1454,1358,1261,1169cm-1;HR-MSm/z:Calcd for C30H34O4{[M+H]+}459.25299,found 459.25314。
2 结果与讨论
1在KOH/H2O的条件下与2反应,以12.6%的收率制得双C-异戊烯基化合物(3);3在丙酮/无水碳酸钾的条件下得到被保护羟基的化合物(4)。5在KOH/H2O的条件下与2反应,以34.6%收率制得单C-异戊烯基化合物(6)[10];6在DDQ(2,3-二氯-5,6-二氰基-1,4-苯醌)的作用下关环,以73.0%的收率制得7;4和7在氮气保护下,在氢氧化钾-水-乙醇的条件下以70.8%收率制得8[11];8在乙醇/无水醋酸钠的条件下关环制得保护羟基的黄烷酮化合物9;9在甲醇/对甲基苯磺酸的条件下以94.6%的产率脱去羟基保护基得到(±)-Lespeflorins A3,其波谱数据与文献报道一致[5]。
中间体3经纯柱层析无法得到,需柱层析后低温重结晶才能得到[9]。
[1] Daskiewicz J B,Depeint F,Viornery L,etal.Effects of flavonoids on cell proliferation and caspase activation in a human colonic cell line HT29:An SAR study[J].J Medicine Chemical,2005,48(8):2790-2804.
[2] Comte G,Daskiewicz J B,Byet C,etal.Rearrangement of 5-O-prenyl flavones:A regioselective access to 6-C-(1,1-dimethylallyl)- and 8-C-(3,3-dimethylallyl)-flavones[J].J Medicine Chemical,2001,44:763-768.
[3] Nam,Jang J,Niamen D,etal.Prenylated flavonoids with PTP1B inhibitory activity from the root bark of eryhrina mildbraedii[J].J Nature Product,2006,69:1572-1576.
[4] Ha Rborne J B,Williams C A.Anthocyanins and other flavonoids[J].Nature Product Report,2001,18:310-333.
[5] Maya M,Hiroyuki T,Takayuki K,etal.Melanin synthesis inhibitors from Lespedeza floribunda[J].J Nat Prod,2009,72:194-203.
[6] Zhang Y H,Yang J H,Li H J,etal.First total synthesis of (±)-puyanin and (±)-4′-O-methylbonannione[J].Chin J Chem,2011,29:521-524.
[7] 杨金会,赵艳敏,计从斌.(±)-Abyssinoflavanone V的首次全合成[J].宁夏大学学报,2008,29(2):154-156.
[8] 杨金会,孟丽聪.天然产物1,3-二-(2-羟基-4-甲氧基苯基)丙烷和1,3-二-( 2,4-二羟基苯基)丙烷的合成[J].有机化学,2008,28(05):918-921.
[9] 左武标,杨金会.四个天然异戊烯基黄酮的全合成研究[J].有机化学,2012,32:2276-2282.
[10] 薛吉军.黄酮类化合物的合成[D].兰州:兰州大学,2004.
[11] Huang C S,Zhang Z,Li Y L.Total synthesis of (R,S)-sophoraflavanone C[J].J Nat Product,1998,61:1283-1285.
[12] 郭冬冬,杨金会,落俊山,等.Coryfolia D的全合成[J].合成化学,2012,20(6):701-704.
TotalSynthesisof(±)-LespeflorinsA3
FENG Yao, YANG Jin-hui, GUO Dong-dong,ZUO Wu-biao, CHENG Bing-bing, XIE Yi-min
(State Key Laboratory Cultivation Base of Natural Gas Conversion,Ningxia University,Yinchuan 750021,China)
2-Hydroxy-4-[(methoxy)methoxy]-3,5-di-(3-methylbut-2-enyl)acetophenone(4)was obtained byC-prenylation and protection of phenolic hydroxyl group from 2,4-dihydroxyacetophenon.2,2-Dimethyl-5-formyl-2H-1-benzopyran(7)was obtained byC-prenylation and catalytic cyclization from 4-hydroxybenzaldehyde.2′-Hydroxy-3′,5′-di-(3-methylbut-2-enyl)-4′-[(methoxy)methoxy]-4,5-(2,2-dimethylbenzopyran)chalcone(8)was prepared by aldol condensation reaction of 4with7.6,8-Di-(3-methylbut-2-enyl)-7-[(methoxy)methoxy]-4′,5′(2,2-dimethylbenzopyran-flavanone(9)was prepared by intramolecular Michael addition reaction of 8.The total synthesis of natural (±)-Lespeflorins A3was firstly achieved by deprotection of 9usingp-toluene sulfonic acid as the catalyst.8and9were novel compounds and the structures were characterized by1H NMR,IR and EI-MS.
Lespeflorins A3;flavanone;isoprenyl flavanone;total synthesis
2013-05-06;
2014-03-30
国家自然科学基金资助项目(21162021);教育部“新世纪优秀人才支持计划”资助项目(NCET-09-0860);宁夏自然科学基金资助项目(NZ1006)
冯尧(1989-),男,汉族,宁夏中卫人,硕士研究生,主要从事天然产物的全合成研究。
杨金会,博士,教授,Tel.095-2062246,E-mail:yang_jh@nxu.edu.cn
O625.1
A
1005-1511(2014)04-0492-04

