298.15 K时CuSO4-NiSO4-H2O三元溶液体系的活度
陈 香,刘士军,黄华强
(中南大学化学化工学院,中国 长沙 410083)
298.15 K时CuSO4-NiSO4-H2O三元溶液体系的活度
陈 香,刘士军*,黄华强
(中南大学化学化工学院,中国 长沙 410083)
用等压法测定了298.15 K时CuSO4-NiSO4-H2O溶液体系在离子强度范围为0.387 7~5.798 6 mol·kg-1内的渗透系数,用Pitzer离子相互作用模型对实验结果进行参数化研究,获得了CuSO4和NiSO4纯盐参数以及混盐参数,渗透系数的模型计算值与实验值的相对偏差为±0.03,表明Pitzer模型能较好描述298.15 K时该溶液体系的热力学性质;得到了该溶液体系中离子平均活度系数随离子强度的变化规律.
CuSO4-NiSO4-H2O体系;等压法;渗透系数;活度系数;Pitzer模型
电解质中各组分的活度是溶液体系的基本性质,对了解各组分的相互作用及发展电解质溶液理论都具有重要的作用[1-2].同时湿法冶金工艺的建立或优化也需要相关混合电解质溶液的活度性质作理论指导[3-4].
关于CuSO4或NiSO4水溶液体系的活度研究已有较多文献报道.Wetmore和Gordon[5]用电动势法测定了298.15 K时硫酸铜溶液从0.02 mol·kg-1到饱和浓度的活度系数;Robinson和Jones[6]采用等压法测定了硫酸铜(0.1 mol·kg-1~1.4 mol·kg-1)以及硫酸镍(0.1 mol·kg-1~2.6 mol·kg-1)溶液的渗透系数,并利用Randall-White[7]方程计算了其活度系数;Brown和Prue[8]采用凝固点降低法测定了稀浓度(<0.1 mol·kg-1)硫酸铜以及硫酸镍溶液的渗透系数, 讨论了硫酸盐在水溶液中的解离常数;Downes和Pitzer[9]采用等压法测定了0.117 4 mol·kg-1~1.555 9 mol·kg-1硫酸铜溶液的渗透系数,拟合获得了Pitzer模型离子作用参数.Malatesta等[10]用电动势法测定了极稀浓度(2.969×10-5mol·kg-1)至0.998 mol·kg-1的硫酸镍溶液298.15 K时的活度系数;Guendouzi等[11]采用湿度法测定了298.15 K时CuSO4及NiSO4水溶液从0.1 mol·kg-1到饱和浓度的渗透系数和离子平均活度系数,并拟合得到了Pitzer模型离子相互作用参数.其中,Robinson用等压法测定的结果与电动势法测定的结果基本一致[6],Miller[12]认为采用凝固点降低法测定的数据在低浓度时较等压法准确,Pitzer[13]发现Robinson采用等压法测定的数据较可靠,但在低浓度时存在一定的偏差.
在湿法冶金体系中,多元体系的热力学性质研究更为重要.与CuSO4或NiSO4相关的三元体系热力学性质研究已有文献报道.Downes和Pitzer[9]采用等压法测定了CuSO4-Na2SO4-H2O以及CuSO4-NaCl-H2O三元体系在298.15 K时的渗透系数和活度系数,拟合得到了混盐参数,发现随着混盐参数的加入,能减小混合体系的渗透系数计算值与实验值的偏差.Akilan[14]采用等压法测定了298.15 K时CuSO4-Na2SO4-H2O和CuSO4-MgSO4-H2O三元体系的渗透系数以及活度系数,发现CuSO4-MgSO4-H2O体系遵从Zdanovskii规则,而CuSO4-Na2SO4-H2O体系对Zdanovskii规则产生了正偏差,体系中阳离子之间存在较大的相互作用;Arvand等[15]采用电动势法测定了298.15 K时NiCl2-NiSO4-H2O体系各组分的活度系数,得到了Pitzer模型参数和Harned方程系数,并计算了其超额吉布斯自由能;姚燕和Atkinson[16]用电动势法研究CuSO4-Na2SO4-H2O体系的活度性质,得到了Pitzer模型参数和Harned方程系数;王琴萍等[17]用电动势法测定了HCl-NiSO4-H2O溶液体系中HCl的活度系数,研究表明其服从Harned规则.
本文用NaCl溶液为参比,采用等压法测定了CuSO4-NiSO4-H2O体系的渗透系数,并应用Pitzer离子相互作用模型拟合渗透系数,从而求得该溶液体系的Pitzer纯盐参数及混盐参数,获得该溶液体系渗透系数以及离子平均活度系数随离子强度的变化规律,以期为溶液热力学提供基础数据,并为铜镍湿法冶金提供指导.
1 实验部分
1.1 试剂及储备液
NaCl储备液由优级纯NaCl(Alfa Aesar化学有限公司)配制,其浓度由灼烧重量法标定, 3个平行样的质量摩尔浓度的相对偏差小于0.05%.CuSO4和NiSO4储备液分别采用优级纯CuSO4·6H2O(Alfa Aesar化学有限公司)和NiSO4·6H2O(Alfa Aesar化学有限公司)配制.铜离子浓度由碘量法标定,镍离子浓度采用EDTA溶液标定,3次平行测定结果相对误差均小于0.05%.不同浓度的实验溶液均采用质量稀释法准确称重配制.所有溶液的配制均使用二次蒸馏水, 电导率小于1×10-5S/m.
1.2 仪器设备
本次实验装置在文献[18]装置的基础上将箱体内不锈钢固定片换成紫铜固定底座,并增加了等压杯数,如图1.所有称重均采用AB265-s分析天平(Mettler Toledo仪器有限公司), 称量精度±0.01 mg.
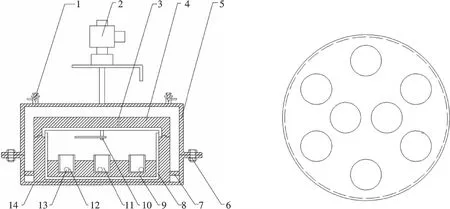
图1 等压箱和紫铜底座Fig.1 Diagram of the isopiestic apparatus and the under copper block
1.3 实验方法
实验时等压箱中两个等压杯分别放置高低浓度的NaCl参比溶液,其他6个等压杯放待测液(CuSO4和NiSO4的混合液),待测液中CuSO4的摩尔分数(YCu)为0~1之间均匀分布.等压箱放入精确控温为298.15±0.01 K恒温水浴中,等压平衡时间一般为5~12 d,两参比溶液的浓度相对偏差小于0.2%即认为已达到平衡.
2 结果与讨论
2.1 等压平衡浓度以及体系水活度和渗透系数
等压法的原理是等压箱中的各溶液在恒温及等压的环境中将达到热力学平衡,此时溶剂水具有相同的化学势,即待测溶液与参比溶液具有相同的水活度.体系等压平衡浓度列于表1, 体系水活度的计算公式为:
lnaw=Mwv*m*φ*/1 000.
(1)
式中:v*为参比溶液中1 mol溶质在水中完全电离时产生阴阳离子的物质的量之和;m*表示平衡时参比溶液溶质的质量摩尔浓度;MW为水的相对分子质量;φ*表示参比溶液渗透系数,其值根据文献[19]提供的值拟合得到,偏差小于10-4.参比溶液NaCl的渗透系数以及CuSO4-NiSO4-H2O体系的水活度列于表1.
a) including the pure salt system only.
图2 CuSO4-NiSO4-H2O体系等水活度图Fig.2 Water iso-activity lines for the CuSO4-NiSO4-H2O system at 298.15 K
CuSO4-NiSO4-H2O体系的等水活度线如图2.从图2看出,CuSO4-NiSO4-H2O三元体系水活度符合Zdanovskii规则,表明具有相同的水蒸汽压的CuSO4和NiSO4溶液形成的混合液也有相同的蒸汽压.
当待测溶液与参比溶液达到等压平衡时,待测溶液的渗透系数可由式(2)计算得到:
φ=v*m*φ*/∑mi.
(2)
式中:φ表示待测溶液的渗透系数,∑mi表示等压平衡时溶液中各物种的总质量摩尔浓度,其他物理量意义同上.
298.15 K时待测体系与参比溶液达到等压平衡后,体系CuSO4-NiSO4-H2O中不同初始浓度的待测液的实验渗透系数值列于表1,其中CuSO4以及NiSO4溶液由实验测定结果拟合的渗透系数与文献值[6, 9]有较好的一致性,结果如图3所示,进一步验证了本实验装置和方法的可靠性.

图3 CuSO4-H2O, NiSO4-H2O体系渗透系数实验值与文献值比较图Fig.3 Plots of experimental data of osmotic coefficients compared with the literature value for the pure salt at 298.15 K
2.2 溶液体系的Pitzer离子相互作用模型
对于CuSO4-H2O或NiSO4-H2O二元溶液体系, Pitzer渗透系数方程表达式为:

(3)


表2 298.15 K时CuSO4-H2O以及NiSO4-H2O体系的纯盐参数
对于CuSO4-NiSO4-H2O混合电解质体系,Pitzer渗透系数方程表达式为:
φ=1+(2mCuSO4+2mNiSO4)-1{2Ifφ+2mCuSO4(mCuSO4+mNiSO4)[BCuSO4φ+
(mCuSO4+mNiSO4)CCuSO4φ]+2mNiSO4(mCuSO4+mNiSO4)[BNiSO4φ+(mCuSO4+
mNiSO4)CNiSO4φ]+mCuSO4mNiSO4[θCu2+Ni2++(mCuSO4+mNiSO4)ψCu2+Ni2+SO42-]}.
(4)
其中,
I=4(mCuSO4+mNiSO4),
fφ=-Aφ[I1/2/(1+1.2I1/2)],
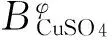

根据方程(4),由表2中纯盐参数及表1中混盐体系的渗透系数值,回归拟合得到298.15 K时CuSO4-NiSO4-H2O体系的混盐参数θCu2+Ni2+,ψCu2+Ni2+SO42-分别为0.019 63,0.000 46,拟合偏差0.004 4.
将表2中纯盐参数和混盐参数θCu2+Ni2+,ψCu2+Ni2+SO42-代入方程(4)计算该混合体系的渗透系数,所有渗透系数计算值与实验值的相对偏差在±0.03以内,表明该Pitzer模型方程可以较好地描述298.15 K时CuSO4-NiSO4-H2O体系的热力学性质.
2.3 三元溶液体系的离子平均活度系数
由Pitzer离子相互作用参数可计算单一电解质溶液以及混合电解质溶液的离子平均活度系数,其计算公式见文献[20, 22].

图4 CuSO4-NiSO4-H2O体系298.15 K时CuSO4离子平均活度 图5 CuSO4-NiSO4-H2O体系298.15 K NiSO4离子平均系数与I关系活度系数与I关系Fig.4 Plots of activity coefficients of CuSO4 vs. ionic strength at different YCu aqueous CuSO4-NiSO4-H2O at 298.15 K Fig.5 Plots of activity coefficients of NiSO4 vs. ionic strength at different YCu aqueous CuSO4-NiSO4-H2O at 298.15 K
图4及图5为三元体系中CuSO4及NiSO4的离子平均活度系数随离子强度的变化关系.二者的离子平均活度系数均随离子强度的增大而减小.相同离子强度下,两者随其摩尔分率的增大,离子平均活度系数均减小.说明在CuSO4-NiSO4-H2O体系中,随离子强度增大阴阳离子的缔合作用显著,活度系数降低.混盐体系的离子平均活度高于纯盐体系的离子平均活度,可能是混盐体系形成了三离子物(Cu2+-SO42--Ni2+),三离子物的形成促使离子对离解成自由离子,即能削弱离子缔合作用[23].对比图4和图5可见,在相同的离子强度时,NiSO4的离子平均活度系数比CuSO4的离子平均活度系数要大.由此说明,镍离子结合水的能力比铜离子强,即水化作用强,自由水分子减少,溶质的有效浓度增加,促进溶解,活度系数上升[24],硫酸镍在水中的溶解度大于硫酸铜在水中的溶解度也可说明这一点[25].
3 结论
以NaCl溶液为参比,采用等压法测定了CuSO4-H2O和NiSO4-H2O单体系的渗透系数,所得数据与文献值吻合较好,验证了本实验装置和方法的可靠性;并测定了298.15K时CuSO4-NiSO4-H2O三元体系的等压平衡浓度,水活度以及渗透系数;由单体系和三元体系的渗透系数,获得了以Pitzer方程为基础的离子作用模型的纯盐参数和混盐参数,由拟合模型参数计算的渗透系数值与实验值的偏差在±0.03以内;三元体系CuSO4-NiSO4-H2O的渗透系数随离子强度的增大呈先减小后增大的趋势,二者的离子平均活度系数都随离子强度的增大而减小.
[1] 李亚红, 高世扬. Pitzer 混合参数对 HCl-NaCl-H2O体系溶解度预测的影响[J]. 物理化学学报, 2001,17(1):91-94.
[2] CLEGG S L, SEINFELD J H, EDNEY E O. Thermodynamic modelling of aqueous aerosols containing electrolytes and dissolved organic compounds.Ⅱ.An extended Zdanovskii-Stokes-Robinson approach[J]. J Aerosol Sci, 2003,34(6):667-690.
[3] KOBYLIN P, SIPPOLA H, TASKINEN P. Thermodynamic model for acidic Ni(Ⅱ) sulfate from solubility data[J]. Calphad, 2013,40:41-47.
[4] LIU H, PAPANGELAKIS V G. Solubility of Pb(Ⅱ) and Ni(Ⅱ) in mixed sulfate-chloride solutions with the mixed solvent electrolyte model[J]. Ind Eng Chem Res, 2006,45(1):39-47.
[5] WETMORE F E W, GORDON A. The activity coefficient of copper sulphate in aqueous solution[J]. J Chem Phys, 1936,5(1):60-63.
[6] ROBINSON R A, JONES R S. The activity coefficients of some bivalent metal sulfates in aqueous solution from vapor pressure measurements[J]. J Am Chem Soc, 1936,58(6):959-961.
[7] RANDALL M, WHITE A M. The activity coefficient of electrolytes from the vapor pressure of the solvent[J]. J Am Chem Soc, 1926,48(10):2514-2517.
[8] BROWN P, PRUE J. A study of ionic association in aqueous solutions of bi-bivalent electrolytes by freezing-point measurements[J]. Proc Royal Soc London. Ser A. Math Phys Sci, 1955,232(1190):320-336.
[9] DOWNES C J, PITZER K S. Thermodynamics of electrolytes. Binary mixtures formed from aqueous NaCl, Na2SO4, CuCl2, and CuSO4, at 25 ℃[J]. J Solut Chem, 1976,5(6):389-398.
[10] MALATESTA F, CARBONARO L, FANELLI N,etal. Activity and osmotic coefficients from the Emf of liquid-membrane cells. VII: Co(ClO4)2, Ni(ClO4)2, K2SO4, CdSO4, CoSO4,and NiSO4[J]. J Solut Chem, 1999,28(5):593-619.
[11] EL GUENDOUZI M, MOUNIR A, DINANE A. Water activity, osmotic and activity coefficients of aqueous solutions of Li2SO4Na2SO4, K2SO4, (NH4)2SO4, MgSO4, MnSO4, NiSO4, CuSO4, and ZnSO4atT=298.15 K[J]. J Chem Thermodyn, 2003,35(2):209-220.
[12] MILLER D G, RARD J A, EPPSTEIN L B,etal. Mutual diffusion coefficients, electrical conductances, osmotic coefficients, and ionic transport coefficientsl ij for aqueous CuSO4at 25 ℃[J]. J Solut Chem, 1980,9(7):467-496.
[13] PITZER K S. Thermodynamic properties of aqueous solutions of bivalent sulphates[J]. J Chem Soc, Faraday Trans 2, 1972,68:101-113.
[14] AKILAN C. Thermodynamic and related studies of aqueous copper (Ⅱ) sulfate solutions[D]. Perth: Murdoch University, 2008.
[15] ARVAND M, GHALAMI-CHOOBAR B, MOGHIMI M,etal. Thermodynamic investigation of the ternary mixed electrolyte (NiCl2+ NiSO4+H2O) system by potentiometric method atT=298.15 K[J]. J Chem Thermodyn, 2009,41(8):916-922.
[16] 姚 燕. 三元体系 Na2SO4-CuSO4-H2O 25 ℃活度系数的研究[J]. 物理化学学报, 1991,7(1):57-63.
[17] 王琴萍, 吕兴梅, 陈洪涛,等. 盐酸在硫酸镍水溶液中的活度系数[J]. 物理化学学报, 2004,20(2):186-190.
[18] 宋 婷, 刘士军, 肖刘萍, 等. NaOH-NaAl(OH)4-H2O 溶液体系渗透系数的测定及离子作用模型[J]. 高等学校化学学报, 2012,33(1):114-118.
[19] HAMER W J, WU Y C. Osmotic coefficients and mean activity coefficients of uni-univalent electrolytes in water at 25 ℃[J]. J Phys Chem Ref Data, 1972,1(3):1047-1100.
[20] PITZER K S, MAYORGA G. Thermodynamics of electrolytes. Ⅲ. Activity and osmotic coefficients for 2-2 electrolytes[J]. J Solut Chem, 1974,3(7):539-546.
[21] PITZER K S, MAYORGA G. Thermodynamics of electrolytes. Ⅱ. Activity and osmotic coefficients for strong electrolytes with one or both ions univalent[J]. J Phys Chem, 1973,77(19):2300-2308.
[22] PITZER K S, KIM J J. Thermodynamics of electrolytes. Ⅳ. Activity and osmotic coefficients for mixed electrolytes[J]. J Am Chem Soc, 1974,96(18):5701-5707.
[23] 黄子卿. 电解质溶液理论导论[M]. 北京: 科学出版社, 1983.
[24] 刘 光, 邱贞花. 离子溶液物理化学[M]. 福州: 福建科学技术出版社,1988.
[25] LINKE W F, SEIDELL A. Solubilities, inorganic and metal-organic compounds: a compilation of solubility data from the periodical literature[M]. Washington, DC: American Chemical Society, 1958.
(编辑 杨春明)
Activity Coefficients of CuSO4-NiSO4-H2O System at 298.15 K
CHENXiang,LIUShi-jun*,HUANGHua-qiang
(College of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China)
The osmotic coefficients of the CuSO4-NiSO4-H2O system at 298.15 K was determined by the isopiestic method in the ion strength range from 0.387 7~5.798 6 mol/kg. The experimental data were represented by the pitzer ion-interaction model, and the Pitzer ion interaction parameters were obtained from resulting osmotic coefficients by multiple linear regression. The osmotic coefficients values determined experimentally and those calculated by the model in reasonable agreement indicated that the Pitzer model can describle the system’s thermodynamics properties well at 298.15 K. The function between acitivity coefficients and the ionic strength was studied.
CuSO4-NiSO4-H2O system; isopiestic; osmotic coefficients; acitivity coefficients; Pitzer model
2014-05-12
国家973计划资助项目(2014CB643401);国家自然科学基金重点资助项目(51134007)
*
,E-mail:liushijun@hotmail.com/shujunliu@csu.edu.cn
O642
A
1000-2537(2014)05-0043-06
- 湖南师范大学自然科学学报的其它文章
- 重阳木树皮和叶片挥发油化学成分的GC-MS分析
- Impacts of Solvent Effect on Descriptors in Density Functional Reactivity Theory: The Case of Coumarin
- Facile Synthesis of Sphere-Like NiO-CuO Composites and Their Supercapacitor Properties
- GC-MS法分析比较尿素包合物及其滤液中各种脂肪酸甲酯的质量分数
- 广义太极代数:∅R上的逻辑代数
- 带电的标量场扰动下Reissner-Nordström Anti-de Sitter黑洞的不稳定性

