手性助剂诱导催化不对称Strecker反应研究进展
唐 贝,李 锦,李高伟
(1.河南省医药学校,河南 开封 475001; 2.商丘师范学院 化学化工学院, 河南 商丘 476000)
手性助剂诱导催化不对称Strecker反应研究进展
唐 贝1*,李 锦1,李高伟2*
(1.河南省医药学校,河南 开封 475001; 2.商丘师范学院 化学化工学院, 河南 商丘 476000)
亚胺的不对称Strecker反应是合成α-氨基酸化合物的重要途径之一,一般在手性助剂的诱导下进行. 近年来,用于诱导不对称Strecker反应的各类手性助剂的研究受到广泛关注. 本文综述了α-苯乙胺、α-氨基酸、α-氨基酸衍生的酰胺、α-苯甘氨醇、亚磺酰基亚胺、糖胺、肼等七类化合物作为手性助剂在不对称Strecker反应中的应用研究现状,就该研究领域存在的问题进行了分析,并对其前景进行了展望.
手性助剂;催化;不对称Strecker反应;研究进展
手性助剂诱导的不对称合成方法是将手性助剂预先与非手性的底物相连,然后进行不对称反应得到中间产物,最后将手性助剂从中间体上切断,即可获得手性的产物分子,同时可以将手性助剂回收. 这种方法由于简单易行,又可以选择不同构型的手性助剂获得所需构型的产物分子,因而得到了广泛的应用. 1963年,HARADA首次利用(S)-α-苯乙胺为手性助剂成功地完成了不对称Strecker催化反应[1]. 此后,用于诱导不对称Strecker反应的各类手性助剂的研究引起有机化学家们的极大兴趣.
1 手性助剂诱导的不对称Strecker反应
1.1 以α-苯乙胺为手性助剂
2000年,WONG等人利用2-甲基-2-羟基丙腈作为氰基的给体进行不对称Strecker反应(图 1)[2]. 在实验过程中,他们使用(S)-苯乙胺作为手性诱导剂,成功地合成出具有重要生物学意义的糖基丙氨酸,获得较好的收率和非对映选择性.

图1 (S)-苯乙胺诱导的糖基丙氨酸的合成Fig.1 Synthesis of C-glycoalanine with (S)-PEA as the chiral inducer
2000年,MANGENEY等人发现通过向上述反应混合物中加入手性二胺和酒石酸,产物的非对映选择性得到提高(图 2)[3]. 作者对反应机理做了初步研究,猜测在该反应体系中可能是发生了自催化反应.

图2 通过加入手性二胺和酒石酸增强非对映选择性Fig.2 Enhanced diastereoselectivity by addition of chiral diamine and tartaric acid
2006年,SAIDI等人报道了一个醛与三甲基硅氰之间的不对称Strecker反应[4],该反应不需要溶剂和催化剂,使用(R)-苯乙胺为手性助剂,产物获得较高的收率和中等的d.r.值(68∶32 ~ 86∶14).
2007年,FADEL小组利用(R)-苯乙胺为手性诱导剂,找到了一个合成光学纯杂环α-氨基酸的有效方法(图 3)[5]. 值得注意的是,氰化反应这一步表现出极高的非对映选择性.

图3 以(R)-苯乙胺为手性助剂诱导的环状α-氨基酸的合成Fig.3 Synthesis of cyclic α-amino acids with (R)-PEA as the chiral auxiliary
1.2 以α-氨基酸为手性助剂
2003年,OHFUNE等人设计出一个合成β-羟基-α,α-二取代-α-氨基酸的有效方法(图 4)[6]. 依次通过以下几步完成:(1)α-酰氧基酮的合成;(2)α-酰氧基酮经分子内缩合形成一个环酮亚胺中间体;(3)氰化物与1, 4-噁嗪经不对称加成反应生成α-氨基腈;(4)α-氨基腈通过氧化反应转换成α-亚氨基腈;(5)脱去用于转移手性的氨基酸,氰基在酸性条件下水解获得产物β-羟基-α,α-二取代-α-氨基酸.
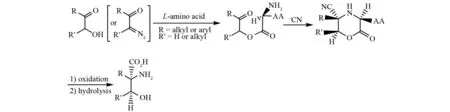
图4 以α-氨基酸为手性助剂诱导的β-羟基α-氨基酸的合成Fig.4 Synthesis of β-hydroxy α-amino acid with α-amino acid as the chiral auxiliary
1.3 以α-氨基酸衍生的酰胺为手性助剂
2001年,BROXTERMAN等人报道了一例不对称Strecker反应,在反应中他们利用(R)-甘氨酸酰胺为手性助剂,通过原位结晶诱导不对称转化过程,对产物进行选择性结晶,析出其中一个非对映异构体(图 5)[7].

图5 (R)-苯酰胺为手性助剂的不对称Strecker反应Fig.5 Diastereoselective Strecker reaction with (R)-phenylglycine amide as the chiral auxiliary
1.4 以α-苯甘氨醇为手性助剂
2001年,WARMUTH小组利用手性苯甘氨醇为手性助剂,合成出苯并环烷烃-1-氨基-1-羧酸[8]. 实验结果表明,产物的非对映选择性对反应温度和所用溶剂存在依赖性. 2004年,MA小组研究出合成α-取代或α,γ-二取代谷氨酸的一种比较实用的方法(图 6)[9]. 2006年,BRIGAUD等人利用(R)-苯甘氨醇为手性助剂有效地合成出α-三氟甲基丙氨酸(图 7)[10]. 尽管产物只得到中等的非对映选择性,但是通过色谱分离技术可以很好地获得光学纯α-氨基腈非对映体. 2008年,LIU等人利用手性苯甘氨醇作为手性助剂,合成出β,β-二氟氨基酸(图 8)[11]. 由于氰基在水解时部分产物发生外消旋化,最终只获得73%的e.e.值.

图7 利用(R)-苯甘氨醇作为手性助剂合成具有光学活性的三氟甲基α-氨基腈Fig.7 Synthesis of optically active trifluoromethyl α-amino nitriles using (R)-phenylglycinol as the auxiliary

图8 手性苯甘氨醇作为手性诱导剂合成β, β-二氟氨基酸Fig.8 Synthesis of β, β-difluoroamino acids with chiral phenylglycinol as the chiral inducer
1.5 以亚磺酰基亚胺为手性助剂
1994年,DAVIS等人首次以光学纯亚磺酰胺为手性助剂诱导不对称Strecker反应,合成出α-氨基酸,并获得较好的收率(62% ~ 78%)和中等的非对映选择性(83∶17d.r.)[12]. 两年后,他们重新改进了实验方案,利用异丙醇作为添加剂,氰化加成这一步的非对映选择性得到显著提高(93∶7d.r.)[13]. 研究推测,可能是因为异丙醇与二乙基氰化铝反应生成了一种更具有选择性的氰化物供给体,即乙基异丙基氰化铝. 此后,DAVIS小组利用该实验方案相继合成出其他不同种类的手性氨基酸[14-22].
2001年,CORDI和MABIC等人对叔丁基亚磺酰胺在不对称Strecker反应中的应用也做了详细研究[23]. 他们利用DAVIS小组建立的二乙基氰化铝/异丙醇反应体系,合成出的产物获得很好的收率(95%)和非对映选择性(93∶7d.r.).
2005年,MUKAIYAMA等人报道了另一个路易斯碱催化的不对称Strecker反应案例(图 9)[24]. 在二甲基甲酰胺/四氢呋喃(2∶1)溶剂中加入10%的醋酸铵溶液,三甲基硅氰和亚磺酰胺顺利地进行不对称Strecker反应得到相应的产物α-氨基腈.
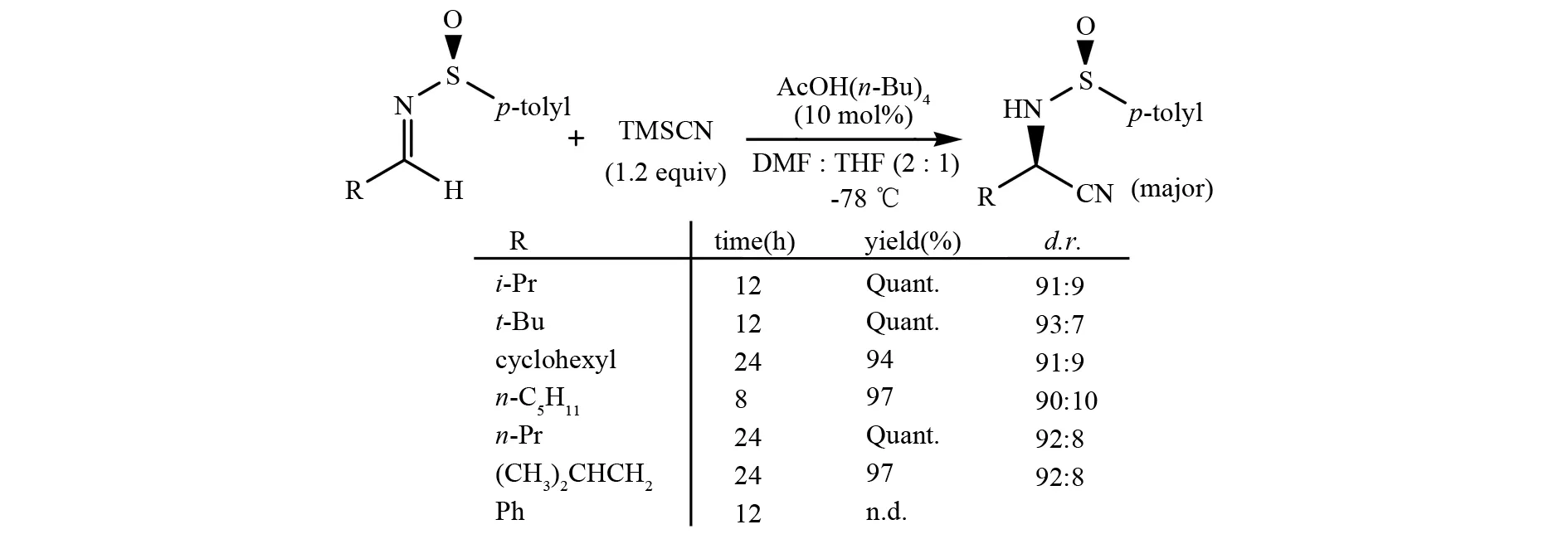
图9 四正丁基醋酸钠催化的手性亚磺酰基亚胺与TMSCN的不对称Strecker反应Fig.9 Tetra-n-butylammonium acetate catalyzed diastereoselective Strecker reaction of chiral sulfinimines and TMSCN
2006年,LU及其同事报道了一个只需要通过更换溶剂来控制的不对称Strecker反应(图 10)[25],为合成α-三氟甲基-α-氨基酸提供了简便的方法. 产物的收率高达92%,非对映选择性达99∶1,但是当溶剂改为DMF时,产物的非对映选择性只有1∶19.

图10 手性叔丁基磺酰基亚胺诱导的不对称Strecker反应Fig.10 Asymmetric Strecker reaction using chiral tert-butylsulfinamide as the chiral inducer
1.6 以糖胺为手性助剂
2004年,ZHANG课题组报道了以糖基胺为手性助剂的不对称Strecker反应(图11)[26-27],可以得到包括甘氨酸、β,γ-不饱和氨基酸在内的一系列氨基酸,产物的收率和对应选择性都很高.

图11 糖基胺诱导的不对称Strecker反应Fig.11 Asymmetric Strecker reaction using glucosylamine as the chiral auxiliary
1.7 以肼为手性助剂
2003年,ENDERS小组报道了一个利用手性肼为手性诱导剂的不对称Strecker反应案例(图 12)[28]. 在2当量的四氯化钛和4.2当量的乙醚存在下,三甲基硅氰顺利地与(S)-1-氨基-2-甲氧基甲基吡咯烷衍生出的腙进行加成,产物α-肼基腈获得高收率和非对映选择性.
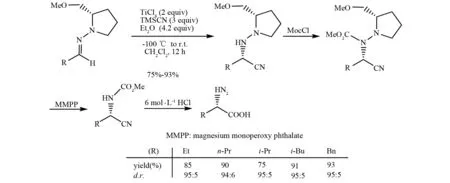
图12 (S)-1-氨基-2-甲氧基甲基-吡咯烷作为手性诱导的不对称Strecker反应Fig.12 Asymmetric Strecker reaction with the chiral hydrazine (S)-1-amino-2-methoxymethyl-pyrrolidine as the chiral inducer
2006年,FRIESTAD等人介绍了三甲基硅氰和由噁唑烷酮类化合物衍生的N-酰腙的加成反应(图 13)[29],产物的非对映选择性主要取决于噁唑烷酮上的取代基.

图13 手性噁唑烷酮衍生的N-酰腙的不对称的Strecker反应Fig.13 Asymmetric Strecker reaction of chiral oxazolidinone-derived N-acylhydrazones

图14 (2S, 5S)-1-氨基-2, 5-二苯基吡咯作为手性助剂的不对称Strecker反应Fig.14 Asymmetric Strecker reaction with (2S, 5S)-1-amino-2, 5-diphenylpyrrolidine as the chiral auxiliary
2 结论与展望
近年来,应用于不对称Strecker反应的各类手性助剂备受有机化学家们的关注,各种新型手性诱导剂不断被报道. 但目前有些手性助剂的诱导性及其使用范围等方面还有待于进一步研究. 因此设计并合成出结构新颖、诱导效能更好、应用范围更广泛的手性助剂成为今后研究的趋势. 这对于合成具有重要生物活性的氨基酸具有重要意义.
[1]HARADA K. Asymmetric synthesis ofα-amino-acids by the Strecker synthesis [J]. Nature, 1963, 200:1201.
[2]VINCENT S P, SCHLEYER A, WONG C H. Asymmetric Strecker synthesis of C-glycopep-tide [J]. J Org Chem, 2000, 65(14): 4440-4443.
[3]LECLERC E, MANGENEY P, HENRYON V. Enhancement of the diastereoselectivity in the addition of trimethylsilyl cyanide to chiral aldimines by catalysis with a chiral 1, 2-diamine: unexpected mechanistic results [J]. Tetrahedron: Asymmetry, 2000, 11(17): 3471-3474.
[4]KAZEMEINI A, AZIZI N, SAIDI M R, et al. One-pot diastereoselective synthesis ofα-aminonitriles from aldehydes, chiral amines, and trimethylsilyl cyanide under solvent-free conditions [J]. Russ J Org Chem, 2006, 42(1): 48-51.
[5]FADEL A, LAHRACHE N. An efficient synthesis of enantiomerically pure (R)-pipecolic acid, (S)-proline, and their N-alkylated derivatives [J]. J Org Chem, 2007, 72(5): 1780-1784.
[6]OHFUNE Y, SHINADA T. Enantio-and diastereoselective construction ofα,α-disubstitut-edα-amino acids for the synthesis of biologically active compounds [J]. Eur J Org Chem, 2005, 2005(24): 5127-5143.
[7]BOESTEN W H J, SEERDEN J P G, DE LANGE B, et al. Asymmetric strecker synthesis ofα-amino acids via a crystallization-induced asymmetric transformation using (R)-phenylglycine amide as chiral auxiliary [J]. Org Lett, 2001, 3(8): 1121-1124.
[8]WARMUTH R, MUNSCH T E, STALKER R A. Enantioselective synthesis of benzocyclicα,α-dialkyl-amino acids: new insight into the solvent dependent stereoselectivity of the TMSCN addition to phenylglycinol derived imines [J]. Tetrahedron, 2001, 57(30): 6383-6397.
[9]TANG Guizhi, TIAN Hongqi, MA Dawei. Asymmetric Strecker reaction ofγ-keto acids. Facile entry toα-substituted andα,γ-disubstituted glutamic acids [J]. Tetrahedron, 2004, 60(46): 10547-10552.
[10]HUGUENOT F, BRIGAUD T. Concise synthesis of enantiopureα-trifluoromethyl alanines, diamines, and amino alcohols via the Strecker-type reaction [J]. J Org Chem, 2006, 71(18): 7075-7078.
[11]WANG Xiaojin, ZHANG Fan, LIU Jintao. Asymmetric synthesis ofβ,β-difluoroamino acids via cross-coupling and Strecker reactions [J]. Tetrahedron, 2008, 64(8): 1731-1735.
[12]DAVIS F A, REDDY R E, PORTONOVO P S. Asymmetric strecker synthesis using enantio-pure sulfinimines: A convenient synthesis ofα-amino acids [J]. Tetrahedron Lett. 1994, 35(50): 9351-9354.
[13]DAVIS F A, PORTONOVO P S, REDDY R E, et al. Asymmetric Strecker synthesis using enantiopure sulfinimines and diethylaluminum cyanide: the alcohol effect [J]. J Org Chem,1996, 61(2): 440-441.
[14]DAVIS F A, SRIRAJAN V, FANELLI D L, et al. Concise asymmetric synthesis ofβ-hydroxyα-amino acids using the sulfinimine-mediated asymmetric strecker synthesis: phenyl-serine andβ-hydroxyleucine [J]. J Org Chem, 2000, 65(22): 7663-7666.
[15]DAVIS F A, PRASAD K R, CARROLL P J. Asymmetric synthesis of polyhydroxyα-amino acids with the sulfin imine-mediated asymmetric Strecker reaction: 2-amino 2-deoxyl-xylono-1,5-lactone (poly-oxamic acid lactone) [J]. J Org Chem, 2002, 67(22): 7802-7806.
[16]DAVIS F A, FANELLI D L. Sulfinimine-mediated asymmetric synthesis of (R)-(4-methoxy-3,5-dihydroxyphenyl)glycine: The central amino acid of vancomycin and related agents [J]. J Org Chem, 1998, 63(6): 1981-1985.
[17]DAVIS F A, SRIRAJAN V, TITUS D D. Efficient asymmetric synthesis ofβ-fluoroα-amino acids [J]. J Org Chem, 1999, 64(18): 6931-6934.
[18]DAVIS F A, SRIRAJAN V. Asymmetric synthesis of (2S,6S)-andmeso-(2S,6R)-di-aminopimelic acids from enantiopure bis(sulfinimines) [J]. J Org Chem, 2000, 65(10): 3248-3251.
[19]DAVIS F A. Adventures in sulfur-nitrogen chemistry [J]. J Org Chem, 2006, 71 (24): 8993-9003.
[20]ZHOU Ping, CHEN Bangchi, DAVIS F A. Recent advances in asymmetric reactions using sulfinimines (N-sulfinyl imines) [J]. Tetrahedron, 2004, 60(37): 8003-8030.
[21]MORTON D, STOCKMAN R A. Chiral non-racemic sulfinimines: versatile reagents for asymme-tric synthesis [J]. Tetrahedron, 2006, 62(38): 8869-8905.
[22]DAVIS F A, LEE S, ZHANG Huiming, et al. Applications of the sulfinimine-mediated asymmetric strecker synthesis to the synthesis ofα-alkylα-amino acids [J]. J Org Chem, 2000, 65(25): 8704-8708.
[23]MABIC S, CORDI A A. Synthesis of enantiomerically pure ethylenediamines from chiral sulfinimines: a new twist to the Strecker reaction [J]. Tetrahedron, 2001, 57(42): 8861-8866.
[24]TAKAHASHI E, FUJISAWA H, YANAI T, et al. Lewis base-catalyzed diastereoselective Strecker-type reaction between trimethylsilyl cyanide and chiral sulfinimines [J]. Chem Lett, 2005, 34(4): 604-605.
[25]WANG Hua, ZHAO Xiaoming, LU Long, et al. Solvent-controlled asymmetric strecker reaction: stereoselective synthesis ofα-trifluoromethylatedα-amino acids [J]. Org Lett, 2006, 8(7): 1379-1381.
[26]ZHOU Guobin, ZHENG Weixin, ZHANG Pengfei, et al. Practical stereo-and regio-selective, copper(I)-promoted Strecker synthesis of sugar-modifiedα,β-unsaturated imines [J]. Helv Chim Acta, 2006, 89(3): 520-526.
[27]ZHOU Guobin, ZHANG Pengfei, PAN Yuanjiang. Studies on stereoselective synthesis of phenylglycine usingD-glucopyranosylimine as chiral template [J]. Chem J Internet, 2004, 6: 85.
[28]ENDERS D, MASER M. Asymmetric Strecker synthesis by addition of trimethylsilyl cyanide to aldehyde SAMP-hydrazones [J]. Tetrahedron Lett, 2003, 44(46): 8479-8481.
[29]DING Hui, FRIESTAD G K. Strecker reactions of chiralN-acylhydrazones [J]. Hererocycles, 2006, 70(1): 185-199.
ResearchprogressincatalyticasymmetricStreckerreaction
inducedbychiralauxiliaries
TANG Bei1*, LI Jin1, LI Gaowei2*
(1.HenanPharmaceduticalSchool,Kaifeng475001,Henan,China;
2.SchoolofChemistryandChemicalEngineering,ShangqiuNormalUniversity,Shangqiu476000,Henan,China)
Asymmetric Strecker reaction of imines is one of the major synthesis routes to synthesizingα-amino acid compounds, and it is usually conducted under the induction of chiral auxiliaries. In recent years, chiral auxiliaries used to induce asymmetric Strecker reaction have been extensively focused on. This review highlights the research situation about the applications of seven kinds of chiral auxiliaries includingα-phenethylamine,α-amino acid, amide compound derivatives ofα-amino acid,α-phenylglycinol, sulfenic acid amide, glycosylamine and hydrazine in asymmetric Strecker reaction. Moreover, the problems existing in this research field are analyzed, and the prospect of this research field is discussed.
chiral auxiliaries; catalysis; asymmetric Strecker reaction; research progress
2013-12-03.
河南省教育厅科学技术研究重点项目(13A150835, 13B150189) .
唐 贝(1984—),女,助教,从事不对称合成及催化的研究.*
, E-mail: tangbei1125@163.com.
TG 162.83
A
1008-1011(2014)03-0323-08