1,25-二羟维生素D3联合塞莱昔布对胃癌细胞株SGC-7901凋亡的影响
彭昌能 李国庆 谷 苗
胃癌是最常见的恶性肿瘤之一,在我国胃癌的发病率居消化道恶性肿瘤的第1位。在胃癌患者的化疗中,适量联合使用药物,通过协同效应作用于肿瘤细胞,减少其临床用药剂量,降低其毒不良反应,一直是肿瘤药物治疗的研究热点之一。
大量的体内外研究表明,维生素D3抑制胃癌等多种肿瘤的机制可能包括以下几个方面:①通过抑制β-钙黏蛋白(β-catenin)诱导的转录,上调 P21、P27蛋白的表达从而诱导肿瘤细胞分化及抗增殖[1];②下调Bcl-2和Bcl-x1的表达,从而上调前凋亡蛋白Bax和Bak的表达诱导肿瘤细胞凋亡,其中Bcl-2在维生素D诱导凋亡中起核心作用[2];③通过上调PTEN基因表达诱导肿瘤细胞凋亡[3]。环氧合酶-2(cyclooxygenase-2,COX-2)被认为与肿瘤的发生、发展具有重要的相关性,因而备受关注[4,5]。COX-2并不直接参与肿瘤的形成,而是通过其催化产物经多种途径促进肿瘤的发生发展。Greenspan等[6]在体外研究选择性COX-2抑制剂对结肠癌细胞生长作用时,发现COX-2的表达的同时Bcl-2的表达也上调,可促进肿瘤细胞的增殖并抑制凋亡。Liu等[7]研究显示COX-2表达增高可引起Bcl-2过表达,降低E-钙黏蛋白活性,抑制细胞凋亡,从而导致胃肠道肿瘤的发生。本研究通过胃癌细胞体外培养,初步探讨1,25-二羟维生素D3与特异性COX-2抑制剂塞来昔布对胃癌的增殖及凋亡的影响,以及影响凋亡的可能机制,为1,25-二羟维生素D3和塞莱昔布应用于临床奠定理论基础。
材料与方法
1.主要试剂:1,25-二羟维生素 D3购自 Sigma公司;CELE购自大连辉瑞制药有限公司;Bcl-2、Bax鼠单抗购自福州迈新公司;羊抗小鼠二抗购自北京中杉金桥公司产品;吖啶橙购自福州迈新公司。
2.细胞株:人胃癌细胞株SGC-7901购自中南大学湘雅医学院细胞中心,本实验室保存,按细胞培养常规方法培养。
3.方法:(1)经预实验MTT法检测VitD3和CELE联用对SGC-7901细胞增殖的抑制作用,笔者选择了1×10-7mol/L VitD3、2×10-5mol/LCELE单用或联用作用于 SGC-7901细胞,用于实验研究(细胞形态学检查、Western blot)。实验分组:①对照组;②VitD3组;③CELE组;④VitD3组+CELE组,每组设6个复孔,分别加入终浓度为1×10-7mol/L VitD3、2×10-5mol/LCELE 单用或联用,无血清培养 24、48、72h,对照组不加药。(2)光镜下细胞形态的观察:细胞接种于6孔板中,观察单药组(2×10-5mol/LCELE 组、10-7mol/L VitD3组),联合组(10-7mol/L VitD3+2×10-5mol/LCELE组)处理细胞48h后,倒置显微镜下用100×摄片,观察各组细胞形态。(3)荧光显微镜下观察细胞的凋亡:收集以单药组(2×10-5mol/LCELE 组、10-7mol/L VitD3组),联合组(10-7mol/L VitD3+2×10-5mol/LCELE组)处理细胞48h后,吖啶橙溶液染色,在荧光显微镜下用400×摄片,观察凋亡细胞形态。(4)Western blot法分析 Bcl-2、Bax蛋白:用 Western blot分析了 SGC-7901细胞经2×10-5mol/L CELE、1×10-7mol/L VitD3单独及联合作用处理48h后Bcl-2、Bax蛋白的表达情况(实验重复3次)。对各个实验组进行不同处理并收集各个处理组细胞,按照标准程序进行Western blot,检测不同处理组Bcl-2、Bax蛋白的表达情况。
4.统计学方法:数据的统计学处理采用统计软件SPSS 13.0,统计学分析方法采用单因素方差(ANOVA)分析,P<0.05表示差异有统计学意义。
结 果
1.光镜下细胞形态观察:由图1可以看出未含药物的对照组处理的细胞轮廓清晰,可见细胞贴壁生长、连接紧密、活力旺盛,未见悬浮细胞。经10-7mol/L VitD3组、2 ×10-5mol/L CELE 组、10-7mol/L VitD3+2×10-5mol/LCELE联合组处理胃癌细胞SGC-7901 48h后,可见细胞体积缩小,贴壁生长的细胞数量减少,细胞间可见拉丝现象,可见部分悬浮的细胞,在10-7VitD3+2×10-5mol/L CELE 联合组处理的细胞大都脱落,悬浮于培养液中,而且细胞数量明显减少,几乎不见贴壁生长的细胞,实验结果从形态学上证实VitD3+CELE联合组对SGC7901细胞的生长抑制明显。

图1 倒置显微镜下细胞形态观察(×100)
2.荧光显微镜下观察细胞凋亡:从实验结果图片(图2)可以看出对照组的细胞核完整,染色质着绿色,经 10-7mmol/L VitD3组、2 × 10-5mmol/LCELE组、10-7mmol/L VitD3+2 ×10-5mmol/L CELE 作用48h后可见凋亡细胞,形态不整变形的细胞,染色加深不均匀,细胞体积缩小,核染色质着橘黄色,可见部分碎裂的细胞以及凋亡小体,而经联合组(10-7mmol/L VitD3+2×10-5mmol/L CELE)处理的细胞则可以看到明显的凋亡小体及细胞碎裂,从形态学上证实VitD3、CELE、VitD3联合CELE诱导 SGC7901细胞凋亡的作用。

图2 荧光显微镜下观察细胞凋亡(×400)
3.VitD3、CELE单独及联合对SGC-7901细胞中Bcl-2、Bax蛋白表达的影响:读取各实验组Bcl-2、Bax和β-actin的灰度比值,以 Bcl-2、Bax与 βactin的灰度比值进行相对半定量分析(图3、图4)。Western blot实验结果显示VitD3、CELE单独及联合对SGC-7901细胞处理48h后,细胞中Bcl-2蛋白的表达明显减弱,Bax蛋白的表达明显增强,Bcl-2/Bax的蛋白比值降低,与对照组相比有统计学差异(P<0.05),联合用药组与各单用药组相比有统计学差异(P <0.05)。

图3 VitD3、CELE单独及联合对SGC-7901细胞中Bcl-2、Bax蛋白表达的影响
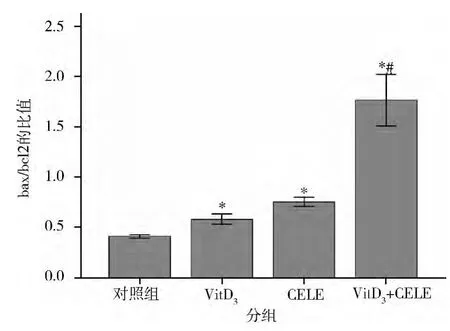
图4 VitD3、CELE单独及联合对SGC-7901细胞中Bax/Bcl-2蛋白比值表达的影响
讨 论
各种环境因素(包括生理的或者病理的)刺激细胞时均可能诱发细胞凋亡,与细胞坏死不同,它是细胞生理性死亡形式,在非邻近细胞间发生,通常不伴有炎症,凋亡的细胞在形态上表现为核浓缩、染色体断裂、细胞体积缩小、以及出现凋亡小体,最后凋亡小体被吞噬细胞清除。细胞增生与细胞凋亡是两个相反的生理过程。在正常情况下,两者都有严密的调控机制,以保证胚胎与胎儿发育,个体成长及成体中新生的细胞替代衰老、死亡的细胞,正常发育与病理增生、细胞毒细胞对靶细胞的攻击、以及恶性肿瘤的自发性退变等[8]。近年来,由于发现细胞凋亡与肿瘤发生有密切关系,因而当前细胞生物学中的关于细胞凋亡与肿瘤的研究已经成为一个热点。
目前,实验室检测细胞凋亡的手段主要包括细胞凋亡的生物化学观察和形态学特征观察,它们分别在体外通过定量以及定性两个方面对细胞凋亡进行研究。细胞凋亡是最常见及最重要的细胞生理性死亡类型,在凋亡过程中具有明显的形态学与生化特征[9,10]。其中判定发生细胞凋亡的重要依据之一是通过观察细胞形态学的改变[11]。笔者采用光镜(×100)下和荧光显微镜(×400)下观察。光镜下对照组的胃癌细胞贴壁生长良好,呈多角型,细胞轮廓清晰,细胞间连接紧密,经1×10-7mmol/L VitD3作用后,细胞生长受到抑制,部分细胞体积缩小,细胞中颗粒状物质增多,部分固缩的细胞悬浮于培养液中,经2×10-5mmol/L CELE作用后,细胞体积缩小,固缩状的圆形细胞明显增多且可见部分碎裂死亡的细胞,经1×10-7mmol/L VitD3与2×10-5mmol/L CELE 联合作用48h后,大量细胞从瓶壁脱落悬浮与培养液中,几乎不见正常形态及贴壁细胞,多数为固缩成圆形或者多角形不规则碎裂死亡的细胞。实验结果从形态学上证实VitD3、CELE对胃癌细胞生长均有抑制作用且联合用药作用更为明显,笔者的实验观察结果与Hehner等[12]的实验研究相一致。在荧光显微镜下观察,吖啶橙可透过正常细胞膜,使细胞核呈绿色或黄绿色均匀荧光;而在凋亡细胞中,因染色质固缩或断裂为大小不等的片段,形成凋亡小体。吖啶橙使其染上致密浓染的黄绿色荧光,或黄绿色碎片颗粒;而坏死细胞黄荧光减弱甚至消失。研究显示在荧光显微镜下,对照组胃癌细胞大小一致,细胞核呈均匀绿色荧光,而经VitD3和CELE单独及联合处理后出现凋亡细胞,荧光显微镜下表现为细胞染色不均匀,核呈圆形或者固缩状、团块状且核染色明显增强,可见黄绿色凋亡小体,凋亡小体是有膜包围的含有核和细胞质碎片的小体,是凋亡细胞的特征性形态学改变[13]。笔者的结果从形态学上证实了VitD3和CELE对胃癌细胞的有诱导凋亡作用,且两药联合作用更为明显。
Bcl-2 家族中有促凋亡成员 Bax、Bak、Bid等,还有抗凋亡成员Bcl-2、Bcl-XL等。Bcl-2与 Bax在肿瘤细胞凋亡中的调控作用正好相反,Bcl-2的上调抑制细胞凋亡,而 Bax的上调则促进凋亡[14,15]。Bax存在细胞质中,它可形成同源二聚体或者与Bcl-2形成异源二聚体。当细胞内Bcl-2表达增多时,可以明显增多Bcl-2与Bax异源二聚体的形成,则导致细胞凋亡减弱。而当细胞内Bax表达增多时,可以明显增加Bax自身形成的同源二聚体,则细胞凋亡增强。因此Bax/Bcl-2比值是决定细胞凋亡的重要原因。有大量实验表明1,25(OH)2D3有加强多种化疗药物抑制肿瘤细胞增殖以及促进细胞凋亡的作用,并减少后者的不良反应。研究发现维生素D能够诱导胃癌细胞凋亡,且维生素D刺激处理增强HDAC抑制剂如TSA/NaBu以及甲基化酶抑制剂5-Aza诱导的细胞凋亡。也有研究表明VitD3能够增强COX-2抑制剂抑制乳腺癌、前列腺癌等多种细胞的增生,促进细胞凋亡。众多体内外研究均已表明COX-2可以增加Bcl-2表达,减少凋亡,而COX-2选择性抑制剂塞来昔布可以下调Bcl-2的表达促进凋亡。但其具体的凋亡机制尚不明了,为进一步探讨VitD3联合CELE协同作用的机制,应用Western blot法检测对照组SGC-7901细胞和VitD3、CELE单独及联合处理48h后的SGC-7901细胞内Bcl-2、Bax蛋白表达情况,实验结果表明显示,VitD3与CELE能促进胃癌细胞凋亡,同时可检测到Bcl-2表达的下调,Bax表达的上调,联合用药组可以更明显的抑制Bcl-2表达。因此VitD3联合CELE促进胃癌细胞凋亡的可能作用机制之一为通过下调Bcl-2的表达,上调Bax的表达而实现的。且两者联用可协同抑制Bcl-2蛋白表达,改善Bcl-2/Bax的平衡,从而促进胃癌细胞凋亡。由此推测,VitD3、CELE抑制了Bcl-2的活性,而增强了Bax的表达量,从而两者联用在质和量两方面更加有效地阻断了Bcl-2抑制胃癌凋亡的作用,改善了Bcl-2/Bax的平衡,从而使两药发挥了协同效应。
由于时间、经费和实验条件的制约,本研究存在一些需要进一步完善的地方,VitD3、CELE可协同促进胃癌细胞凋亡的作用,其机制中COX-2、Bcl-2和Bax 3者之间的关系,可行RT-PCR和Westernblot法做进一步的研究。在体内两药联用的最佳作用浓度可行动物实验进一步研究。
1 Pendas-Franco N.Vitamin D and wnt/β -catenin pathway in colon cancer:role and regulation of DICKKOPF genes[J].Anticancer Res,2008,25(5A):2613-2623
2 Guzey M,Kilada S,Reed JC.Apoptosis induction by 1alpha,25 - di-hydroxyvitamin D3 in prostate cancer[J].Mol CaIlcer Ther,2002,I(9):667
3 Pan L,Matloob AF,Du J,et al.Vitamin D stimulates apoptosis in gastric c-ancer cell in synergy with trichostatinA/sodium butyrate-induced and 5-aza-2-deoxycytidine-induced PTEN upregulation[J].FEBS,2010,277(4):989 -999
4 Mann JR,DuBois RN.Cyclooxygenase-2 and gastrointestinal cancer[J].Cancer J,2004,10(3):145 -152
5 Temraz S,Mukherji D,Shamseddine A.Potential targets for colorectal cancer prevention[J].Int J Mol Sci,2013,14(9):17279 - 17303
6 Greenspan EJ,Madigan JP,Boardman LA,et al.Ibuprofen inhibits activation of nuclear{beta}-catenin in human colon adenomas and induces the phosphorylation of GSK -3{beta}[J].Cancer Prev Res(Phila),2011,4(1):161 -171
7 Liu H,Huang P,Xu X,et al.Anticancer effect of celecoxib via COX -2 dependent and independent mechanisms in human gastric cancers cells[J].Dig Dis Sci,2009,54(7):1418 - 1424
8 Nakagawa K,Kawaura A,Kato S,et al.1 Alpha,25 - dihydroxyvitamin D(3)is a preventive factor in the metastasis of lung caneer[J].Careinogenesis,2005,26(2):429 -440
9 Gavrilov V,Steiner M,Shany S.The combined treatment of 1,25 -dihydroxyvitamin D3and a non-steroid anti-inflammatory drug is highly effectivein suppressing prostate cancer cell line(LNCaP)growth[J].Anticancer Res,2005,25(5):3425 -3429
10 Gramoun A,Shorey S,Bashutski JD,et al.Effects of vitaxin,a no -veltherapeutic in trial for metastatic bone tumors,on osteoclast func -lions invitro[J].J Cell Biochem,2007,102(2):341 -352
11 Pelczynska M,wietrzyk J,Jamszewicz I,et al.Correlation between V -DR expression and antiproliferative activity of vitamin D3compounds in combi- nation with cytostatics[J].Anticancer Res,2005,25(3B):2235-2240
12 Ting HJ,Hsu J,Bao BY,et al.Docetaxel- induced growth inhibition a-nd apoptosis in andmgen independent pmstate cancer cells are enhanced by lal- pha,25 - dihydroxyvitamin D3[J].Cancer Lett,2007,247(1):122-129
13 Palanivel K,Kanimozhi V,Kadalmani B,et al.Verrucarin A,a protein synthesis inhibitor,induces growth inhibition and apoptosis in breast cancer cell lines MDA -MB -231 and T47D[J].Biote chnol Lett,2013,35(9):1395 -1403
14 Lu HF,Sue CC,Yu CS,et al.Diallyl disulfide induced apoptosis undergo caspase-3 activity in human bladder cancer T24 cells Food[J].Chem Toxicol,2004,42(10):1543 -1552
15 Pan L,Matloob AF,Du J,et al.Vitamin D stimulates apoptosis in gastric c-ancer cell in synergy with trichostatinA/sodium butyrate-induced and 5-aza-2-deoxycytidine-induced PTEN upregulation[J].FEBS,2010,277(4):989 -999

