胃癌中组织蛋白酶D和C-met的表达及对血管生成的作用
王春贵
(内蒙古民族大学医学院,内蒙古 通辽 028000)
CD105作为与血管内皮细胞增生有关的抗原,是转化生长因子(TGF)-β受体复合物之一,可以诱导缺氧的蛋白。CD105也能标记血管内皮细胞,尤其是对肿瘤生长时新生血管内皮细胞标记的特异性强。组织蛋白酶(Cath)-D是一种水解酶,可以催化底物。近年相关研究认为其与肿瘤血管生成相关〔1,2〕。肝细胞生长因子受体(C-met)可以介导肝细胞生长因子(HGF)发生的细胞信号传递和相关的生物学作用,在组织形态的分化及肿瘤进展中具有重要作用〔3〕。本文关注Cath-D和C-met在胃癌中的作用,研究二者的协同作用及对CD105阳性的血管生成的作用。
1 材料与方法
1.1一般资料 2011年6月至2013年5月通辽市科尔沁区第一人民医院行胃癌根治手术的患者78例作为观察组,其中男40例,女38例,年龄53~72(平均64.4)岁。纳入均经病理主治医师确诊,并符合WHO的诊断标准。收集切端经病理证实为正常胃黏膜组织62例作为对照组,其中男32例,女30例,年龄53~70(平均65.1)岁。两组一般临床资料无明显差别(P>0.05),具有可比性。
1.2Cath-D、C-met和CD105蛋白检测 Cath-D、C-met和CD105蛋白均购自福州迈新生物工程公司。检测应用免疫组化SP法,DAB染色,均由实验室技师操作,严格质控。
1.3结果判定标准 Cath-D、C-met阳性部位均定位于细胞质中,以出现棕黄色颗粒为阳性细胞,Cath-D、C-met计算阳性率,以阳性率≥25%为阳性,以阳性率<25%为阴性。CD105以细胞质呈棕黄色颗粒为阳性反应细胞,标记CD105阳性的微血管密度(MVD)值,确定黄色的内皮细胞或细胞丛为一个血管,只要结构不相连,其分支结构也作为一个血管计数。选取5个400倍视野内的微血管数取其平均值,定为MVD。
1.4统计学方法 采用SAS6.12软件进行χ2检验、t检验和线性相关分析。
2 结 果
2.1Cath-D、C-met和MVD在观察组与对照组中表达阳性率的比较 Cath-D、C-met的阳性率和MVD在观察组中明显高于对照组(P<0.05),见表1。
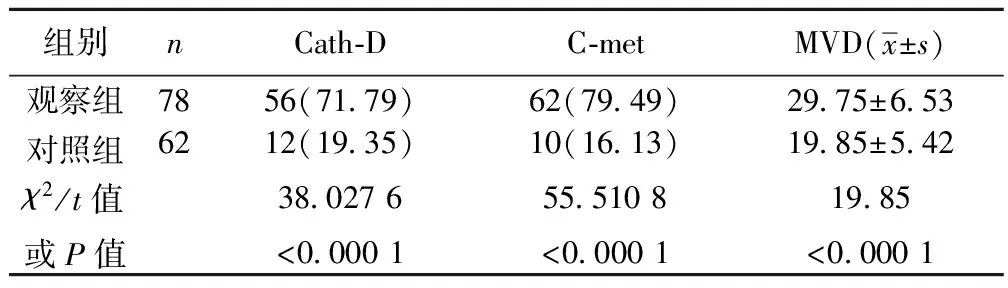
表1 Cath-D、C-met和MVD在两组中表达的比较〔n(%)〕
2.2观察组中Cath-D、C-met和MVD在不同临床病理特征中表达的比较 观察组中Cath-D、C-met阳性率和MVD均与肿瘤的浸润深度、临床分期相关,而Cath-D、C-met表达的阳性率与淋巴结转移、分化程度相关。Cath-D、C-met和MVD均与Ki67表达的增殖指数无关,见表2。
2.3观察组中Cath-D、C-met和MVD表达的相关性分析 观察组中Cath-D和C-met(r=0.45,P=0.025 4)、Cath-D和MVD(r=0.54,P=0.005 6)、C-met和MVD(r=0.52,P=0.008 0)之间具有正相关性。
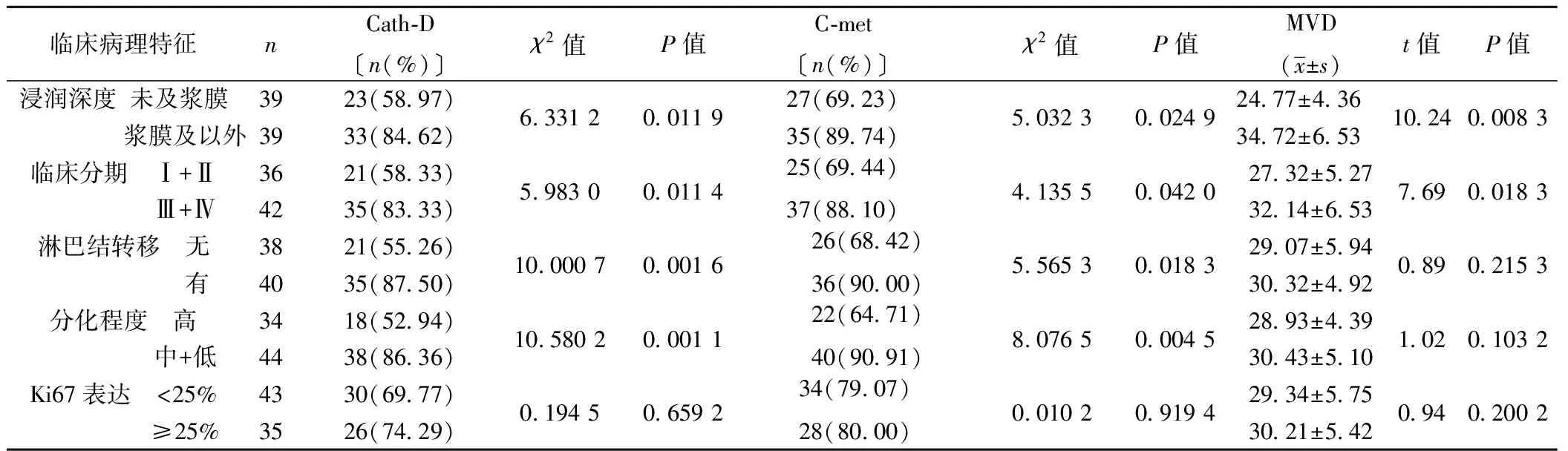
表2 观察组中Cath-D、C-met阳性表达和MVD在不同临床病理特征中表达的比较〔n(%)〕
3 讨 论
胃癌发展过程中生物学行为出现明显的变化,在此过程中出现多种蛋白的表达异常。肿瘤血管生成是重要的生物学行为,尤其是肿瘤迅速生长的时期,此时肿瘤常较小,血管生长活跃。当肿瘤增长的速度超过其脉管系统的蔓延能力时,此时相关缺氧诱导因子调控的蛋白表达增强活力,使适应缺氧环境的肿瘤细胞表型更容易存活并为了存活而更易获得侵袭转移的潜能。而Cath-D是具有肽链内切酶活性的蛋白,也是在缺氧时诱导产生的蛋白之一,Cath-D高表达时不仅可以调节肿瘤的转移,还可以调节肿瘤脉管生成。也有人认为在肿瘤进展过程中Cath-D活化,可以引起肿瘤细胞浸润和侵袭能力增强〔4,5〕。C-met是酪氨酸蛋白激酶家族成员,可以调控侵袭性生长肿瘤的遗传程序。C-met还可以激活蛋白激酶结构域中的酪氨酸蛋白激酶(pTK),导致丝裂原活化蛋白激酶发生磷酸化后有效地上调尿纤溶酶原激活物(u-PA),引起一系列的生物反应,并可以诱导肿瘤发生转移〔6〕。C-met具有血管生成的作用,主要是通过自分泌和旁分泌的形式刺激血管内皮细胞的增生〔7〕。
本实验提示Cath-D、C-met均为促进肿瘤发生的重要诱导因素。即两种蛋白参与肿瘤的生长、淋巴结转移及肿瘤发生过程中的分化过程。本实验提示Cath-D、C-met对CD105阳性的血管生成有明显的促进作用,即Cath-D、C-met可以介导肿瘤的血管生成。在肿瘤发生和进展中,Cath-D不仅通过促进癌基因来加速癌的进展,还能间接促进肿瘤内部脉管生成,使癌组织的营养供应丰富,肿瘤的生长加速。Cath-D、C-met可以引起肿瘤细胞分泌多种成血管信号时,肿瘤血管可以由周围正常组织的固有血管向肿瘤组织向内延伸而成,也可以通过内皮细胞前体细胞分化后形成内皮依赖性血管,此时血管生成加快,肿瘤细胞生长加速,肿瘤体积增大〔8,9〕。
4 参考文献
1刘爱东, 庞久玲, 刘士生. 胃癌中基质金属蛋白酶-9和CD105表达关系的研究〔J〕. 中国老年学杂志, 2009; 29(7): 886-7.
2刘 驰. 组织蛋白酶-D与血管内皮生长因在肝细胞癌中的表达〔J〕. 中国老年学杂志, 2012; 32(1): 59-60.
3Strohmeyer D, Strauss F, Rössing C. Expression of bFGF, VEGF and c-met and their correlation with microvessel density and progression in prostate carcinoma〔J〕. Anticancer Res, 2004, 24(3a): 1797-804.
4张 凡, 常永霞. 小鼠黑色素移植瘤血管生成拟态CD31、CD34、组织蛋白酶D表达意义〔J〕. 中国老年学杂志, 2010; 30(15): 2189-91.
5唐建建, 姜 曙, 毛伯镛. 组织蛋白酶B表达与胶质瘤恶性程度和血管生成的关系〔J〕. 四川大学学报(医学版), 2006; 37(2): 212-4.
6Kim YJ, Go H, Wu HG,etal. Immunohistochemical study identifying prognostic biomolecular markers in nasopharyngeal carcinoma treated by radiotherapy〔J〕. Head Neck, 2011; 33(10): 1458-66.
7张 敏, 雷志敏, 闫国胜, 等. HGF/C-met、VEGF和uPA在口腔鳞癌组织中的表达及意义〔J〕. 临床口腔医学杂志, 2010; 26(1): 8-10.
8Pizarro-Cerdá J, Jonquières R, Gouin E. Distinct protein patterns associated with Listeria monocytogenes InlA- or InlB-phagosomes〔J〕. Cell Microbiol, 2002; 4(2): 101-15.
9韩瑞珠, 李 鹏, 李晓丹, 等. E-钙黏蛋白和组织蛋白酶D与血管内皮生长因子在喉鳞癌转移中的作用〔J〕. 中国耳鼻咽喉头颈外科, 2005; 12(2): 77-9.

