eNOS、ACE基因多态性与代谢综合征的相关性
刘 丹 胡 松 赵吉顺 尹燕凤 毛拥军
(山东外贸职业学院,山东 青岛 266000)
代谢综合征(MS)是一组以代谢紊乱为主要特征的症候群,主要表现:腹型(或内脏型)肥胖、胰岛素抵抗(葡萄糖耐受不良)、特征性血脂异常〔低高密度脂蛋白(HDL-C)血症,高甘油三酯(TG)血症〕、高尿酸(UA)血症、高血压。其中,高血压是MS最典型特征,据报道超过1/3高血压患者罹患有MS〔1〕。高血压已经成为MS患者逐渐增加的心血管事件的独立危险因素〔2〕,是血压平稳MS患者的2倍〔3〕。遗传学的进步,人们发现许多疾病的机制由多个基因和信号通路参与并相互作用;随着基因图谱的完成,运用遗传学探讨疾病的发病机制与流行病学特征成为可能。本研究通过基因芯片技术检测eNOS(G894T)基因多态性与ACE(D/I)多态性,评估基因多态性与老年原发性高血压患者MS的相关性。
1 对象与方法
1.1入选标准及排除标准 入选标准:2010年1月至2012年6月,于青岛大学医学院附属医院特需保健科就诊,60岁以上的原发性高血压患者。排除标准:排除继发性高血压、严重心脑血管疾病、心功能Ⅲ~Ⅳ级(NYHA分级)、左室射血分数(LVEF)<50%、心脏瓣膜病、肝肾衰竭、恶性肿瘤。根据标准入选368例,均告知研究方法及意义,签署知情同意书。
1.2研究方法
1.2.1临床资料 收集入选对象既往史、个人史、用药史以及社会学特征;测量身高、体重、腹围,留取尿液及空腹12 h静脉血。安静环境中静息30 min以上,水银血压计测右上臂血压,取3次非同日血压的均值。参照2007年《中国成人血脂异常防治指南》〔4〕,以下标准符合3条或更多诊断为MS:血压≥130/85 mmHg;向心性肥胖:腰围>90 cm(男),85 cm(女);TG≥1.7 mmol/L;HDL-C≤1.04 mmol/L;空腹血糖≥6.1 mmol/L,糖负荷后2 h血糖≥7.8 mmol/L或有糖尿病史。
1.2.2超声心动图检查 均行彩色多普勒心脏超声检查。参照美国心脏超声协会推荐方法,测取标准左心室长轴切面M型超声连续的3个心动周期,测量左室舒张末期内径(LVDd),左室后壁厚度(LVPWT),舒张期室间隔厚度(IVST)。根据数值计算左室重量指数(LVMI)〔5〕。
1.3标本制备 取肘静脉血2~3 ml,乙二胺四乙酸(EDTA)抗凝,充分混匀。
1.4仪器设备 BaiO-BE系列基因芯片检测仪(上海百傲科技有限公司),BE-2.0生物芯片识读仪,离心机TGL-16B,PCR扩增仪TC-25/H,分光光度计,电泳槽,恒温培养箱DHP030,微量移液器,水浴锅,打印机等。
1.5内皮素-2 A894G基因多态性测定 取静脉血,分离白细胞,提取DNA。留取肘静脉血约3~5 ml,EDTA 50 μl抗凝处理。低渗法裂解红细胞分离得到白细胞。饱和酚/氯仿法由白细胞中提取基因组DNA,加入TE溶解DNA,-20℃保存。将DNA溶解至蒸馏水中与单纯蒸馏水作为空白对照,紫外分光光度计检验DNA的纯度。聚合酶链式反应扩增ET-2基因的特异片段(反应体系为25 μl)。反应条件:94℃热启动5 min,94℃变性25 s,56℃退火25 s,72℃延伸25 s,反复40个循环,72℃延伸5 min,最后冷却至4℃。将杂交仓中的基因芯片与PCR扩增产物混匀杂交,加入显色溶液,置于BaiO基因生物芯片识读仪检测,图像Array Doctor软件自动分析生成结果,检测eNOS(G894T)多态性与ACE(D/I)多态性。
1.6统计学方法 评估基因分布是否符合HarDY-Weinberg平衡。采用SPSS15.0软件进行t、χ2检验、协方差分析及Logistic回归分析。
2 结 果
2.1基线特征 MS(+)组与MS(-)组相比,年龄、体质指数(BMI)、腰臀比(WHR)、血糖、LVMI差异显著(P<0.05)。性别、脉压、HDL-C、低密度脂蛋白胆固醇(LDL-C)、UA无差异(P>0.05)(表1)。
2.2基因型及等位基因的频率分布及关联性分析 eNOS(G894T)基因多态性与ACE(D/I)多态性基因多态性分布符合HarDY-Weinberg平衡,样本具有群体代表性。分析MS(+)组与MS(-)组eNOS基因多态性与ACE多态性的差异(表2)。χ2检验后显示:MS(+)与MS(-)相比,eNOS基因G/G与G/T+T/T分布差异具有统计学意义(P<0.05);eNOS、ACE基因型分布无显著差异(P>0.05),eNOS基因型G/G+G/T与T/T分布无显著差异,eNOS等位基因G、T,ACE等位基因D、I分布无显著差异。
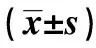
表1 基本资料比较
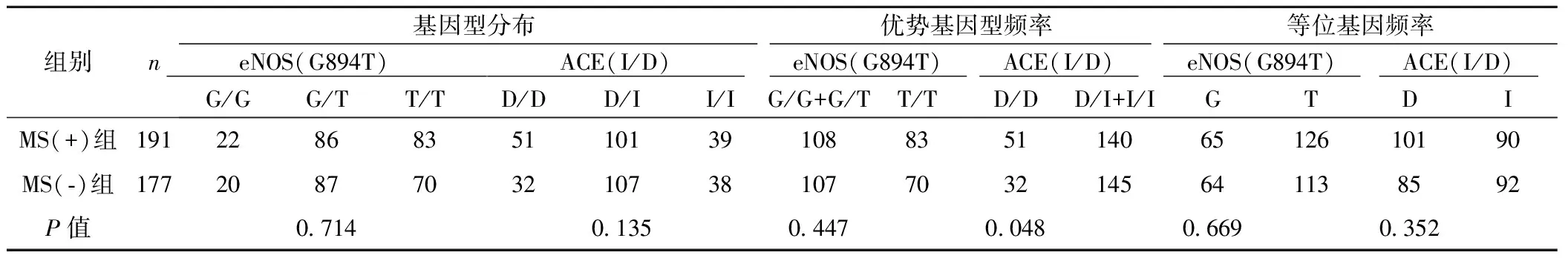
表2 基因型频率分布(n)
2.3协方差检验 检验正态分布和方差齐性后,定义协变量为性别、年龄、性别、BMI、WHR、SBP、DBP、TG、TC、HDL-C、LDL-C、LVMI,两组基因的优势基因型为因变量,MS为分组变量,检验各组协变量与因变量的总体回归系数相同且不为0后,进行检验。结果显示: eNOS(G894T)基因型T/T与MS无明显相关(P=0.293),ACE(D/I)基因型D/D与MS相关(P=0.032)。MS(+)组ACE基因型D/D协方差95%CI为1.645~1.781;MS(-)组95%CI为1.758~1.900。采用独立样本t检验分析两组不同基因型对参数的影响(表3)。结果显示:eNOS基因型T/T与G/T+T/T相比,年龄、UA差异具有统计学意义(P<0.05);ACE组基因型D/D与D/I+I/I相比,WHR、LVMI差异具有统计学意义(P<0.05)。
2.4二分类Logistic回归分析 将MS有无定义为因变量,将年龄、性别、生化指标、既往病史等影响因素及两组基因优势基因型定义为自变量,进行二分类Logistic回归分析(表4)。MS(+)与MS(-)相比,BMI、WHR、LVMI、ACE基因型DD为MS危险因素(P<0.05)。BMI:OR=1.327,95%CI:1.151~1.531;WHR:OR=12.936,95%CI:1.704~98.218;LVMI:OR=1.417,95%CI:1.398~2.426;ACE基因型D/D:OR=2.017,95%CI:1.107~3.675。
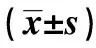
表3 不同基因型各参数比较
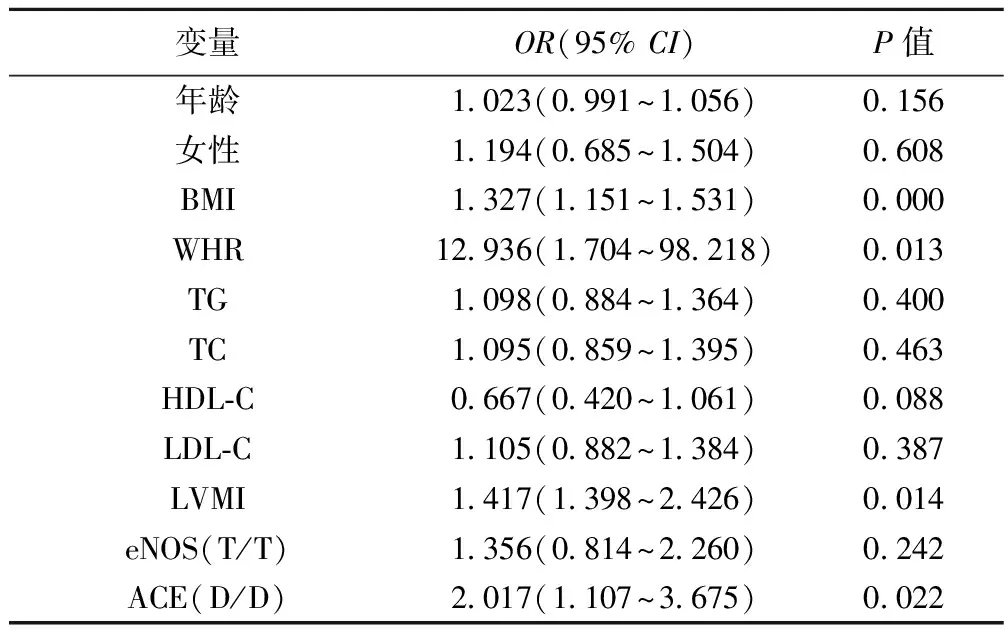
表4 二分类Logistic回归分析
3 讨 论
MS患者发生心肌梗死或脑卒中的概率是正常人的3倍;死亡率则是正常人的2倍〔5〕。关于MS的分子生物学机制、基因调控及信号转导通路仍未完全明确,但已有研究证实MS的相关机制,并同时证明了MS与心肌肥厚之间的关联性。
氧化应激反应及内皮功能障碍。近期研究发现:MS促进氧化应激发生,并与钠潴留及盐敏感性紧密相关〔6〕。内皮功能障碍与胰岛素抵抗的相互关系已得到大型流行病学研究支持〔7〕:胰岛素抵抗通过抑制细胞内磷脂酰肌醇激酶-3(PI3K)相关信号通路,使内皮系统NO的产生与内皮素-1(ET-1)分泌失衡,从而导致内皮功能障碍。动物实验发现:IGF1-PI3K(p110α)-Akt 信号通路参与调节心肌生长。胰岛素生长因子(IGF1)主要由肝脏分泌,参与胎儿生长及发育;心肌细胞同样分泌IGF1,并与其相应的细胞表面受体IGF1R相连。基因定向小鼠实验〔8〕证实:IGF1参与心肌细胞的生长,主要表现为心肌数量的增加;IGF1激活PI3K(p110α与Akt),进而诱导心肌细胞增大;IGF1R转基因小鼠心肌内,PI3K的激活及Akt磷酸化作用显著提高。内皮细胞中,无生物活性的eNOS储存在微囊蛋白1(Cav-1)内,在磷酸化活跃的部位分解释放有活性的eNOS,从而调节NO的合成〔9〕。以前研究认为eNOS内含天冬氨酸残基,致使eNOS功能障碍,而最近研究证实eNOS基因型T/T的人群相较基因型G/G更容易出现eNOS合成失调。
肾素-血管紧张素-醛固酮系统(RAS)激活。实验研究发现:RAS受内分泌及食物摄取情况调节,食物的过度摄取导致脂肪组织内血管及张素Ⅱ(AngⅡ)水平显著升高。同样,脂肪细胞内血管紧张素原(Ang)及AngⅡ的大量产生可能增加肥胖、高血压的发生率〔10〕。资料显示,血管壁肌层内,AngⅡ通过血管紧张素受体-1(AT1)干扰PI3K及Akt信号通路,进而干扰胰岛素信号,抑制胰岛素的功能〔11〕;细胞因子RhoA的活性与氧化性应激通过抑制PI3K/Akt通路、减少NO的生成参与介导这一过程〔1〕。近期研究显示〔5〕:ACE基因D等位基因可能为MS的危险因素。
本研究通过流行病学调查发现:ACE基因型DD与MS相关;但未证实eNOS基因型与MS的相关性;MS(+)组与MS(-)组之间两组基因等位基因的Pearsonχ2检验无显著差异。上述结果与相关研究结论不符,考虑原因可能与地区差异及样本量较小有关。认为ACE基因型DD亦可能为心肌肥厚指标LVMI的危险因素。本研究系回顾性研究,较前瞻性研究具有局限性,样本量偏小,难以避免选择性偏倚;有待大样本研究进一步证实。
4 参考文献
1Hidekatsu Yanai,Yoshiharu Tomonol,Kumie Itol,etal.The underlying mechanisms for development of hypertension in the metabolic syndrome〔J〕.Nutr J,2008;7(1):10-5.
2Giuseppe Mancia,Michele Bombelli,Giovanni Corrao,etal.Metabolic syndrome in the Pressioni Arteriose Monitorate E Loro Association(PAMELA) Study:daily life blood pressure,cardiac damage,and prognosis〔J〕.Hypertension,2007;49(1):40-7.
3Giusepp E,Schillaci M,Matteo Pirro,etal.Prognostic value of the metabolic syndrome in essential hypertension〔J〕.J Am Coll Cardiol,2004;10:735-1097.
4陆再英,钟南山.内科学〔M〕.第7版.北京:人民卫生出版社,2008:170-8.
5Mittal G,Gupta V,Haque SF,etal.Effect of angiotensin converting enzyme gene I/D polymorphism in patients with metabolic syndrome in North Indian population〔J〕.Chin Med J,2011;124(1):45-8.
6Sarafidis PA,Bakris GL.The antinatriuretic effect of insulin:an unappreciated mechanism for hypertension associated with insulin resistance〔J〕?Am J Nephrol,2007;27(1):44-54.
7Kim JA,Montagnani M,Koh KK,etal.Reciprocal relationships between insulin resistance and endothelial dysfunction:molecular and pathophysiological mechanisms〔J〕.Circulation,2006;113:1888-904.
8Bianca C,Bernardoi,Kate L,etal.Molecular distinction between physiological and pathological cardiac hypertrophy:experimental findings and therapeutic strategies〔J〕.Pharmacol Therapeutics,2010;128(2):191-227.
9Xin Y,Song XD,Xue H,etal.A common variant of the eNOS gene (E298D) is an independent risk factor for left ventricular hypertrophy in human essential hypertension〔J〕.Clin Sci,2009;117(1):67-73.
10张 强,崔天祥,李 莉,等.血管紧张素Ⅱ-1型受体基因多态性与高血压及血管内皮功能的相关性〔J〕.中国老年学杂志,2012;32(14):22-3.
11Sowers JR.Insulin resistance and hypertension〔J〕.Am J Physiol Heart Circ Physiol,2004;286:H1597-602.

