金樱子对阿霉素诱导心肌损伤的保护作用及机制
罗卫民,刘越峰,罗湘玉,张军△,林称意,郭家龙
(1. 湖北医药学院 附属十堰市太和医院 心胸外科,湖北 十堰442000;2. 湖北医药学院 附属十堰市人民医院,湖北 十堰 442000)
金樱子对阿霉素诱导心肌损伤的保护作用及机制
罗卫民1,刘越峰2,罗湘玉1,张军1△,林称意1,郭家龙1
(1. 湖北医药学院 附属十堰市太和医院 心胸外科,湖北 十堰442000;2. 湖北医药学院 附属十堰市人民医院,湖北 十堰 442000)
目的观察金樱子(Rosa Larigata Michx,RlM)对阿霉素诱导心肌损伤大鼠模型的保护作用及相关机制。方法30只SD大鼠随机分为空白对照组、阿霉素组模型组和金樱子干预组(n=10)。模型组采用阿霉素(15 mg/kg)分6次隔天腹腔注射,金樱子组按每公斤体重给予1~5g金樱子灌胃,空白对照组仅给予等体积生理盐水。处理结束后,观察观察大鼠生存率;ELISA检测血浆脑钠肽(brain natriuretic peptide,BNP)浓度;采用缺口末端标记法检测心肌凋亡细胞。同时观察心肌组织中心肌谷胱甘肽过氧化物酶(glutathion peroxidase,GSH-PX)、过氧化氢酶(hydrogen peroxidase,CAT)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)的活力;实时定量PCR检测铜锌超氧化物歧化酶(CuZn superoxide dismutase,CuZn-SOD)以及bcl-2、bax mRNA表达水平。结果与阿霉素组比较,金樱子可明显提高大鼠的生存率(P<0.01)。阿霉素组大鼠血浆BNP浓度显著增高(P<0.01),金樱子处理后BNP浓度显著降低(P<0.01)。此外,阿霉素组CuZn-SOD蛋白表达水平以及心肌组织GSH-PX、CAT、SOD活力明显降低。金樱子能提高CuZn-SOD蛋白mRNA表达水平以及心肌组织GSHPX、CAT、SOD活力。阿霉素组心肌细胞凋亡发生率显著增高(P<0.01);bcl-2基因表达下降,bax基因表达增强,bcl-2/bax mRNA比值降低。高剂量金樱子能降低阿霉素所致心肌细胞凋亡,并增强bcl-2基因表达,降低bax水平。结论金樱子通过多环节发挥抗氧化作用,并具有一定的抗凋亡效应,其作用机制可能与影响bcl-2 和bax的表达有关。
金樱子;阿霉素;保护作用;凋亡
心肌病是指伴有心功能障碍的心肌疾病,根据其病因的不同可分为原发性心肌病和特异性心肌病[1]。在各种因素导致的心肌病中,氧化应激是心肌细胞损伤的核心环节[2]。目前通过采取有效措施保护心肌细胞,逆转心肌重塑,是治疗心力衰竭的重要方法。主要包括以利尿剂、地高辛和血管紧张素转化酶抑制剂为主的“三联疗法”。此外,大剂量维生素C、维生素E以及各种免疫治疗虽然取得一定疗效,但最终结果仍不理想[3]。
阿霉素(adriamycin,ADR)是一种抑制RNA和DNA合成的抗肿瘤药物,对RNA的抑制作用最强,属周期非特异性药物。其最显著的副作用是可以引发药物性心肌病而引起心力衰竭[4],基于此特性,阿霉素被广泛应用于扩张型心肌病的实验模型[5]。
金樱子为蔷薇科金樱子(Rosa Laevigata Michx,RLM)的果实,研究发现它具有强大的抗氧化和清除自由基能力[6]。本实验通过采用阿霉素建立心肌损伤大鼠模型,随后用金樱子对其进行干预,旨在观察其对阿霉素心肌毒性的保护作用及可能的机制。
1 材料与方法
1.1 主要实验试剂 RNA提取试剂盒购自FUJIFILM;T-SOD试剂盒、CAT试剂盒以及GSH-PX试剂盒均为南京建成生物工程研究所产品。TUNEL法凋亡检测试剂盒购自武汉博士德公司。其他生化试剂主要为上海生物工程有限公司分析纯产品。BNP ELISA检测试剂盒购于上海复旦悦达生物技术有限公司。金櫻子购于十堰市中草药材公司,经去籽后用煎药机进行熬煎(YJD 13-GL,北京东华原医疗设备有限责任公司),提取液浓度为2.0 g/mL。其他仪器设备:实时定量PCR仪(7500,ABI),酶标仪(iMark,BIO-RAD),石蜡切片机(RM 2235, Leica)。
1.2 心肌损伤大鼠动物模型的建立及金樱子干预 30只SD大鼠由湖北医药学院实验动物部提供,体重(250±5)g,随机分为3组(n=10),正常对照组:常规饲料喂养,并给予等体积生理盐水灌胃;阿霉素模型组:采用阿霉素2.5 mg/kg腹腔注射,隔日注射1次,共6次。金樱子干预组:分为低、中、高剂量组,即阿霉素处理前按每kg体重分别给予1 g、3 g、5 g金樱子组灌胃。最后一次灌胃后,处理各组存活的大鼠,24 h后,采用1%戊巴比妥钠0.3 mL 腹腔注射麻醉大鼠,获取肺组织用于下一步检测。
1.3 ELISA检测BNP的浓度 获取大鼠抗凝静脉血,2500 rpm离心10min,获取血清液储存于-70℃以供测定BNP浓度。测定方法按照南京建成生物工程研究所提供的试剂盒进行,并用酶联仪在450nm波长依序测量各孔的光密度,根据标准曲线计算BNP的浓度。
1.4 T-SOD、GSH-PX以及CAT活性检测 获取大鼠心肌组织,经0.86%生理盐水漂洗后,置于匀浆器中研磨,按重量体积比加生理盐水制备成10%组织匀浆,4℃下14,000 r/min离心
10 min,取上清用于T-SOD、GSH-PX以及CAT活性检测,具体操作步骤按南京建成生物工程研究所提供的试剂盒进行。
1.5 实时定量PCR检测CuZn-SOD、bax和bcl-2基因
mRNA的表达 根据FUJIFILM公司提供的试剂盒操作要求获取总RNA。利用oligo(dT)引物及SuperScript III逆转录酶将1µg RNA逆转录为cDNA后,用RNA酶处理产物。设计特异性引物用于CuZn-SOD、bcl-2和bax mRNA的扩增。同时采用β-actin为内参,计算两者比值,数据以相对含量比值表示。
1.6 采用缺口末端标记法(TUNEL)检测心肌细胞凋亡摘取心脏标本后用4%的多聚甲醛固定24 h常规石蜡包埋,切片脱蜡入水后用蛋白酶K(20µg/mL)消化15 min;1%H2O2甲醇溶液封闭内源性过氧化物酶,加入20µLTUNEL混合液,37℃孵育1 h,TBS液漂洗、封闭;加入生物素标记抗地高辛抗体50µL, 37℃孵育30 min,TBS漂洗;DAB显色,苏木素复染。脱水、透明、封片后,镜下观察。随机挑选5个不同的视野,计算凋亡指数(凋亡阳性细胞核数/总计数的细胞核)×100%。
1.7 统计学方法 所有分组均设立3个平行对照,采用SPSS13.0统计软件分析数据,正态计量资料采用“x±s”表示,组间比较采用方差分析。P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠生存情况 对照组大鼠全部存活,存活率100%。阿霉素模型组建模当日大鼠无明显变化,随后逐日精神萎靡,食欲不振,毛色灰暗且质地粗糙。大鼠活动显著减少,第5 d开始有大鼠死亡发生,12 d后大鼠存活率仅70%。而采用金樱子处理后大鼠的活动度、饮食以及毛色均较好,且无大鼠死亡。
2.2 BNP测定 各组大鼠血清中BNP含量见图1所示。阿霉素组BNP明显升高,而经不同浓度金樱子处理后,BNP逐渐降低。当金樱子浓度达5 g/kg时,BNP含量接近对照组(79.62±11.26)ng/mL水平。

图1 金樱子对大鼠体内BNP的影响1.空白对照组;2.阿霉素组;3.阿霉素+金樱子低剂量组(1g);4.阿霉素+金樱子中剂量组(3g);5.阿霉素+金樱子高剂量组(5g)#P<0.01,与对照组相比;*P<0.05,与阿霉素组相比Fig.1 Effect of Rosa laevigata Michx on BNP secretion1.Control;2.Adriamycin;3.Adriamycin+Rosa laevigata Michx(1 g);4.Adriamycin+Rosa laevigata Michx(3g);5.Adriamycin+Rosa laevigata Michx(5 g)#P<0.01,compared with control group;*P<0.05,compared with Adriamycin group
2.3 各组大鼠心肌组织中CuZn-SOD mRNA的表达 定量PCR结果显示:正常对照组CuZn-SOD mRNA表达表达较高,阿霉素作用后,CuZn-SOD mRNA水平显著减少。而不同浓度金樱子能上调心肌组织中CuZn-SOD的表达水平(见图2)。
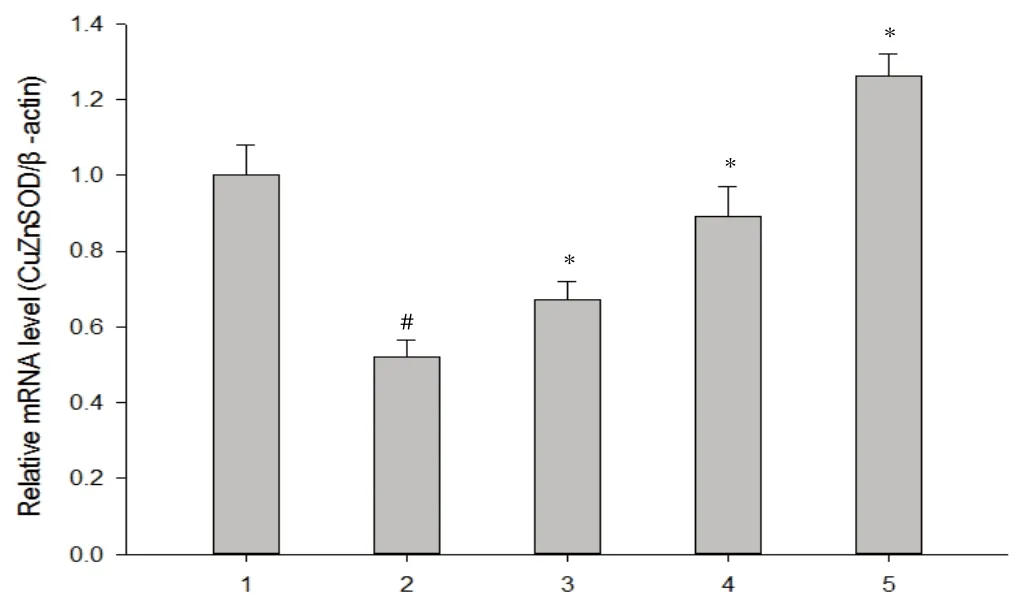
1.空白对照组;2.阿霉素组;3.阿霉素+金樱子低剂量组(1g);4.阿霉素+金樱子中剂量组(3g);5.阿霉素+金樱子高剂量组(5g)#P<0.01,与对照组相比;*P<0.05,与阿霉素组相比图2 金樱子对大鼠心肌组织中CuZn-SOD mRNA的影响1.Control;2.Adriamycin;3.Adriamycin+Rosa laevigata Michx (1g);4.Adriamycin+ Rosa laevigata Michx (3 g);5.Adriamycin+Rosa laevigata Michx(5 g)#P<0.01,compared with control group;*P<0.05,compared with driamycin groupFig.2 Effect of Rosa laevigata Michx on CuZn-SOD mRNA expression in rat myocardium
2.4 大鼠心肌组织中T-SOD、GSH-PX和CAT的活力与正常对照组相比,阿霉素模型组心肌组织中T-SOD、GSHPX及CAT活力明显降低(P<0.05)。大鼠经金樱子治疗后,心肌组织中T-SOD、GSH-PX及CAT活力明显增高,与阿霉素组相比差异有统计学意义(P<0.05,见表1)。
2.5 金樱子对心肌细胞凋亡率的影响 正常大鼠心肌细胞凋亡发生率很低。腹腔注射阿霉素后,心肌细胞凋亡明显增加,约为28%,不同浓度金樱子干预后,心肌细胞凋亡率随着金樱子浓度的增高而降低。当用5 g/kg金樱子处理后,凋亡率降至7.52%(见图3)。

表1 大鼠心肌组织中T-SOD、GSH-PX和CAT的活力(U/mg protein)Tab.1 The enzymic activity of T-SOD, GSH-PX and CAT(U/mg protein)

图3 金樱子对大鼠心肌细胞凋亡的影响1.空白对照组;2.阿霉素组;3.阿霉素+金樱子低剂量组(1 g);4.阿霉素+金樱子中剂量组(3 g);5.阿霉素+金樱子高剂量组(5 g)#P<0.01,与对照组相比;*P<0.05,与阿霉素组相比Fig.3 Effect of Rosa laevigata Michx on myocardial cells apoptosis1.Control;2.Adriamycin;3.Adriamycin+Rosa laevigata Michx(1 g);4.Adriamycin+ Rosa laevigata Michx(3g);5.Adriamycin+Rosa laevigata Michx(5 g)#P<0.01,compared with control group;*P<0.05,compared with Adriamycin group
2.6 凋亡基因表达 阿霉素模型组与正常组相比,bcl-2表达减少,bax的表达增加,bcl-2/bax mRNA比值减小。用金樱子干预治疗后,bcl-2的mRNA的相对表达量明显高于阿霉素组,bcl-2/bax mRNA比值增大(见表2)。
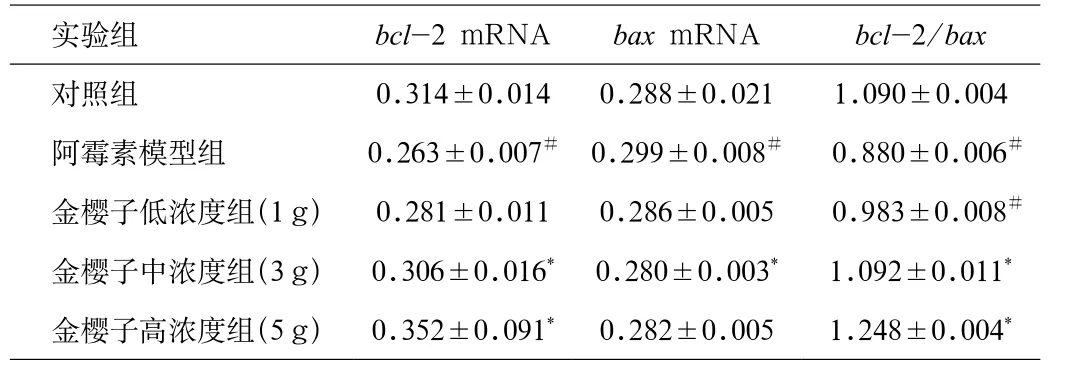
表2 大鼠心肌组织中凋亡基因表达(相对含量)Tab.2 Apoptosis genes expression in rat myocardium(relative content)
3 讨论
阿霉素属蒽醌类抗生素,其特殊的化学结构有利于氧自由基的产生。当其进入心肌细胞后,产生大量O2-、H2O2或反应性极强的HO-。这些氧自由基可作用于心肌细胞的不同细胞器及核酸,引起脂质过氧化和DNA损伤,导致膜完整性的破坏而引起心肌损伤[7]。大量实验证明,阿霉素可诱导氧自由基的产生[8]。在本研究中,给SD大鼠注射15 mg/kg阿霉素24 h后,心肌组织中GSH-PX活性以及总SOD和CAT的活性明显降低。抗氧化酶活性的降低意味着自由基清除功能减弱,表明了氧化应激在阿霉素诱导心肌细胞中的作用。SOD通常以铜和锌、或锰、铁、或镍作为辅因子。基本上所有的真核细胞的细胞内都含有带有铜和锌的SOD,即CuZn-SOD,本研究显示阿霉素也能抑制CuZn-SOD的表达,与国外研究结果相符[9],说明CuZn-SOD在心肌毒性过程中有着重要作用。
BNP主要在心室合成,是反映心室功能的敏感且可靠的指标[10]。本研究结果显示,模型组大鼠血浆BNP浓度显著增加,说明阿霉素引起了心肌细胞氧化损伤,导致心肌细胞功能障碍,从而诱导心室细胞合成BNP。不同剂量的金樱子对阿霉素诱导的心力衰竭大鼠有明显的保护作用,不但可改善实验模型组大鼠的存活率,BNP浓度也接近正常组。
阿霉素导致心肌细胞凋亡是其心脏毒性的最终结果。抗凋亡蛋白bcl-2主要分布于线粒体膜上,其功能主要是维持线粒体的正常功能。生理条件下bax存在于胞质中,处于非激活状态。在各种促凋亡因子的诱导下,bax发生构象改变,随后转移至线粒体外膜,诱导线粒体中细胞色素C的释放而导致凋亡的发生[11-12]。本实验中,15 mg/kg的阿霉素处理大鼠后,bcl-2表达水平明显下降,而bax水平则明显增高,两者比值降低。而金樱子有明显的对抗阿霉素引起的促凋亡作用。即金樱子通过下调促凋亡基因bax上调bcl-2的表达,从而增加bcl-2/bax的比值,抑制了阿霉素所致的心肌细胞凋亡,减轻了心肌损伤,改善了心脏功能。最近研究发现NO可以通过抑制caspase-3的活性或抑制线粒体跨膜电势抑制凋亡[13-14]。Amlodipine促进内源性NO的产生而发挥其抗凋亡效应[15],金樱子是否也在此环节发挥抗凋亡作用需进一步研究。
[1] Shankar PB,Shanthi C,Cherian KM.Pre-excitation induced left ventricular dysfunction:A less known cause of cardiomyopathy in children.Ann Pediatr Cardiol,2013,6(1):77-79.
[2] Yang F,Chen H,Liu Y,et al.Doxorubicin caused apoptosis of mesenchymal stem cells via p 38,JNK and p 53 pathway.Cell Physiol Biochem,2013,32(4):1072-1082.
[3] Kandala J,Upadhyay GA,Pokushalov E,et al.Meta-analysis of stem cell therapy in chronic ischemic cardiomyopathy,2013,112(2):217-225.
[4] da Silva MG,Mattos E,Camacho-Pereira J,et al.Cardiac systolic dysfunction in doxorubicin-challenged rats is associated with upregulation of MuRF 2 and MuRF 3 E 3 ligases.Exp Clin Cardiol,2012,17(3):101-109.
[5] Chen ZC,Chen LJ,Cheng JT.Doxorubicin-Induced Cardiac Toxicity Is Mediated by Lowering of Peroxisome Proliferator-Activated Receptor delta Expression in Rats.PPAR Res,2013(2013):456042.
[6] Jia Y,Ji L,Zhang S,et al.Total flavonoids from Rosa Laevigata Michx fruit attenuates hydrogen peroxide induced injury in human umbilical vein endothelial cells.Food Chem Toxicol,2012,50(9):3133-3141.
[7] Zhang YW,Shi JJ,Li YJ,et al.Cardiomyocyte death in doxorubicin-induced cardiotoxicity.Arch Immunol Ther Exp (Warsz),2009(57):435-445.
[8] Chularojmontri L,Ihara Y,Muroi E,et al.Cytoprotective role of Phyllanthus urinaria L.and glutathione-S transferase Pi in doxorubicin-induced toxicity in H9 c 2 cells.J Med Assoc Thai,2009,92(Suppl 3):S 43-51.
[9] Li T,Danelisen L,Singal PK.Early changes in myocardial antioxidant enzymes inrats treated with adriamycin.Mol Cell Biochem,2002(232):19-26.
[10] Hongkan W,Soongswang J,Veerakul G,et al.N-terminal pro brain natriuretic peptide and cardiac function in doxorubicin administered pediatric patients[J].J Med Assoc Thai,2009,92(11):1450-1457.
[11] Tacar O,Sriamornsak P,Dass CR.Doxorubicin:an update on anticancer molecular action,toxicity and novel drug delivery systems[J].J Pharm Pharmacol,2013,65(2):157-170.
[12] Wu S,Ko YS,Teng MS,et al.Adriamycin-induced cardiomyocyte and endothelial cell apoptosis:in vitro and in vivo studies[J].J Mol Cell Cardiol,2002,34(12):1595-1607.
[13] Kim YM,Talanian RV,Billiar TR.Nitric oxide inhibits apoptosis by preventing increases in caspase-3-like activity via two distinct mechanisms[J].J Biol Chem,1997(272):31138-31148.
[14] Childs AC,Phaneuf SL,Dirks AJ,et al.Doxorubicin treatment in vivo causes cytochrome C release and cardiomyocyte apoptosis,as well as increased mitochondrial efficiency,superoxide dismutase activity,and Bcl-2:Bax ratio[J]. Cancer Res,2002(62):4592-4598.
[15] Zhang X,Hintze TH.Amlodipine releases nitric oxide from canine coronary microvessels:an unexpected mechanism of action of a calcium channel-blocking agent[J].Circulation,1998(97):576-580.
Protective effect and mechanism of Rosa laevigata Michx on adriamycin -induced cardiotoxicity
LUO Wei-min1, LIU Yue-feng2, LUO Xiang-yu1, ZHANG Jun1△, LIN Cheng-yi1, GUO Jia-long1
(1. Department of Cardiothoracic Surgery, Hubei University of Medicine affiliated Taihe hospital of Shiyan, Shiyan 442000, China; 2. Department of Ophthalmology,Hubei University of Medicine Affiliated People’s Hospital of Shiyan, Shiyan 442000, China)
ObjectiveTo study the protective effect mechanism of Rosa laevigata Michx (RLM) on cardiotoxicity induced by adriamycin in rats。Method30 SD rats were randomly into control group, doxorubicin group and RLM groups. The control group was injected with normal saline injection, while the model group was injected with adriamycin intraperitoneally at the dosage of 15 mg/kg every other day. For the RLM groups,1~5 g/kg RLM were given after adriamycin injection. The survival rate, plasma BNP was observed. Apoptosis of cardiomyocyte was detected by instituted-labeled DNA (TUNEL). The activity of GSH-PX, CAT and total SOD in the myocardium tissue were also observed. The expression level of CuZn-SOD , bcl-2 and bax were detected by real-time PCR。ResultsThe survival rate was signi fi cantly improved in SD rats treated with RLM compared with that in the adriamycin group (P<0.01). The BNP level was increased when treated by adriamycin (P<0.01), and decreased after RLM administration (P<0.01). RLM could also upregulate the expression of the CuZn-SOD mRNA level, and enhance the activity of GSH-PX, CAT and T-SOD compared with that in adriamycin group. Adriamycin could induce myocardial cells apoptosis, as demonstrated by TUNEL. RLM could inhibit adriamycin-induced apoptosis, bax mRNA expression, and increase bcl-2 expression and bcl-2/bax ratio。ConclusionRLM exhibit some antioxidant activity through many stages, and the antiapoptosis activity may be related to affect the expression of bax and bcl-2 expression.
rosa laevigata Michx; adriamycin; protective effect; apoptosis
R 453.9
A
1005-1678(2014)01-0029-04
十堰市科技公关项目(2009S48)
罗卫民,硕士,主治医师;张军,通信作者,Email:zhjun 159@ sina.com。

