茶树八氢番茄红素脱氢酶cDNA全长克隆与表达分析
李娜娜 邵文韵 刘 畅 陆建良 梁月荣
(浙江大学茶叶研究所,浙江杭州 310058)
类胡萝卜素是广泛存在于植物体内的一类色素,是含有多个共轭双键的萜烯类化合物,在植物生命中发挥重要作用,具有捕获光能,消除氧自由基的光保护功能,同时为植物生长调节剂脱落酸及其他激素类物质合成提供底物[1-2]。类胡萝卜素各组分的颜色具有差异性,在非绿色组织内,积累某些独特的成分,植株器官所呈现出来的颜色也不相同,如无色的八氢番茄红素和六氢番茄红素,浅黄色的ζ-胡萝卜素,橙黄色的链孢红素,红色的番茄红素,黄色的叶黄素,橘黄色的 β-胡萝卜素[1]。
八氢番茄红素脱氢酶(EC:1.3.5.5,phytoene desaturase,PDS)是类胡萝卜素生物合成途径(pathway:map00906)中的关键限速酶之一,催化八氢番茄红素(phytoene)两步脱氢转化为ζ-胡萝卜素。PDS基因的突变和抑制性表达,会大量积累八氢番茄红素,减弱叶绿素、类胡萝卜素和赤霉素的生物合成,植株呈现白化和矮化的外在表型[3];当含有PDS基因片段的重组质粒病毒侵染植物后诱导靶基因沉默,由于PDS的mRNA表达受到抑制,侵染发病的植物叶片出现白化现象[4-7]。
‘黄金芽’由白化突变新梢培育而成,全年白化,叶片黄色,是新型光照敏感型茶树品种,成品茶具有氨基酸含量高、滋味鲜爽、香气悠长等优良品质特征[8-10]。为探究PDS基因是否是‘黄金芽’产生白化现象的关键调控因子,本实验利用 RACE(Rapid Amplification of cDNA Ends)和 RT-PCR技术,克隆获得茶树八氢番茄红素脱氢酶的全长基因,结合实时荧光定量 PCR技术[11-12],分析比较PDS基因在正常绿色茶树品种‘福鼎大白茶’、黄色白化突变品种‘黄金芽’及遮荫处理‘黄金芽’中的表达变化,同时该基因的获得也为利用基因工程手段调控茶树类胡萝卜素物质的生物合成打下基础。
1 材料与方法
1.1 材料
供试材料为茶树品种‘福鼎大白茶’、‘黄金芽’、30%遮荫度‘黄金芽’及60%遮荫度‘黄金芽’的新梢一芽二叶,采自浙江省杭州市富阳茶园,取样后迅速用液氮冷冻处理,然后置于-80℃冰箱保存备用。
1.2 方法
1.2.1 总RNA提取和cDNA第一链合成 采用Trizol法(裂解液购自 TaKaRa公司,Code No.9109)提取总RNA,方法步骤参照文献[13]。以提取所得茶树总 RNA为模板,Oligo dT为引物,按照PrimeScriptTM1st Strand cDNA Synthesis试剂盒(TaKaRa公司,Code No.6110A)操作说明书合成cDNAD第一链。
1.2.2 PDS 基因 3'端序列(3'RACE)和 5'端序列(5'RACE)的获得 根据已发表八氢番茄红素脱氢酶中间序列(GenBank:EU275984.1),利用 Primer Premier 5.0软件设计引物。3'RACE特异性引物:5'-TGCTATTGAAGGAGATGCCTATG-3',预测产物大小 900 bp;5'RACE特异性引物:5'-ACCTAGAATTGCTGGAATGAGTCC-3',预测产物大小950 bp。引物由上海生工生物工程技术服务有限公司完成。
3'端序列的操作步骤依次按照3'-Full RACE Core Set Ver 2.0 试剂盒(TaKaRa Code:D314)说明书进行。①反转录反应。②套式PCR反应,包括Outer PCR和Inner PCR反应。取20 μl Inner PCR产物进行2%琼脂糖凝胶电泳检测,并切胶回收目的片段,保存于-20℃。
5'端序列的获得采用5'-Full RACE Kit试剂盒(TaKaRa Code:D315)进行套式PCR反应。①去磷酸化处理。使用alkaline phosphatase(CIAP)对Total RNA中裸露的5'磷酸基团进行去磷酸反应。②“去帽子”反应。使用 tobacco acid pyrophosphatase(TAP)去掉mRNA的5'帽子结构,保留一个磷酸基团。③5'RACE adaptor的连接。④反转录反应。⑤套式PCR反应,包括Outer PCR和Inner PCR反应。反应结束后,取20 μl PCR反应液进行2%琼脂糖凝胶电泳,确认PCR扩增产物并切割胶回收目的片段,保存于-20℃。
1.2.3 目的片段克隆及测序 使用 TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver 3.0 试剂盒(TaKaRa Code:D823A)从切割的琼脂糖凝胶中回收纯化DNA片段,接着将DNA片段插入进T载体,采用PMD®18-T Vector试剂盒(TaKaRa Code:D101A)。将10 μl DNA 连接液与50 μl冰浴融化的Trans 109(TransGen,Lot#F141012)感受态细胞混合,冰浴和热激之后加入940 μl液体LB培养基,37℃振荡培养1 h,进行转化反应。离心后吸取适量体积已转化的感受态细胞加到含有0.1 mg/ml氨苄青霉素、0.024 mg/ml 异丙基-β-D-硫代吡喃半乳糖苷(IPTG)、0.04 mg/ml X-Gal的固体LB培养基上,37℃培养过夜。挑选白色单菌落接种于0.1 ml液体LB培养基中,37℃振荡培养4 h,采用菌液PCR法确认阳性克隆。阳性克隆液送至上海英潍捷(Invitrogen)生物技术有限公司完成测序。
1.2.4 CsPDS生物信息学分析 利用 ExPASy的ProtParam(http://web.expasy.org/protparam/)程序,计算蛋白质物理化学性质,包括相对分子量、理论等电点、氨基酸组成、正负电荷残基数、不稳定系数、总平均亲水性等;使用 ExPASy的 ProtScale(http://web.expasy.org/protscale/)程序,对蛋白质进行亲水性/疏水性分析;采用 SOPMA程序(http://pbil.univ-lyon1.fr/),进行蛋白质二级结构预测;利用 SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)程序,预测蛋白质的信号肽;使用 ChloroP 1.1 Server(http://www.cbs.dtu.dk/services/ChloroP/)程序,预测蛋白质序列的叶绿体转运肽(cTP);采用 PSORT(http://www.psort.org/)程序,进行蛋白质亚细胞定位预测;利用ExPASy 的 TMpred(http://embnet.vital-it.ch/software/TMPRED_form.html)程序,预测蛋白质的跨膜结构域;使用NCBI的blastx程序(http://blast.ncbi.nlm.nih.gov/Blast.cgi),对该核苷酸序列进行蛋白同源序列比对;采用ClustalX软件、GeneDoc软件和MEGA 5.05软件,进行氨基酸的多序列比对和系统进化树分析。
1.2.5 CsPDS实时荧光定量 PCR 使用 NCBI Primer-BLAST(http://www.ncbi.nlm.nih.gov/tools/primer-blast/)程序,在线设计CsPDS引物,引物序列为 F:5'-AAGGACGTGTGCCCTTTGAA-3',R:5'-CTGCACCAGCAATGACAACC-3',产物大小为 154 bp。以β-Actin作为内参基因,内参引物序列为F:5'-CTTCCTCATGCTATCCTCCGTCTT-3',R:5'-ATTT CCCGTTCAGCAGTGGTG-3',产物大小为 113 bp。引物由上海生工生物工程技术服务有限公司完成。
使用SYBR® Premix Ex TaqTM试剂盒(TaKaRa Code:DRR420A)试剂进行荧光定量PCR。在荧光定量PCR管中加入上游引物和下游引物各0.4 μl(引物浓度为 20 μmol/L),灭菌蒸馏水 6.8 μL,SYBR® Premix Ex TaqTM10 μL,cDNA 模板 2 μL,ROX Reference Dye 0.4 μl(荧光校正),总反应体系为20 μL,每个样品3个重复。采用两步法,反应条件为95℃预变性30 s、95℃变性5 s、60℃退火30 s,40个循环,数据读取由 ABI Stepone PlusTMReal-Time PCR System自动完成,使用公式方法来计算各基因的相对表达量。
2 结果与分析
2.1 茶树叶片总RNA的提取
提取的茶树叶片总RNA经1.2%琼脂糖凝胶电泳检测其完整性,并用 GeneQuant RNA/DNA Calculator比色测定其浓度和纯度。图1可见,所提取的总RNA样品28 S和18 S条带清晰完整,且28 S的条带亮度大于18 S;OD260/OD280值为1.6~1.9之间。说明总RNA的质量良好,没有发生降解并且无基因组污染,符合后续实验要求。
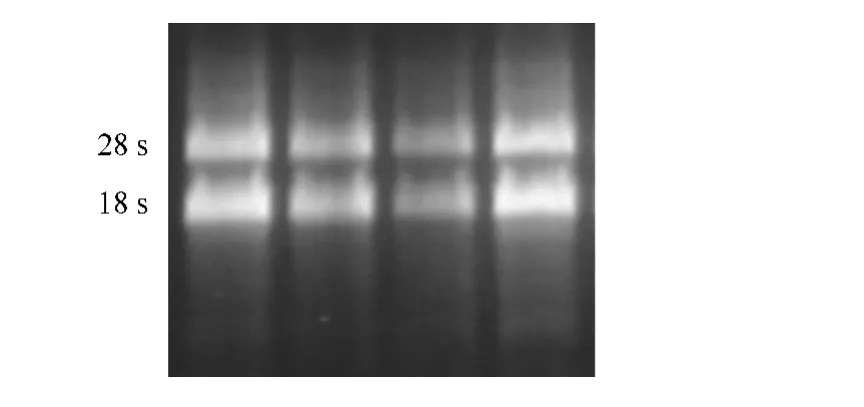
图1 总RNA琼脂糖凝胶电泳
2.2 PDS基因3'端和5'端序列的扩增
根据茶树PDS基因已知中间序列和TaKaRa 3'RACE试剂盒原理设计引物,反转录cDNA为模板,3'端特异性引物和 3'RACE Outer Primer、Inner Primer进行两次扩增得到产物,经2%琼脂糖凝胶电泳可见900 bp目的条带(图2)。根据茶树PDS基因已知中间序列和TaKaRa 5'RACE试剂盒原理设计引物,接头RNA反转录的cDNA为模板,5'端特异性引物和5'RACE Outer Primer、Inner Primer进行两次扩增得到产物,经2%琼脂糖凝胶电泳可见950 bp目的条带(图3)。
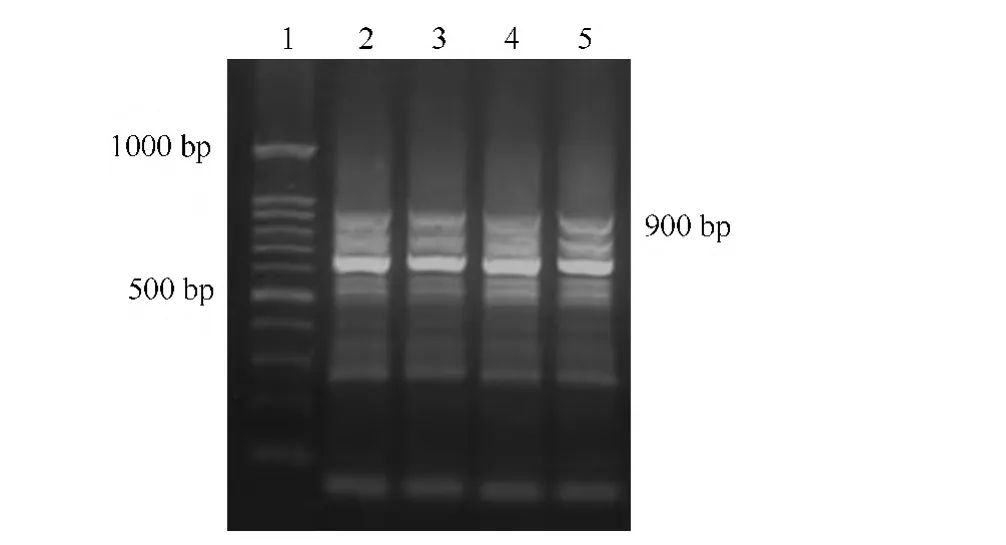
图2 PDS基因3'末端扩增结果
2.3 CsPDS基因序列生物学分析
利用ExPASy的ProtParam程序计算蛋白质物理化学性质,结果显示,CsPDS的分子量为64.86 KDa,理论等电点为6.77,含量丰富的氨基酸有亮氨酸(Leu)10.0%、丙氨酸(Ala)7.7%、赖氨酸(Lys)7.2%、缬氨酸(Val)7.2%,带负电荷氨基酸残基数为68,带正电荷氨基酸残基数为67,不稳定指数38.50,此蛋白质稳定(不稳定指数 <40,蛋白质稳定)。
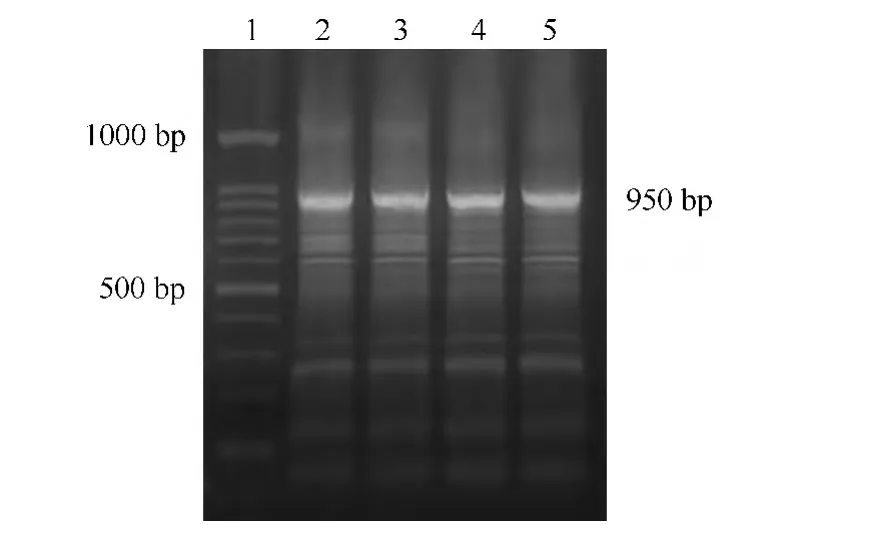
图3 PDS基因5'末端扩增结果
使用 ExPASy的 ProtScale程序,采用 Hphob./Kyte&Doolittle的方法,对CsPDS蛋白进行亲水性/疏水性分析,结果如图4所示,最大值2.522,最小值 -2.844,总平均亲水性为 -0.163。根据正值越大,疏水性越高;负值越小,亲水性越高来判断,表明CsPDS为亲水性蛋白。SOPMA二级结构预测表明,CsPDS具有占39.35%的α-螺旋(229个氨基酸)、占4.47%的β-转角(26个氨基酸)、占39.35%的无规则卷曲(229个氨基酸)和占16.84%的延伸链(98个氨基酸)。
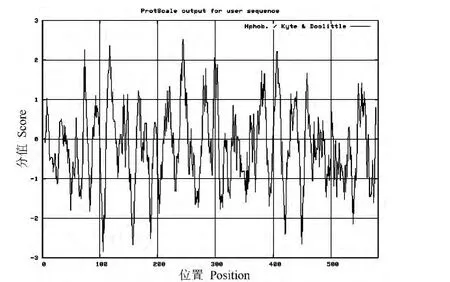
图4 CsPDS的亲水性/疏水性预测
利用SignalP 4.1 Server程序对蛋白质进行分析,没有发现信号肽,该蛋白质为非分泌蛋白;利用ChloroP 1.1 Server程序预测蛋白质序列的叶绿体转运肽(cTP),结果表示,该基因蛋白质序列含有叶绿体转运肽,且cTP前导序列长度58。利用 ExPASy的PSORT程序对蛋白亚细胞定位进行预测(图5),CsPDS具有在叶绿体类囊体膜中的可能性。通过TMpred程序预测蛋白质的跨膜结构域,结果显示,该蛋白具有2个明显的跨膜螺旋,在氨基酸第110~129和239~256区域,说明CsPDS编码的蛋白是跨膜蛋白质。分析可知,CsPDS为细胞核基因编码,在叶绿体类囊体膜上发挥作用的酶蛋白。

图5 CsPDS蛋白亚细胞定位预测
使用NCBI的blastx程序,对该基因核苷酸序列进行蛋白同源性比对,发现该序列与许多植物的PDS氨基酸序列都有较高的同源性(表1),其中与柿子(Diospyros kaki)、葡萄(Vitis vinifera)、杏(Prunus armeniaca)、烟草(Nicotiana attenuata)最为接近,相同度分别为87%、84%、84%和83%。对其保守结构域分析发现,其保守区具有NAD_binding_8特殊位点,属于NAD_binding_8 Superfamilies超家族基因。

表1 茶树CsPDS氨基酸序列在NCBI中blastx结果
利用 ClustalX 1.81软件、GeneDoc软件和MEGA 5.05软件,选择和茶树CsPDS亲缘性较近的几个物种的PDS氨基酸序列作多序列比对和系统进化树的分析。结果表明(图6),茶树与其他植物的PDS序列具有许多高度保守区域,以黑色和灰色方框表示,颜色越深,保守度越高。采用 MEGA 5.05软件的邻接法(Neighbor-Joining,NJ),构建茶树与柿树等15种植物的PDS氨基酸序列的系统进化树(图7),茶树PDS与柿树(Diospyros kaki)、葡萄(Vitis vinifera)等的亲缘关系相近,但与菊花(Chrysanthemum)、腊梅(Chimonanthus praecox)等的亲缘关系较远。

图6 茶树CsPDS氨基酸序列与其他植物氨基酸序列的多序列比对
2.4 CsPDS基因表达分析
实时荧光定量 PCR检测结果显示(图8),CsPDS基因在‘黄金芽’内表达量显著高于正常茶树品种‘福鼎大白茶’(2.86倍),30%遮荫率可以使其表达上调,60%遮荫率条件下表达量与自然光照下无明显差异。遮荫能减弱光照强度,‘黄金芽’叶色由黄色逐渐转变为绿色[14]。分析可见,CsPDS基因的表达并没有随着光照强度的减弱而持续上调,且在突变体内的表达量高于正常植株。
3 讨论
茶树功能基因的分离和克隆是茶树生物技术研究的重要内容之一,是茶树基因表达分析和种质资源遗传改良的重要工作基础[15]。本实验从茶树中克隆CsPDS基因cDNA序列含有1749 bp的完整开放阅读框,生物信息学分析表明,该基因编码的氨基酸序列与其他植物有较高的同源性,保守区域具有NAD(P)结合特殊位点,多序列比对得出CsPDS与

图7 基于NJ法的不同植物PDS氨基酸序列的系统进化树
不同物种之间氨基酸序列的保守域基本相同。因此,可认为本实验克隆获得的CsPDS是八氢番茄红素脱氢酶,为分析该基因的表达及利用基因工程手段调控茶树类胡萝卜素类物质代谢提供可能。
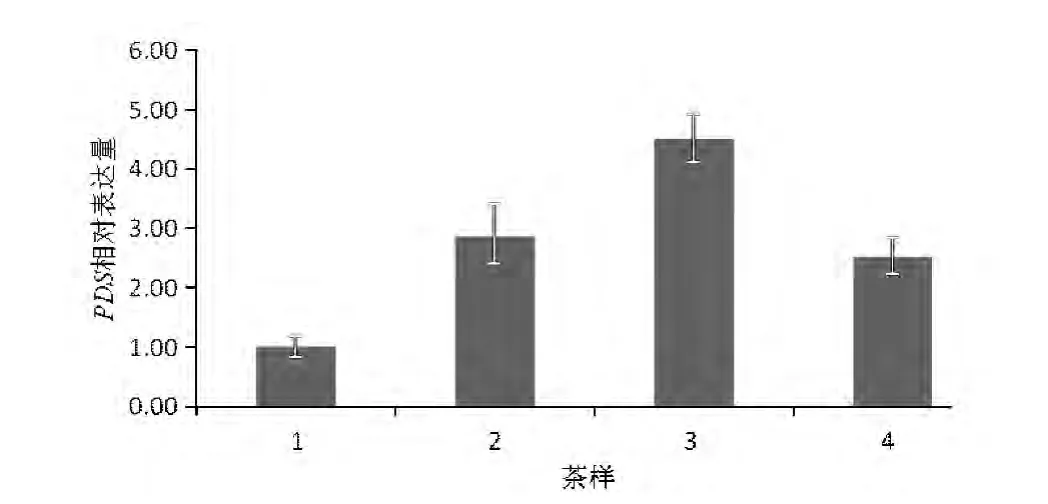
图8 CsPDS在不同茶样品中的表达情况
‘黄金芽’是新梢叶片呈现黄色白化现象的茶树突变体,成品茶品质独特,氨基酸含量高[8-10,14],但抗逆性相对较弱,对外界光照强度甚是敏感,夏季强光照易使白化叶片灼伤焦枯[8,16]。为进一步开发利用‘黄金芽’种质资源及改进其栽培管理技术,需要研究该品种的分子遗传白化机理。八氢番茄红素脱氢酶是催化牻牛儿基牻牛儿基焦磷酸(GGPP)进入类胡萝卜素生物合成途径的第二反应步骤,[17]利用病毒诱导PDS基因沉默,PDS表达受到抑制,植物会出现明显的黄化[18-19]或高度均匀的光漂白[20]表型。本研究的实时荧光定量表达分析的结果说明,CsPDS在‘黄金芽’体内的表达没有受到显著抑制,甚至明显高于正常绿色茶树品种的表达量,说明‘黄金芽’的黄色白化现象不是PDS基因抑制性表达而引起,其白化表型遗传机理有待进一步的调查研究。
1 Tanaka Y,Sasaki N,Ohmiya A.Biosynthesis of plant pigments:anthocyanins,betalains and carotenoids.Plant Journal,2008,54(4):733-749.
2 Diretto G,Al-Babili S,Tavazza R,Scossa F,Papacchioli V,MiglioreM, BeyerP, Giuliano G. Transcriptional-Metabolic Networks in beta-Carotene-Enriched Potato Tubers:The Long and Winding Road to the Golden Phenotype.Plant Physiology,2010,154(2):899-912.
3 Qin GJ,Gu HY,Ma LG,Peng YB,Deng XW,Chen ZL,Qu LJ.Disruption of phytoene desaturase gene results in albino and dwarf phenotypes in Arabidopsis by impairing chlorophyll,carotenoid,and gibberellin biosynthesis.Cell Research,2007,17(5):471 -482.
4 杨学东,戴薇,张昌伟,王金彦,孔敏,侯喜林.白菜病毒诱导基因沉默技术体系的建立.园艺学报,2012,39(11):2168-2174.
5 陶小荣,周雪平,崔晓峰,钱亚娟.病毒诱导的基因沉默及其在植物基因功能研究中的应用.生物化学与生物物理进展,2004,31(9):777-783.
6 Kumagai MH,Donson J,Della-Cioppa G,Harvey D,Hanley K,Grill LK.Cytoplasmic Inhibition of Carotenoid Biosynthesis with Virus-Derived RNA.Proceedings of the National Academy of Sciences of the United States of America,1995,92(5):1679-1683.
7 Ruiz MT,Voinnet O,Baulcombe DC.Initiation and maintenance of virus-induced gene silencing.Plant Cell,1998,10(6):937 -946.
8 王开荣,李明,梁月荣,张龙杰,沈立铭,王胜彬.茶树新品种黄金芽选育研究.中国茶叶,2008,30(4):21-23.
9 王开荣,李明,王荣芬,沈立铭.光照敏感型白化茶栽培与加工技术.中国茶叶,2008,30(11):16-17.
10 王开荣,张国平,李明,林伟平,方乾勇,杜颖颖,俞茂昌,梁月荣.新梢白化系列茶树新品系性状比较研究.茶叶,2006,32(1):22-24.
11 乔小燕,马春雷,陈亮.茶树黄酮合成酶Ⅱ基因全长cDNA序列的克隆和实时荧光定量PCR检测.茶叶科学,2009,29(5):347-354.
12 孙美莲,王云生,杨冬青,韦朝领,高丽萍,夏涛,单育,洛洋.茶树实时荧光定量PCR分析中内参基因的选择.植物学报,2010,45(5):579-587.
13 李娜娜,陆建良,郑新强,梁月荣.茶树品种福鼎大白茶和小雪芽叶片基因转录组研究.江苏农业学报,2012,28(5):974-978.
14 杜颖颖.新梢白化茶树品种白化机理研究.2009,浙江大学农业与生物技术学院,浙江大学.
15 陆建良,林晨,骆颖颖,张广辉,梁月荣.茶树重要功能基因克隆研究进展.茶叶科学,2007,27(2):95-103.
16 李明,张龙杰,王开荣,梁月荣,沈立铭,王胜彬,陆建良.光照敏感型白化茶新品种“黄金芽”白化特性研究.茶叶,2008,34(2):98-102.
17 Tuan PA,Kim JK,Kim HH,Lee SY,II Park N,Park SU.Carotenoid Accumulation and Characterization of cDNAs Encoding Phytoene Synthase and Phytoene Desaturase in Garlic(Allium sativum).Journal of Agricultural and Food Chemistry,2011,59(10):5412-5417.
18 Romero I,Tikunov Y,Bovy A.Virus-induced gene silencing in detached tomatoes and biochemical effects of phytoene desaturase gene silencing.Journal of Plant Physiology,2011,168(10):1129-1135.
19 徐大伟,张雨良,檀根甲.棉花八氢番茄红素脱氢酶GhPDS1基因的克隆与表达谱分析.棉花学报,2011,23(3):200-204.
20 Ito H,Ochiai M,Kato H,Shiratake K,Takemoto D,Otagaki S,Matsumoto S.Rose Phytoene Desaturase Gene Silencing by Apple Latent Spherical Virus Vectors.Hortscience,2012,47(9):1278-1282.

