核桃凋落叶分解对小麦生长及生理特性的影响
黄建贝,胡庭兴,吴张磊,胡红玲,陈 洪,王 茜
(四川农业大学林学院,四川省林业生态工程重点实验室,雅安 625014)
植物化感作用(Allelopathy)是H. Molisch在1937年首先提出[1],1984年由Rice将其较完整地定义为: 植物通过释放化学物质到环境中而对其它植物或自身产生直接或间接的有害或有益的作用[2]。化感作用在林农作物间作[3- 4]、杂草的生物防治与抗病虫害[3]、林业树种的选择与配置[3]、植物自毒作用的缓解[3]、控制外来生物入侵[3,5]、藻类及其它海洋植物次生物质[3]等多方面均有广泛研究,对农林复合系统的可持续发展和自然资源及环境保护具有重要意义。
核桃(Juglansregia),又称胡桃、羌桃,遍及世界各地,高营养价值的果实以及上等的木材使其具有重要的经济价值。截至2010年底,我国核桃种植面积和产量均居世界第一位[6]。但与此同时,实践表明“核桃树下无丰草”[7],其化感作用所带来的生态负效应也早已被人们所关注,国内外亦对此展开了大量研究。黑核桃(Juglansnigra)主要的化感物质胡桃醌(Juglone)已经被证实可以影响多种蔬菜、大田作物、观赏植物和一些木本植物的生长乃至生存[8]。在核桃活组织(根、叶和果实青皮)中含有无毒的氢化胡桃醌,能被氧化为有毒的胡桃醌[9],更深入的研究表明胡桃醌的形成与葡萄糖苷酶有关,它是土壤中常见的一种酶[10],这种酶可以催化水解作用,产生氢化胡桃醌,然后再经过快速的化学氧化转化为胡桃醌[11]。Jose等[12]研究表明核桃根际沉淀可产生胡桃醌,活体胡桃树也可被雨雾淋溶出化感物质胡桃醌[13]。与黑核桃相近的树种如白核桃(Juglanscinerea)和其它一些遍布于亚洲和美国的核桃树种都会产生胡桃醌[14]。国内学者研究了核桃青皮水提液对小麦(Triticumaestivum)[15- 17]、三叶草(Trifoliumrepens)[15]、萝卜(Raphanussativus)[16- 17]、绿豆(Vignaradiata)[16- 17]、黄瓜(Cucumissativus)[16]、油菜(Brassicanapus)[17]等的化感作用,核桃枝叶水提物对绿豆[18]、黄瓜[18]、黑豆(Glycinemax)[7]的化感作用。这些浸提液的相关研究均是在相对较短的时间内进行,并且只能提取枝叶中水溶性或者亲水性的次生物质,忽略了土壤及其中的微生物等环境因素对土壤中凋落物化感物质的释放和表达产生的影响,因此与自然状态相比表现出的化感效应差异可能很大[19- 20]。植物残体分解是化感物质释放的重要途径之一,而有关核桃残体释放的化感物质在进入土壤物质循环后,对受体植物生长产生的综合影响如何,国内外还鲜见报道。本试验采用盆栽试验,以小麦为受体,模拟自然状态下核桃凋落叶在土壤内分解过程中对其生长的影响,以期为植物残体化感作用的深入研究提供参考,这对核桃农林复合模式中如何正确的选择搭配物种并采取合理的配置方式和经营措施也具有重要的参考意义。
1 材料与方法
1.1 试验材料
1.1.1 供体材料
于2011年10月底在四川省资阳市收集8年生核桃凋落叶,取回后风干剪成1 cm2左右的小块,贮存备用。
1.1.2 受体材料
受体植物采用常见农作物小麦(Triticumaestivum)。选择饱满、大小均一的籽粒,播种前先晒种1d,用0.1% HgCl2消毒后浸种24 h,待用。
1.1.3 栽植土壤与容器
选择当地常见的沙壤土,将其充分混匀后平铺晾置2 d,待用;栽植容器为上口径27 cm的白色塑料盆钵,每盆装土8 kg左右。
1.2 试验方法
1.2.1 试验设计
本试验采用单因素随机试验设计。根据2011年8月至11月在成熟核桃林下观测结果,成熟的核桃叶年凋落量约10000 kg/hm2,折算到试验所用盆钵盆口面积上约60 g/盆,故采用60 g作为基本施入量。由于林分生长和环境条件(如风力和动物扰动)的差异,不同林地单位面积上核桃凋落量不一致,因此试验中设置0 g/盆(CK),30 g/盆(A1),60 g/盆(A2),90 g/盆(A3)4个梯度水平,每个水平设置12个重复,共48盆。2011年11月20日在雅安市四川农业大学科研园区,将剪成约1 cm2碎片(以利于与土壤均匀混合)的凋落叶按设计量与土壤混合装盆,并在其表层覆盖未混合凋落叶的土壤3cm, 以利于播种。于当天播种小麦种子30粒/盆,一次性浇透水,之后每2 d浇1次。用HH2土壤水分速测仪(ML2x,GBR)监测土壤水分含量,保证土壤体积含水量维持在18%左右。
为观测施加凋落叶对土壤通气透水性以及对根系生长的物理阻隔是否对受体植物的生长产生明显的影响,设置补充试验,方法是将凋落叶蒸煮12 h后,先后置于80% 丙酮和乙醇中,常温下浸提24 h,再置于蒸锅中蒸煮12 h,尽可能去除凋落叶中的水溶性的和非水溶性次生代谢物(含化感物质)。同样设置0(CK)、30 g/盆(B1)、60 g/盆(B2)和90 g/盆(B3)4个凋落叶水平,每个处理设置3个重复,凋落叶处理、与土壤混合以及小麦播种方法同上。
1.2.2 测定指标及方法
2011年11月20日播种,播种后分75、95、115、160 d 4次取样,前3次随机抽取各处理幼苗30株测定茎秆地径、茎高、株高、及地上部分生物量,并取同一部位(前3次从顶端向下数取第3片叶,最后1次取旗叶)新鲜叶片测定其抗性生理指标。
补充试验于2012年11月20日播种,观察生长期间各处理间是否有差异,播种60 d时测定其茎秆地径、株高、地上部分干重。
茎秆地径测定:测定植株土壤表面处外径宽度。
茎高测定:测定时从土壤表面量到植株茎顶端。
株高测定:测定时从土壤表面量到植株顶端。
地上部分生物量测定:将每株植株地上部分在通风干燥箱内105℃杀青,然后80℃烘至恒定质量。
超氧化物歧化酶SOD活性测定:采用氮蓝四唑法[21],以抑制NBT光化还原的50%为一个酶活单位u。
过氧化物酶POD活性测定:参照愈创木酚法[22],将每min OD增加0.01定义为1个酶活单位u。
过氧化氢酶CAT活性测定:参照紫外分光光度法[22],以1 min内OD减少0.1为一个酶活单位u。
丙二醛 (MDA)与可溶性糖含量测定:采用硫代巴比妥酸加热显色法[23]。
可溶性蛋白含量测定:采用考马斯亮蓝G250法[23]。
1.2.3 数据处理
化感效应指数(RI)采用Williamson等[24]的方法,RI=1-C/T(当T≥C时)或RI=T/C-1 (当T
所有数据均采用 SPSS16.0统计分析软件(SPSS Inc, USA) 进行单因素方差分析(One-way ANOVA),并用最小显著差数法(LSD法)进行多重比较。
2 结果与分析
2.1 核桃凋落叶分解对小麦茎秆地径、茎高、株高、地上部分干重的影响
由表1可知,核桃凋落叶对小麦生长的影响除75 d 茎高变化不显著(P>0.05)以及95 d茎高和地上部分干重有低浓度促进高浓度抑制的趋势外,其它各指标的变化规律均随着凋落叶施入量的增加呈现出显著的下降趋势(P<0.05)。160 d与115 d相比,除茎秆地径外,其余各项指标的抑制作用均有减缓趋势。
从化感指数看,各时期除茎高外,其余指标均表现为A2与A1差异明显,与A3差异明显减小,说明当核桃凋落叶在土壤中的含量达到一定程度之后,小麦生长受到抑制的程度并没有明显增加。
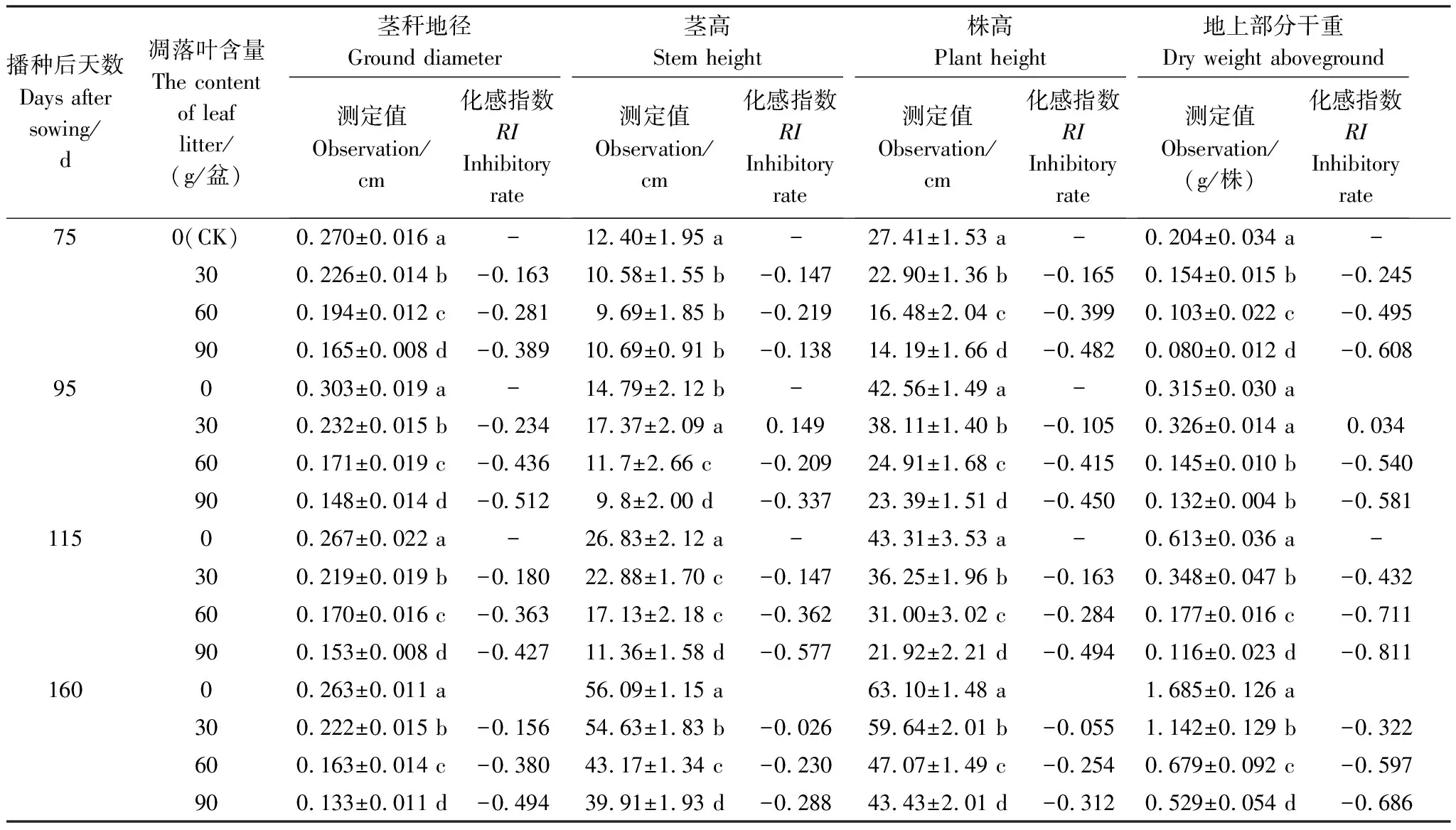
表1 核桃凋落叶不同处理量对小麦茎秆地径、茎高、株高、地上部分干重的影响
2.2 核桃凋落叶分解对小麦叶片抗氧化酶活性的影响
2.2.1 SOD活性
由图1可以看出,当核桃凋落叶分解到95 d和115 d时,小麦叶片SOD活性均表现为A1处受抑制,A2、A3处为促进作用,且在A3处达到显著水平(P<0.05);160 d时,随着凋落叶量的增加SOD活性上升,与CK相比A2、A3均达到显著水平(P<0.05)。

图1 核桃凋落叶不同处理量对小麦超氧化物歧化酶(SOD)活性的影响
2.2.2 POD活性
各凋落叶处理下小麦叶片POD活性与CK相比均表现为显著(P<0.05)的抑制作用(图2)。75—95 d时,除CK外,随凋落叶量的增加POD活性呈现上升的趋势;115—160 d,随凋落叶量增加POD活性下降,但各凋落叶处理间差异不显著(P>0.05)。

图2 核桃凋落叶不同处理量对小麦过氧化物酶(POD)活性的影响

图3 核桃凋落叶不同处理量对小麦过氧化氢酶(CAT)活性的影响

图4 核桃凋落叶不同处理量对小麦丙二醛(MDA)含量的影响
2.2.3 CAT活性
由图3可知,75—115 d时各凋落叶处理CAT活性与CK相比均表现为抑制作用(RI<0),115 d时均达到显著水平(P<0.05);160 d时,随凋落叶量的增加CAT活性显著上升(P<0.05,RI>0)。
2.3 核桃凋落叶分解对小麦叶片丙二醛(MDA)含量的影响
由图4可知,75 d时MDA含量变化不大;95 d 时仅A3处理MDA含量显著高于CK(P<0.05);115 d时,MDA含量随凋落叶量的增加显著增加(P<0.05);160 d时,A1、A2处理与CK相比呈现出显著的抑制作用(RI<0)。
2.4 核桃凋落叶分解对小麦叶片渗透调节物质的影响
2.4.1 可溶性糖含量

图5 核桃凋落叶不同处理量对小麦可溶性糖含量的影响
从图5可以看出,75—115 d时,可溶性糖含量除95 d时A2水平略低于CK外,各凋落叶处理均显著高于CK(P<0.05),并随着凋落叶量的增加呈现出增加的趋势;160 d时呈现出相反的趋势,随凋落叶量的增加可溶性糖含量下降(RI<0)。
2.4.2 可溶性蛋白含量
由图6可知,可溶性蛋白含量与可溶性糖含量的变化趋势相反,75—115 d时各凋落叶处理均显著低于CK(P<0.05),95—115 d随凋落叶量的增加呈现出下降的趋势;160 d时,随着凋落叶量的增加可溶性蛋白含量显著增加(P<0.05)。
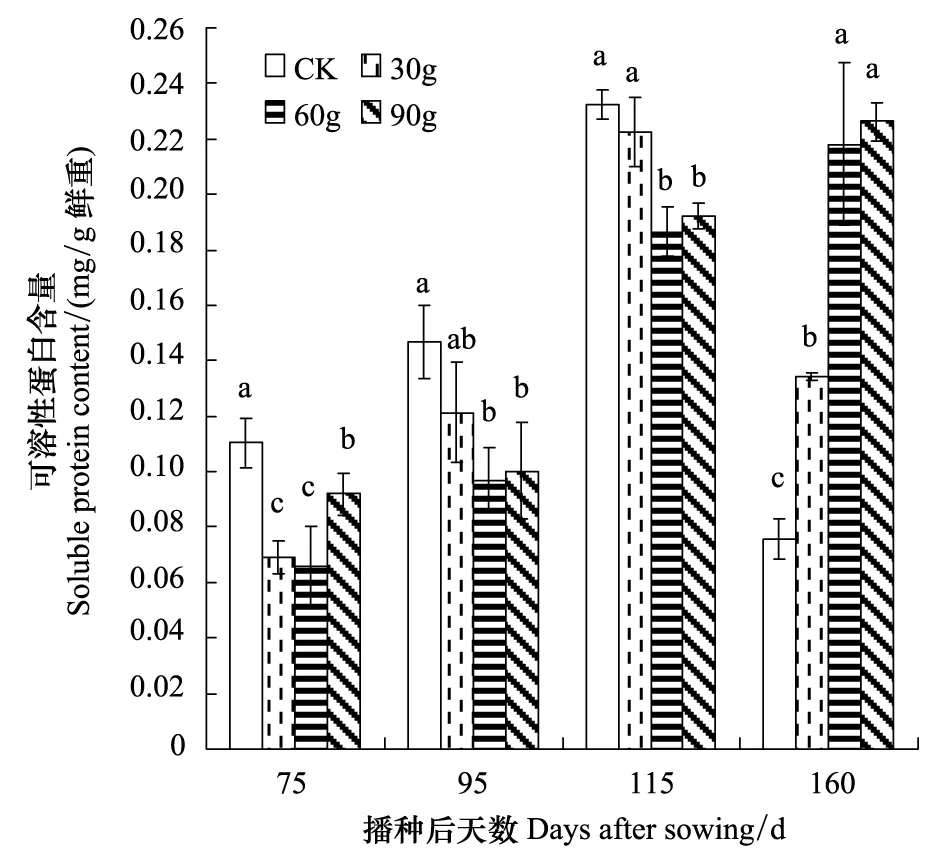
图6 核桃凋落叶不同处理量对小麦可溶性蛋白含量的影响
2.5 核桃凋落叶分解对小麦的化感综合效应
从表2中可以看出,各凋落叶处理对小麦均表现为抑制效应。75—115 d时,除95 d A1下降外其它均随着凋落叶处理量的增加抑制效应增强;115—160 d时各凋落叶处理下小麦均有一定恢复,A1水平甚至已接近CK水平,A2与A3处理对小麦的抑制效应也基本降至同一水平;A2与A1相比增加的抑制效应明显高于A3比A2增加的抑制效应。

表2 核桃凋落叶不同处理量对小麦的化感综合效应CE
2.6 浸提蒸煮后的核桃凋落叶分解对小麦茎秆地径、株高、地上部分干重的影响
从表3中可以看出, 60 d时CK、B1和B2处理下小麦茎秆地径、株高、地上部分干重之间差异不显著(P>0.05),仅高量处理B3与其它各处理差异显著(P<0.05),但RI绝对值与未经处理凋落叶A3相比明显减小。

表3 浸提蒸煮后的核桃凋落叶不同处理量在土壤中分解初期对小麦形态生长的影响
3 讨论
有研究表明,核桃叶中含有萘醌及苷类、黄酮类、多酚类、萜类、酸类等多种化感物质[25- 26],而化感物质能显著地影响植物生长和相关酶过程、植物光合作用、植物呼吸作用、蛋白质和核酸的代谢、植物对营养和水分的吸收等方面[27]。
本试验表明,核桃凋落叶在其初期分解过程中对小麦各项生长指标均表现为抑制作用,在75—115 d期间,随着凋落叶量的增加抑制效应增强,160 d时各项生长指标均有一定程度的恢复,这与黄溦溦等[28]和陈洪[29]等分别以银木凋落叶和巨桉凋落叶为供体的研究结果一致。前期的抑制效应是由于核桃凋落叶释放的次生代谢物质在土壤中不断积累造成的;后期因为凋落叶在土壤中的分解超过了5个月,其释放的次生代谢物已经减少,同时,微生物的作用也可能减少了这些次生代谢物质在土壤中的积累。中量凋落叶处理(A2)与低量处理(A1)小麦的形态指标差异较大(净增量大),但与A3的差异明显减小,说明凋落叶量的继续增加没有明显增强对小麦生长的抑制作用,表明当核桃凋落叶在土壤的含量达到一定程度之后,其化感强度并不会明显增加。

本试验中,160 d时随着凋落叶量的增加SOD和CAT活性上升,POD仍然呈下降趋势,这与候必新等[33]研究棕色彩棉子叶衰老过程中的变化一致。由于此时小麦叶片已进入衰老期,而叶片衰老常伴随抗氧化酶活性的降低[34],因此可能是核桃凋落叶分解释放出的次生代谢物质抑制了小麦的发育进程,使CK水平下的小麦叶片先于凋落叶处理进入衰老期,导致SOD和CAT活性较低。与SOD和CAT不同,POD活性可以在逆境或衰老后期升高,从而参与活性氧的生成及叶绿素的降解[35]。王虹等[36]研究黄瓜叶片时,均发现伴随叶片的衰老POD活性上升,因此160 d 时POD活性呈下降趋势可能是CK水平下的小麦叶片先进入衰老后期。160 d时,A1、A2处理MDA含量显著低于CK,也可能与小麦叶片进入衰老期的前后有关。
逆境胁迫下,植物细胞内积累一些渗透调节物质,以调节细胞内的渗透势,维持水分平衡,同时还可以保护细胞内代谢活动所需的酶类活性。75—115 d时,随着处理量的增加,小麦叶片可溶性糖含量上升,可溶性蛋白含量下降,这与黄溦溦等[28]和陈洪等[29]的研究结果一致。盐胁迫、干旱胁迫、低温胁迫、低氧胁迫均可以使植物体内可溶性糖含量增加[37]。可溶性蛋白含量下降可能是化感胁迫致使受体内蛋白质降解转化成了蔗糖、葡萄糖等小分子的可溶性糖。研究表明,植物在遭受酚酸胁迫时,体内总蛋白质的合成速率下降,原有的一些蛋白质的合成受到抑制[38]。本试验只研究了核桃凋落叶的化感物质对可溶性糖和可溶性蛋白总量的变化,而它们具体组成成分的变化及化感物质对其作用机制有待深入研究。
经有机溶剂浸提并蒸煮后的核桃凋落叶对小麦生长的影响不大,表明在一定的凋落叶施入量范围内,其对土壤物理性质的影响和对小麦根系生长的物理阻隔作用不太明显,不会显著抑制小麦的生长,而其分解过程中释放的次生代谢物质才是抑制小麦生长的主导因素,这与黄溦溦[28]等和吴秀华等[39]分别以银木凋落叶和巨桉凋落叶为供体的研究结果一致。
综上,核桃凋落叶在分解释放次生谢物质的过程中,破坏了小麦的抗氧化酶系统,小麦细胞遭受了较严重的损害,从而限制了植株的生长,最终影响到生物量的积累。
核桃化感作用的研究报道较多,但相关报道多见于对核桃根系分泌的化感物质胡桃醌的研究,对于核桃凋落叶化感作用的研究报道较少。本试验从抗性生理的角度研究了核桃凋落叶在土壤内分解过程中对受体小麦的化感作用,在一定程度上模拟了自然状态下凋落物分解对受体植物的影响,今后还应深入开展更接近于生产实际的野外定位控制试验。同时对其化感物质的种类和含量,以及对受体植物的其它作用方式进行深入研究。
:
[1] Rice E L. Pest Control with Nature′s Chemicals. Hu D X translate. Beijing: Science Press, 1988: 9- 10.
[2] Rice E L. Allelopathy. 2nd ed. New York: Academic Press Inc., 1988: 309- 315.
[3] Peng S L, Shao H. Research significance and foreground of allelopathy. Chinese Journal of Applied Ecology, 2001, 12(5): 780- 786.
[4] Wang Y L, Wu F Z. Allelopathy in the intercropping mixed cropping and its research methods. Northern Horticulture, 2009, (8): 136- 139.
[5] Huang Q Q, Shen Y D, Li X X, Cheng H T, Song X, Fan Z W. Research progress on the distribution and invasiveness of alien invasive plants in China. Ecology and Environmental Sciences, 2012, 21(5): 977- 985.
[6] Mei Q, Wu Z Z. Why the development of walnut industry is the fastest than ever before. (2011- 9- 6)[2012- 4- 1]. http://www.cnhetao.com/shownews.asp?id=3258.
[7] Xue J H, Yang W M. Allelopathy of walnut leaf water extracts on black soybean seedling. Journal of Anhui Agricultural Sciences, 2010, 38(29): 16120- 16123.
[8] Jose S, Gillespie A R. Allelopathy in black walnut (JuglansnigraL.) alley cropping. II. Effects of juglone on hydroponically grown corn (ZeamaysL.) and soybean (GlycinemaxL. Merr.) growth and physiology. Plant and Soil, 1998, 203(2): 199- 205.
[9] Willis R J.Juglansspp., juglone, and allelopathy. Allelopathy, 2000, 7(1): 1- 55.
[10] Busto M D, Perez-Mateos M. Characterization of Beta-d-glucosidase extracted form soil fractions. European Journal of Soil Science, 2000, 51(2): 193- 200.
[11] Duroux L, Delmotte F M, Lancelin J M, Kéravis G, Jay-Allemand C. Insight into naphthoquinone metabolism: Beta-glucosidase-catalysed hydrolysis of hydrojuglone beta-D-glucopyranoside. Biochemical Journal, 1998, 333(Pt 2): 275- 283.
[12] Jose S, Gillespie A R. Allelopathy in black walnut (JuglansnigraL.) alley cropping. I. Spatio-temporal variation in soil juglone in a black walnut-corn (ZeamaysL.) alley cropping system in the midwestern USA. Plant and Soil, 1998, 203(2): 191- 197.
[13] Rice E L. Allelopathy // Kong C H, Hu F. Allelopathy and Its Application. Beijing: China Agricultural Press, 2001: 128.
[14] Bertin C, Yang X, Weston L A. The role of root exudates and allelochemicals in the rhizosphere. Plant and Soil, 2003, 256: 67- 83.
[15] Bie Z X, Zhai M Z, He L H, Wang T, Jing B N. The allelopathy of hydreous extracts of walnut green husk on wheat and clover seedlings. Journal of Northwest Forestry University, 2007, 22(6): 108- 110.
[16] Zhang F Y, Zhai M Z, Mao F C, Zhao B X. The effect of walnut peel′s extracts on seedling growth of some crops. Acta Agriculturae Boreali-Occidentalis Sinica, 2005, 14(1): 62- 65.
[17] Wang T, Zhai M Z, Jia C X, Zhang R Q. Study on the allelopathic activity of secondary metabolites from walnut green husk. Journal of Northwest Forestry University, 2008, 23(3): 160- 162.
[18] Zhai M Z, Gao X H, Zhao C X, Huang Y L. Study on allelopathy of aqueous extracts from walnut leaf and stem. Acta Agriculturae Boreali-Occidentalis Sinica, 2006, 15(3): 179- 182.
[19] Inderjit, Weiner J. Plant allelochemical interference or soil chemical ecology? Perspectives in Plant Ecology, Evolution and Systematics, 2001, 4(1): 3- 12.
[20] Inderjit, Nilsen E T. Bioassays and field studies for allelopathy in terrestrial plants: Progress and problems. Critical Reviews in Plant Science, 2003, 22(3): 221- 238.
[21] Giannopolitis C N, Roes S K. Superoxide dismutases. I. Occurrence in high plants. Plant Physiology, 1977, 59(2): 309- 314.
[22] Gao J F. Experiment Guidance for Plant Physiology. Beijing: Higher Education Press, 2006: 214- 215, 217- 218.
[23] Xiong Q E. Plant Physiology Experiments Tutorial. Chengdu: Sichuan Science and Technology Press, 2003: 126- 127, 85- 85.
[24] Williamson G B, Rich A D. Bioassays for allelopathy: measuring treatment responses with independent controls. Journal of Chemical Ecology, 1998, 14(1): 181- 182.
[25] Yao H Y, Tan J C, Zhang A L, Xu Y P. Advances in research of the chemistry and bioactivity of Juglans plants. Acta Botanica Boreali-Occidentalia Sinica, 2003, 23(9): 1650- 1655.
[26] Sun M L, Song Z Q, Fang G Z. Antifungal activities and active components of alcoholic extracts from leaves of Juglans Mandshurica Maxmi. Chemistry and Industry of Forest Products, 2007, 27: 81- 83.
[27] Kong C H, Hu F. Allelopathy and Its Application. Beijing: China Agriculture Press, 2001: 164- 164, 160- 160.
[28] Huang W W, Hu T X, Zhang N N, Xiao Y L, He Y Y, Li Z B, Ding W. Effects of leaf fitter ofCinnamomumseptentrionaleon growth and resistance physiology ofBrassicarapain the decomposition process of fitter. Acta Ecologica Sinica, 2012, 32(12): 3883- 3891.
[29] Chen H, Hu T X, Yang W Q, Wu X H, Yin L, Li B, Mi X H, Zeng F M, Gong P. Effects ofEucalyptusgrandisleaf litter on growth and resistance physiology ofElymussibiricusin the initial decomposition process of litter in soil. Acta Prataculturae Sinica, 2011, 20(5): 57- 65.
[30] Li K, Guo X W, Guo Y S, Li C X, Xie H G, Hu X X, Zhang L H, Sun Y N. Allelopathy of grape root aqueous extracts. Chinese Journal of Applied Ecology, 2010, 21(7): 1779- 1784.
[31] Zhang R M, Wang Y Z, Hou P, Wen G S, Gao Y. Physiological responses to allelopathy of aquatic stem and leaf extract ofArtemisiafrigidain seedling of several pasture plants. Acta Ecologica Sinica, 2010, 30(8): 2191- 2204.
[32] Liu J X, Hu H B, Wang X. Allelopathic effect of aqueous extract from cucumber (CucumissativusL.) aboveground part on tomato (LycopersiconesculentumMill). Chinese Journal of Eco-Agriculture, 2009, 17(2): 312- 317.
[33] Hou B X, Tang Z H, Wan H X, Zhou T. A study of the chlorophyll content and enzyme during the period of senescence of the brown cotton cotyledons. Journal of Hunan University of Arts and Science, 2008, 20(3): 49- 52.
[34] Wang Z. Plant Physiology. Beijing: China Agriculture Press, 2000: 422- 423.
[35] Zhao L Y, Deng X P, Shan L. The response mechanism of active oxygen species removing system to drought stress. Acta Botanica Boreali-Occidentalia Sinica, 2005, 25(2): 413- 418.
[36] Wang H, Jiang Y P, Shi K, Zhou Y H, Yu J Q. Effects of light quality on leaf senescence and activities of antioxidant enzymes in cucumber plants. Scientia Agricultura Sinica, 2010, 43(3): 529- 534.
[37] Gao Y Z, Wang Y H, Wang J T, Liu J X, Wang D L. Research advances in the responses of carbohydrates in grassland plants to environmental stress. Chinese Journal of Applied Ecology, 2009, 20(11): 2827- 2831.
[38] Chen S L, Zhou B L, Lin S S, Li X, Ye X L. Effects of cinnamic acid and vanillin on grafted eggplant root growth and physiological characteristics. Chinese Journal of Applied Ecology, 2010, 21(6): 1446- 1452.
[39] Wu X H, Hu T X, Yang W Q, Chen H, Hu H L, Tu L H, Pan Y X, Zeng F M. Effects ofEucalyptusgrandisleaf litter decomposition on the growth and photosynthetic characteristics ofCichoriumintybus. Chinese Journal of Applied Ecology, 2012, 23(1): 1- 8.
参考文献:
[1] 赖斯. 天然化学物质与有害生物防治. 胡敦孝, 译. 北京: 科学出版社, 1988: 9- 10.
[3] 彭少麟, 邵华. 化感作用的研究意义及发展前景. 应用生态学报, 2001, 12(5): 780- 786.
[4] 王玉彦, 吴凤芝. 间套混作中的化感作用及其研究方法. 北方园艺, 2009, (8): 136- 139.
[5] 黄乔乔, 沈奕德, 李晓霞, 程汉亭, 宋鑫, 范志伟. 外来入侵植物在中国的分布及入侵能力研究进展. 生态环境学报, 2012, 21(5): 977- 985.
[6] 梅青, 吴兆喆. 我国核桃产业发展缘何热度空前? (2011- 9- 6) [2012- 4- 1]. http://www.cnhetao.com/shownews.asp?id=3258.
[7] 薛金辉, 杨卫民. 核桃叶水浸液对黑豆幼苗的化感效应. 安徽农业科学, 2010, 38(29): 16120- 16123.
[15] 别智鑫, 翟梅枝, 贺立虎, 王婷, 景炳年. 核桃青皮水提液对小麦和三叶草的化感作用研究. 西北林学院学报, 2007, 22(6): 108- 110.
[16] 张凤云, 翟梅枝, 毛富春, 赵彬希. 核桃青皮提取物对几种作物幼苗生长的影响. 西北农业学报, 2005, 14(1): 62- 65.
[17] 王婷, 翟梅枝, 贾彩霞, 张瑞启. 核桃青皮中次生代谢物质的化感活性研究. 西北林学院学报, 2008, 23(3): 160- 162.
[18] 翟梅枝, 高小红, 赵彩霞, 黄钰铃. 核桃枝叶水溶物的化感作用研究. 西北农业学报, 2006, 15(3): 179- 182.
[22] 高俊凤. 植物生理学实验指导. 北京: 高等教育出版社, 2006: 214- 215, 217- 218.
[23] 熊庆娥. 植物生理学实验教程. 成都: 四川科学技术出版社, 2003: 126- 127, 85- 85.
[25] 姚焕英, 唐静成, 张鞍灵, 胥耀平. 核桃属植物化学成分及生物活性研究. 西北植物学报, 2003, 23(9): 1650- 1655.
[26] 孙墨珑, 宋湛谦, 方桂珍. 核桃楸叶乙醇提取物的抑菌活性及活性成分分析. 林产化学与工业, 2007, 27: 81- 84.
[27] 孔垂华, 胡飞. 植物化感相生相克作用及其应用. 北京: 中国农业出版社, 2001: 164- 164, 160- 160.
[28] 黄溦溦, 胡庭兴, 张念念, 肖银龙, 何远洋, 李仲彬, 丁伟. 银木凋落叶腐解过程对小白菜生长和抗性生理的影响. 生态学报, 2012, 32(12): 3883- 3891.
[29] 陈洪, 胡庭兴, 杨万勤, 吴秀华, 尹丽, 李彬, 米小华, 曾凡明, 弓平. 巨桉凋落叶分解初期对老芒麦幼苗生长和抗性生理的影响. 草业学报, 2011, 20(5): 57- 65.
[30] 李坤, 郭修武, 郭印山, 李成祥, 谢洪刚, 胡禧熙, 张立恒, 孙英妮. 葡萄根系浸提液的化感作用. 应用生态学报, 2010, 21(7): 1779- 1784.
[31] 张汝民, 王玉芝, 侯平, 温国胜, 高岩. 几种牧草幼苗对冷蒿茎叶水浸提液化感作用的生理响应. 生态学报, 2010, 30(8): 2191- 2204.
[32] 刘建新, 胡浩斌, 王鑫. 黄瓜地上部水浸液对番茄的化感抑制效应. 中国生态农业学报, 2009, 17(2): 312- 317.
[33] 侯必新, 唐智华, 万海清, 周亭. 棕色彩棉子叶衰老过程中叶绿素含量与酶活性的研究. 湖南文理学院学报, 2008, 20(3): 49- 52.
[34] 王忠. 植物生理学. 北京: 中国农业出版社, 2000: 422- 423.
[35] 赵丽英, 邓西平, 山仑. 活性氧清除系统对干旱胁迫的响应机制. 西北植物学报, 2005, 25(2): 413- 418.
[36] 王虹, 姜玉萍, 师恺, 周艳虹, 喻景权. 光质对黄瓜叶片衰老与抗氧化酶系统的影响. 中国农业科学, 2010, 43(3): 529- 534.
[37] 高英志, 王艳华, 王静婷, 刘鞠善, 王德利. 草原植物碳水化合物对环境胁迫响应研究进展. 应用生态学报, 2009, 20(11): 2827- 2831.
[38] 陈绍莉, 周宝利, 蔺姗姗, 李夏, 叶雪凌. 肉桂酸和香草醛对嫁接茄子根系生长及生理特性的影响. 应用生态学报, 2010, 21(6): 1446- 1452.
[39] 吴秀华, 胡庭兴, 杨万勤, 陈洪, 胡红玲, 涂利华, 泮永祥, 曾凡明. 巨桉凋落叶分解对菊苣生长及光合特性的影响. 应用生态学报, 2012, 23(1): 1- 8.

