难溶药物格列美脲的片剂处方设计及溶出评价
李海鹰,杨文智,马丽兰,李霞霞,申世刚
(1.河北大学药学院,河北保定 071002;2.河北大学化学与环境科学学院,河北保定 071002)
难溶药物格列美脲的片剂处方设计及溶出评价
李海鹰1,2,杨文智1,马丽兰1,李霞霞1,申世刚2
(1.河北大学药学院,河北保定 071002;2.河北大学化学与环境科学学院,河北保定 071002)
采用研磨法混合主辅料,经湿法制粒压片,自制格列美脲片(GMT)和羟丙基-β-环糊精格列美脲片(HP-β-CDGMT)并对其进行质量评价.制备的片剂中崩解剂为质量分数5%低取代羟丙基纤维素,稀释剂为预胶化淀粉与微晶纤维(质量比5∶1),黏合剂为质量分数10%淀粉浆.2种自制片的片重差异、脆碎度、含量和含量均匀度,均符合2010版中国药典规定.HP-β-CDGMT溶出与GMT相比,明显得到改善.添加HP-β-CD辅料的优化片剂处方,工艺简单易行且自制HP-β-CDGMT主药溶出符合美国药典(USP 35)要求.
格列美脲;羟丙基-β-环糊精;湿法制粒压片;溶出度
格列美脲(glimepiride,GM),商品名Amaryl,属第3代磺酰脲类降糖药,是FDA批准的第1个可与胰岛素同时使用治疗II型糖尿病的新药,相比其他磺酰脲类口服降糖药,具有起效快、作用强、剂量小等优点[1].格列美脲在水中溶解度极低,文献报道其溶解度为1.6mg/L[2],从而导致药物难以溶出,生物利用度降低,因此改善难溶性药物的溶出具有现实意义.寻找适宜的技术方法增大格列美脲的溶解度,是其剂型设计首要解决的问题.Seedher等[3]利用潜溶技术,使格列美脲溶解度增大153倍.Sebastjan等[4]采用固体分散体技术,制备格列美脲的聚胺酯超支聚合物固体分散体,可改善格列美脲体外溶出.Ammar等[5-6]联用包合物和固体分散体技术,制备格列美脲环糊精包合物并分散于水溶性固体基质中,可加快格列美脲药物的体外溶出.以上报道方法虽可增大格列美脲溶解度或改善其溶出,但用于制剂工艺有一定难度.环糊精可提高药物的溶解度,文献[7]采用研磨法制备环糊精诺氟沙星片剂,有效改善了难溶性药物诺氟沙星的溶出度且工艺简单易行.HP-β-CD是β-环糊精的衍生物,羟丙基的引入破坏了β-CD分子内的氢键,从而可提高水溶性并降低溶血性[8-9].因此,HP-β-CD被广泛应用于改善难溶性药物的溶解性,提高生物利用度方面研究.本文通过采用研磨法混合主辅料,湿法制粒压片,获得2种自制片GMT(自制格列美脲片)和HP-β-CDGMT,并考察GMT和HP-β-CDGMT的溶出,希望获得溶出合格的格列美脲片剂处方工艺,其研究数据可为小剂量难溶性药物片剂剂型设计提供参考.
1 仪器与试剂
UV-8500型紫外可见分光光度计(上海天美科学仪器有限公司);FL2200型高效液相色谱仪(浙江福立分析仪器有限公司);pHS-3C型酸度计(上海精密科学仪器有限公司);ZB-1C型智能崩解仪(天津大学精密仪器厂);D-800L型智能药物溶出仪(天津大学无线电厂);CS-2型脆碎度测试仪(天津市光学仪器厂);TDP-5型单冲压片机(上海天翔健台制药机械有限公司).
格列美脲(湖北康宝泰精细化工有限公司);HP-β-环糊精(江苏丰园生物技术有限公司);药用淀粉、微晶纤维、预胶化淀粉、硬脂酸镁、低取代羟丙基纤维素(L-HPC)、可溶性淀粉均为安徽山河药用辅料有限公司生产;水为重蒸馏水.
2 方法与结果
2.1 格列美脲片的制备
依文献[7]所述方法优化空白片处方,考察稀释剂、黏合剂和崩解剂等3个因素的影响.最终选定稀释剂为预胶化淀粉与微晶纤维(质量比5∶1),崩解剂为质量分数5%低取代羟丙基纤维素,以质量分数10%淀粉浆为黏合剂,加入质量分数0.5%硬脂酸镁作为润滑剂,所制得的空白片在1min内崩解.
按表1分别取处方量主药置于研钵中或与HP-β-CD研磨30min,按等量递加法先后加入处方量的过(180±7.6)μm筛的低取代羟丙基纤维素、微晶纤维和预胶化淀粉,混合均匀,缓慢加入质量分数10%的淀粉浆适量制成软材,(850±29)μm筛制粒,在60℃干燥后,用(850±29)μm筛整粒,剩余粉末进行二次制粒.加入干颗粒质量0.5%(质量分数)的硬脂酸镁为润滑剂,混合均匀后,压制片质量为200mg GMT或HP-β-CDGMT,每片含格列美脲1mg.
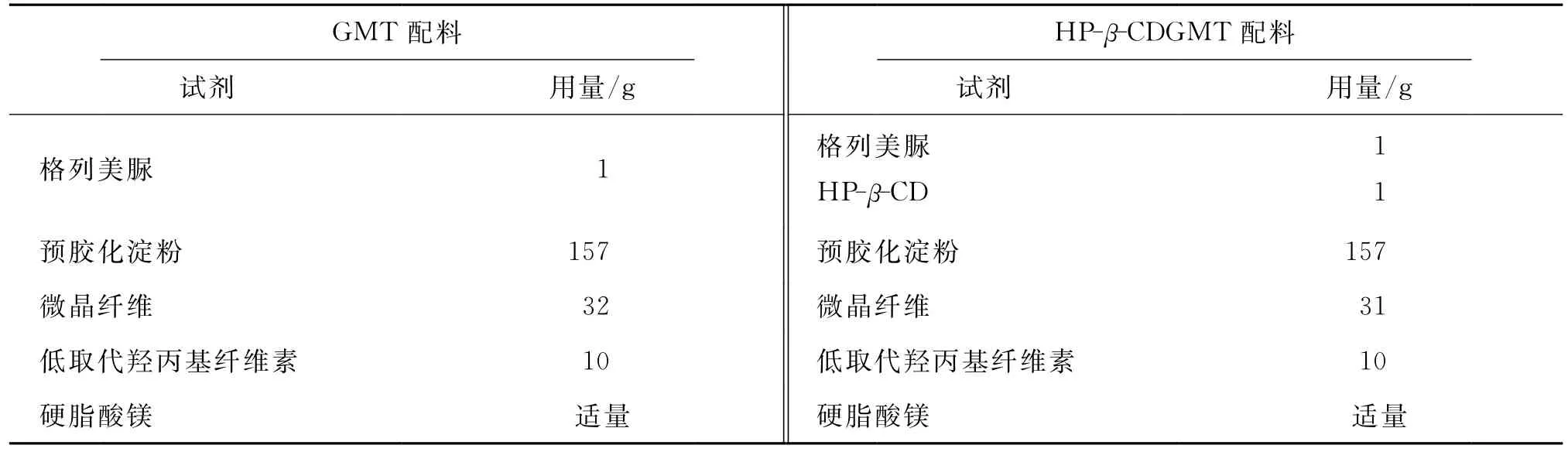
表1 GMT及HP-β-CDGMT的处方Tab.1 Ingredients and excipients of tablets
2.2 制备片剂的含量测定
2.2.1 检测波长的确定 称取格列美脲原料药、片剂辅料及HP-β-CD适量,加流动相配制成待测溶液,用紫外分光光度计分别进行扫描.依据紫外扫描曲线,确定227nm为格列美脲的检测波长,在此波长处,HP-β-CD等辅料对格列美脲检测无干扰,见图1a.
2.2.2 色谱条件 色谱柱为Hypersil BDS C18(4.6mm×150mm,5μm);流动相为CH3OH-0.025mol/L NH4H2PO4(体积比75∶25,);流速为1.0mL/min;柱温为室温;进样量为20μL.格列美脲6.1min出峰,辅料无干扰.见图1b.
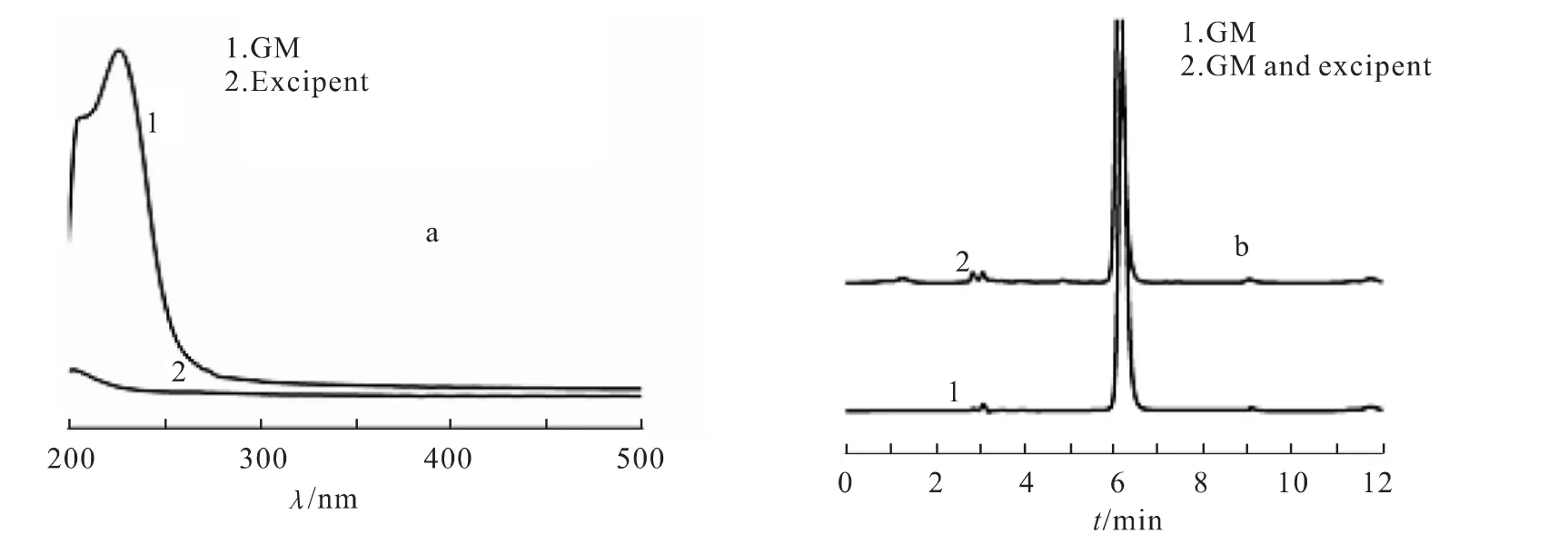
图1 格列美脲样品UV扫描图谱和HPLC色谱Fig.1 UV Scanning spectrogram and HPLC chromatogram of glimepiride
2.2.3 标准曲线的建立 精密称取105℃干燥至恒重的格列美脲10mg至100mL量瓶中,加入流动相,超声,定容,摇匀.再精密吸取上述溶液分别配成不同质量浓度的标准液,进行色谱分析.以峰面积(y)对质量浓度(x)进行回归分析,其回归方程为y=1.16×104+6.20×104x,r=0.999 9(n=8),线性为0.1~50mg/L.
2.2.4 精密度实验 分别配制1,20,40mg/L的格列美脲标准溶液,连续测定5次,记录峰面积,样品的日内RSD值分别为0.62%,0.46%,0.58%.在相同条件下连续测定5d,日间RSD值分别0.98%,0.65%,0.80%,方法精密度和样品稳定性良好.
2.2.5 回收率实验 取同一批号的样品溶液,加入高、中、低3种质量浓度的格列美脲对照品溶液,每种质量浓度各3份,进行HPLC分析,计算加样回收率.加样回收率为98.9%~102.0%,平均回收率为100.1%.
2.2.6 含量测定 取2种格列美脲片剂各20片,精密称定,研细.精密称取适量药粉于50mL量瓶中,加入流动相超声处理使格列美脲溶解,定容,摇匀,过滤,取续滤液进行色谱分析,计算药物含量,结果见表2.

表2 格列美脲片剂的检查Tab.2 Quality controlled results of glimepiride tablets
2.3 格列美脲片剂的检查
片重差异和脆碎度的检查:分别依照2010版中国药典附录IA和XG项下进行检查,结果见表2.
含量均匀度检查:取本品1片,精密称定,依2.2.6项下含量测定方法进行分析,计算含量,应符合规定(2010版中国药典附录XE).
溶出度检查:取本品,依照中国药典(2010版)附录XC溶出度测定第三法进行测定.以质量分数0.02%三羟甲基氨基甲烷(trihydroxymethyl aminomethane,Tris)100mL为溶出介质,转速为75r/min.45min时取溶液滤过,续滤液进行色谱分析;或参照美国药典(USP 35)采用浆法测定格列美脲片剂溶出,转速为75r/min,900mL pH 7.8磷酸盐缓冲液(phosphate buffer,PBS)为溶出介质,15min取溶液2 500r/min离心5min,HPLC分析,考察溶出度,结果见表2.
由表2可知:2种自制格列美脲片剂,其含量均匀度、片重差异、含量及脆碎度均符合2010版中国药典的规定.2种自制片在0.02%Tris溶出介质中,45min药物溶出度均大于标示量的90%;在USP 35规定的磷酸盐缓冲液溶出介质中,仅HP-β-CDGMT符合要求,15min溶出度大于标示量的80%.
2.4 体外释放曲线的绘制
依照2010版中国药典附录XC第三法及文献[10,11]考察自制片剂的释放情况,释放介质分别为100mL的质量分数0.02%Tris溶液、PBS(pH 7.4)、0.05mol/L盐酸溶液(pH 1.3)和蒸馏水,转速为75r/min.分别在0,5,10,15,20,30,45和60min取溶液适量并补加(37±0.5)℃的等体积释放介质,过滤,取续滤液进行HPLC分析,绘制格列美脲释放量与时间关系曲线.图2为自制GMT在质量分数0.02% Tris、PBS(pH 7.4)和pH为1.3盐酸溶液中的释放曲线,格列美脲在偏酸或中性条件下释放缓慢,这与文献报道采用900mL pH 7.8的PBS为释放介质,格列美脲50min释放45%相一致[12].

图2 GMT在不同释放介质中的释放曲线Fig.2 Comparison of glimepiride tablets release in different solution
图3为GMT和HP-β-CDGMT分别在质量分数0.02%Tris和蒸馏水中的释放曲线.以质量分数0.02%Tris为释放介质,HP-β-CDGMT在45min溶出达到(98.2±0.7)%,优于GMT.而以蒸馏水为释放介质,HP-β-CDGMT溶出速率依然大于GMT,2种片剂在60min溶出均低于标示量的50%.以上结果表明:释放介质不同,格列美脲片溶出存在差异,HP-β-CD作为辅料加入可改善格列美脲药物的溶出.
2010版中国药典未收载格列美脲药物及其制剂,故以美国药典(USP 35)为标准考察自制片的溶出.GMT和HP-β-CDGMT释放曲线见图4.由图可知:HP-β-CDGMT释放格列美脲较GMT快.经统计学Student-t检验,2种片剂的药物释放曲线存在显著性差异(p<0.05).
本文中少量HP-β-CD辅料替代稀释剂淀粉,对片剂压制成型影响不大.环糊精包合物的制备方法有饱和溶液法、研磨法、冷冻干燥法、喷雾干燥法和超声波法等[13],每种方法均有各自优势,但从工艺和成本预算上考虑,研磨法最为简单、方便且经济[14].文献报道采用研磨法成功制备京尼平-β-环糊精包合物,制备工艺简单快速,且包合效果良好[15].

图3 GMT和HP-β-CDGMT在质量分数0.02%Tris和蒸馏水中释放曲线Fig.3 Comparison of release between the samples in 0.02%Tris and distilled water
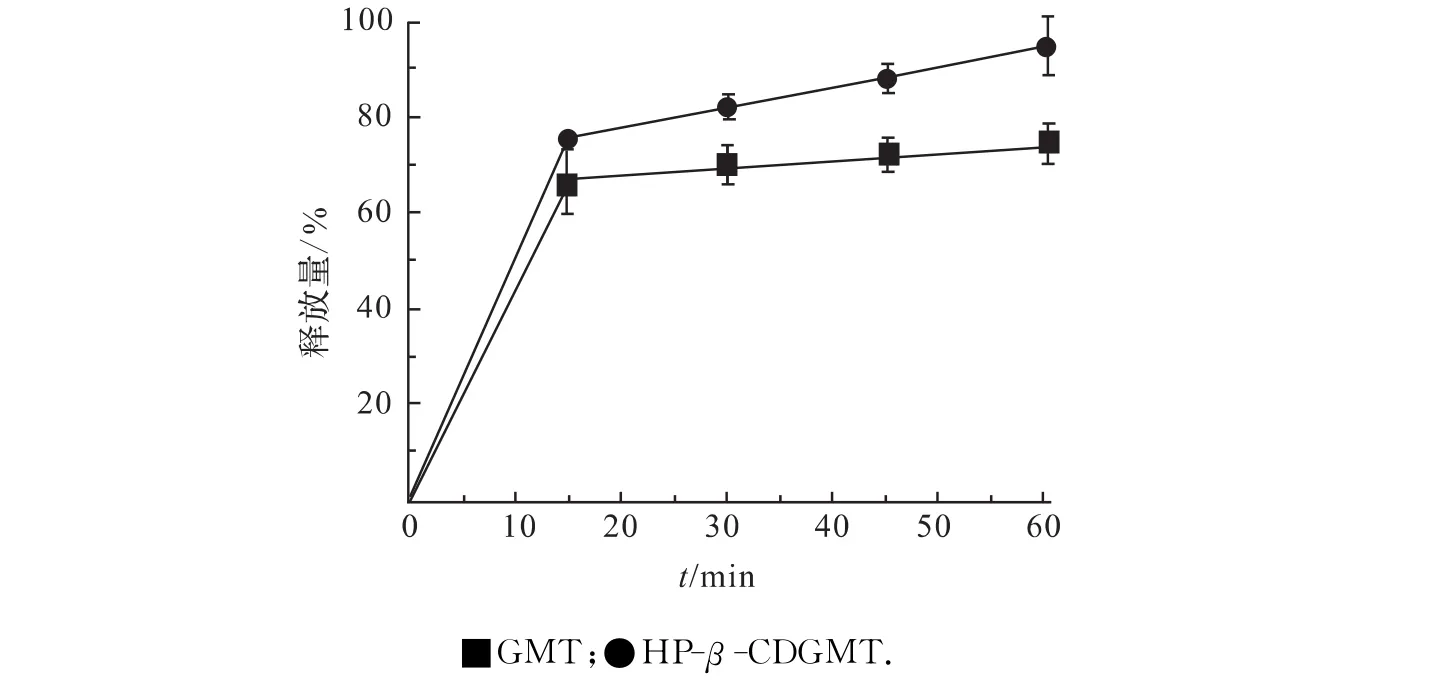
图4 GMT和HP-β-CDGMT在pH 7.8磷酸盐介质中释放曲线Fig.4 Comparison of release between the samples in pH 7.8phosphate buffer
3 结论
本文制备了格列美脲片和羟丙基-β-环糊精格列美脲片,并选用HPLC法测定格列美脲含量,分析方法准确快速.自制片的片重差异、脆碎度、含量和含量均匀度符合2010版中国药典要求,HP-β-CDGMT的溶出符合美国药典(USP 35)要求.采用等量递加研磨法混合主辅料,制备工艺简单,方便湿法制粒压片工艺且有效改善格列美脲溶出,利于规模化生产.
[1] MASSIMO M B.Glimepiride in typeⅡdiabetes mellitus:a review of the worldwide therapeutic experience[J].Clin Ther,2003,25:799 -816.
[2] AMMAR H O,SALAMA H A,GHORAB M,et al.Inclusion complexation of glimepiride in dimethyl-β-cyclodextrin[J].Asian Journal of Pharmaceutical Sciences,2007,2(2):44-55.
[3] SEEDHER N,KANOJIA M.Co-solvent solubilization of some poorly-soluble antidiabetic drugs[J].Pharmaceutical Development and Technology,2009,14(2):185-192.
[4] SEBASTJAN R,JOZE G,JULIJANA K,et al.Hyperbranched poly(esteramides)as solubility enhancers for poorly watersoluble drug glimepiride[J].Int J Pharm,2010,396:119-126.
[5] AMMAR H O,SALAMA H A,GHORAB M,et al.Formulation and biological evaluation of glimepiride-cyclodextrin-polymer systems[J].Int J Pharm,2006,309:129-138.
[6] AMMAR H O,SALAMA H A,GHORB M,et al.Implication of inclusion complexation of glimepiride in cyclodextrinpolymer systems on its dissolution,stability and therapeutic[J].Int J Pharm,2006,320:53-57.
[7] 杨文智,王芳,李海鹰,等.环糊精诺氟沙星片剂的制备及溶出度考察[J].河北大学学报:自然科学版,2012,32(4):369 -374.
YANG Wenzhi,WANG Fang,LI Haiying,et al.Preparation of(-cyclodextrin norfloxacin tablets and evaluation its dissolution rate[J].Journal of Hebei University:Natural Science Edition,2012,32(4):369-374.
[8] LAJOS S,JOZSEF S.Highly soluble cyclodextrin derivatives:chemistry,properties and trends in development[J].Adv Drug Deliv Rev,1999,36(1):17-28.
[9] 陶涛.羟丙基倍他环糊精的特性及其药剂学应用[J].中国医药工业杂志,2002,33(6):304-307.
TAO Tao.Characteristics and pharmaceutical applications of hydroxypropyl beta cyclodextrin[J].Chinese Journal of Pharmaceuticals,2002,33(6):304 -307.
[10] 高立军,王维贤,魏君,等.格列美脲片溶出方法的研究[J].药物分析杂志,2002,22(6):486-487.
GAO Lijun,WANG Weixian,WEI Jun,et al.Investigation on the method of dissolution of glimepiride tablets[J].Chinese Journal of Pharmaceutical Analysis,2002,22(6):486-487.
[11] 杨晓菊,谢沐风.不同厂家格列美脲片溶出度的比较[J].中国医药工业杂志,2008,39(10):758 -761.
YANG Xiaoju,XIE Mufeng.Dissolution of different brands of glimepiride tablets[J].Chinese Journal of Pharmaceuticals,2008,39(10):758-761.
[12] KIRAN T,SHASTRI N,RAMAKRISHNA S,et al.Surface solid dispersion of glimepiride for enhancement of dissolution rate[J].Int J Pharm Tech Res,2009,1(3):822 -831.
[13] 梅兴国.微载体药物递送系统[M].武汉:华中科技大学出版社,2009.
MEI Xingguo.Microcarrier drug delivery system[M].Wu Han:Huazhong University of Science and Technology Press,2009.
[14] RIEKES M K,TAGLIARI M P,GRANADA A,et al.Enhanced solubility and dissolution rate of amiodarone by complexation withβ-cyclodextrin through different methods[J].Materials Science and Engineering C,2010,30(7):1008-1013.
[15] 卢毅,张彤,陶建生,等.京尼平-β-环糊精包合物制备工艺研究[J].中国药学杂志,2008,43(20):1568 1573.
LU Yi,ZHANG Tong,TAO Jiansheng,et al.Study on preparation process of inclusion complex of genipin-β-cyclodextrin[J].Chinese Pharmaceutical Journal,2008,43(20):1568 -1573.
(责任编辑:梁俊红)
Preparation and dissolution rate evaluation of glimepiride tablets
LI Haiying1,2,YANG Wenzhi1,MA Lilan1,LI Xiaxia1,SHEN Shigang2
(1.College of Pharmaceutical Sciences,Hebei University,Baoding 071002,China;
2.College of Chemistry and Environmental Science,Hebei University,Baoding 071002,China)
In order to improve the dissolution rate of glimepiride,the technology of preparation glimepiride tablets was optimized.HP-β-cyclodextrin glimepiride mixture complex were prepared by kneading and wet granulation method.The optimal prescription of glimepiride tablets was pregelatinized starch mixing microcrystalline cellulose,5%L-HPC,10%starch slurry and magnesium stearate using as diluents,disintegrants,adhensives and lubricants respectively.The results of the tablet weight differences,breakage,content and content uniformity accorded with Chinese Pharmacopoeia(2010).The dissolution rate of HP-β-cyclodextrin glimepiride tablets was higher than that of glimepiride tablets,and was in accord with the requirements of USP 35.Moreover,the preparation process was simply in technology.
glimepiride;HP-β-cyclodextrin;wet granulation;dissolution rate
R944.4
A
1000-1565(2014)05-0491 -06
10.3969/j.issn.1000 -1565.2014.05.009
2014-04 -10
河北省科技计划项目(13272705);河北大学精品实验项目2014
李海鹰(1973-),女,内蒙古集宁人,河北大学副教授,在读博士研究生,主要从事药物分析及药物制剂方面的研究.lihylihy@163.com

